钠钾ATP酶抑制剂通过调节DNA损伤感应复合体Mre11/Rad50/Nbs1的表达诱导肝癌HepG2细胞周期阻滞
徐忠伟,王凤梅,王聪聪,单娜娜,徐瑞成,3
(1.中国人民武装警察部队后勤学院,天津 300309;2.天津市第三中心医院,天津 300170;3.天津市职业与环境危害生物标志物重点实验室,天津 300309)
钠钾ATP酶抑制剂通过调节DNA损伤感应复合体Mre11/Rad50/Nbs1的表达诱导肝癌HepG2细胞周期阻滞
徐忠伟1,王凤梅2,王聪聪1,单娜娜1,徐瑞成1,3
(1.中国人民武装警察部队后勤学院,天津 300309;2.天津市第三中心医院,天津 300170;3.天津市职业与环境危害生物标志物重点实验室,天津 300309)
目的 研究钠钾ATP酶抑制剂华蟾毒配基(cinobufa-gin)对人肝癌HepG2细胞DNA损伤修复阻断及其发生机制。方法 免疫组化分析人肝癌临床组织标本、正常肝组织中钠钾ATP酶α1亚单位的表达;以人肝癌细胞HepG2为靶细胞,实验分为对照组、5 μmol·L-1华蟾毒配基作用6、12 和24 h组;单细胞电泳检测DNA双链断裂,Real time-PCR 和Western blot检测损伤修复基因Mre11、Rad50、Nbs1和p53的表达变化,流式细胞术检测细胞周期。结果 肝癌组织钠钾ATP酶α1亚单位表达与癌旁组织相比明显升高(P<0.05);华蟾毒配基诱导HepG2细胞DNA断裂的发生率与作用时间高度相关,作用时间延长断裂效应更加明显(P<0.05),Mre11,Nbs1,Rad50和p53表达随药物作用时间延长逐渐升高(P<0.05),流式细胞术分析细胞周期对照组S期细胞比例为(21.32±4.21)%,5 μmol·L-1华蟾毒配基处理6 h后为(33.25±5.72)%,处理12 h后为(56.72± 6.29)%,作用24 h后为(67.32±9.42)%。结论 华蟾毒配基激活Mre11/Rad50/Nbs1损伤感应复合体介导肝癌HepG2细胞周期阻滞。
华蟾毒配基;HepG2细胞;DNA双链断裂;钠钾ATP酶;细胞周期;细胞周期相关蛋白
原发性肝癌(简称肝癌)是临床中最常见的恶性肿瘤之一。蟾酥为宝贵的中药之一,已被作为药物使用近千年,《本草纲目》记载“蟾酥,疗疳积,消臌胀,解疔毒之药也”。而华蟾毒配基(cinobufagin)是中药蟾酥的主要抗癌活性成分之一,目前是我国临床治疗中晚期肝癌的首选中药制剂,药物作用靶点为细胞膜表面钠钾ATP酶(Na+,K+-ATPase)[1]。研究证实非小细胞肺癌、神经胶质瘤、肝细胞癌和乳腺癌等肿瘤细胞中钠钾ATP酶呈现高表达状态,参与调控肿瘤细胞的发生和发展[2-3]。前期的研究显示华蟾毒配基可下调肝癌细胞周期蛋白A(cyclin A)表达引发细胞周期S期阻滞现象[4-5]。然而蟾酥制剂在治疗肝癌中的作用机制仍然不明确。因此,研究华蟾毒配基抑制肝癌细胞生长,探讨其作用机制,意义重大。
1 材料与方法
1.1 材料与试剂 人肝癌细胞株HepG2购自协和基础医学院细胞库,华蟾毒配基为Sigma公司产品,无水乙醇溶解成母液,浓度为1 mmol·L-1,-20℃避光保存;H-DMEM培养基,胎牛血清购自Gibco公司。TRIzol为Invitrogen公司产品;四甲基偶氮唑盐(MTT)、碘化丙啶(PI)和二甲基亚砜(DMSO)购自于Sigma公司;PrimeScriptTMRT逆转录试剂购自于TaKaRa公司;SYBR GreenⅠ染料为Roche公司产品,一抗兔抗人Mre11、Nbs1、Rad50和p53单克隆抗体购自Abcam公司,二抗和ECL化学发光试剂购自KPL公司。
1.2 免疫组化检测肝癌组织与肝癌旁组织中钠钾ATP酶α1亚单位表达 90例肝癌与癌旁组织样本,年龄(49.8±8.8),均为原发性肝癌肿瘤。常规处理,石蜡包埋切片,高压蒸汽抗原修复,3%H2O2室温孵育30 min;兔血清封闭10 min,Na+,K+-AT-Pase α1羊单克隆抗体,4℃孵育过夜,二抗室温孵育30 min,3,3-二氨基联苯胺(DAB)显色5 min,冲洗,乙醇脱水,二甲苯透明,中性树脂封片,每张切片随机选取3个视野LeicaBM2500拍照,图像数据由Im-age-Pro Plus 6.0软件分析,测量阳性结果区域面积和积分光密度值,计算样本的平均光密度值,分析肝癌与癌旁组织中Na+,K+-ATPase α1亚单位表达水平。
1.3 单细胞电泳检测DNA双链断裂程度 实验分组同前,第1层胶制作:取0.5%常温熔点琼脂糖溶液熔化后包被载玻片,冷却充分凝固。第2层胶制作:100 μL 0.5%低熔点琼脂糖溶液中混合500个细胞,均匀滴在第1层胶上,充分冷却。玻片浸入预冷裂解液[10 mmol·L-1Tris-HCl(pH 7.5)2.5 mol·L-1NaC1,100 mmol·L-1四甲基乙二胺四乙酸二钠,1%Triton X-100和10%二甲基亚砜],4℃,2 h。置于水平电泳槽中,加入电泳液(1 mmol· L-1四甲基乙二胺,300 mmol·L-1氢氧化钠),静置20 min,25 V电泳30 min。25 g·L-1碘化丙啶(PI)75 μL染色,荧光显微镜下观察结果。采用CASP1.2软件分别计算彗星头部和尾部积分面积(Head Area和Tail Area)与荧光强度(Head DNA and Tail DNA Amount),计算各自荧光密度值,同时检测彗星尾部迁移长度(Tail Moment)。通过分析彗星头部光密度值和彗星尾部长度与荧光密度值评估DNA损伤。
1.4 RNA提取和Real time-PCR检测Mre11、Nbs1、Rad50和p53 mRNA表达 实验分组同前,TRIzol法提取细胞总RNA,按PrimeScriptTMRT试剂反转录合成cDNA。反应体系为20 μL(上、下游引物各1 μL,模板1 μL,SYBR green试剂4 μL,ddH2O 12 μL)。引物序列见Tab 1,反应条件:95℃变性10 min:95℃变性5 s,65℃退火15 s,72℃延伸15 s,共40个循环。通过相对定量法(2-△△Ct)分析实验组目的基因表达丰度。

Tab 1 Sequences of PCR primers
1.5 Western blot法检测Mre11、Nbs1、Rad50和p53蛋白表达 实验分组同前,蛋白印迹实验参考以前方法[6],每组60 μg蛋白通过10%SDS-PAGE分离,Bio-rad半干转印系统转膜,经抗体孵育,经ECL液化学发光,暗室X线曝光、显影、定影。Bandscan 5.0软件进行灰度值分析。
1.6 流式细胞术检测细胞周期 接种1×105个HepG2细胞,培养24 h后加药,实验分组同前,药物作用6、12和24 h后,收集细胞,75%冷乙醇固定,PBS洗1次,加入终浓度为50 mg·L-1RNA酶和5 g·L-1碘化乙啶(PI)溶液,孵育20 min,流式细胞仪检测细胞周期变化。
2 结果
2.1 人肝癌组织与正常肝组织钠钾ATP酶α1亚单位的差异化表达 通过IPP6.0软件分析肝癌与癌旁组织中钠钾ATP酶α1亚单位表达的平均光密度。Fig 1显示,肝癌组织钠钾ATP酶α1亚单位密度值为184.74±17.22,癌旁组织为67.21± 8.41,肝癌组织中钠钾ATP酶α1亚单位与正常肝脏癌旁组织相比呈现高表达状态,差异有统计学意义(P<0.05)。

Fig 1 Expression level of Na+,K+-ATPase α1 subunit in normal liver tissues and hepatoma tissue by|Immunohistochemistry(×400)
2.2 华蟾毒配基诱发HepG2细胞DNA双链断裂5 μmol·L-1华蟾毒配基可引起HepG2细胞DNA损伤(Fig 2)。药物组细胞电泳后可见彗星状拖尾,对照组呈现明亮的圆点无拖尾,经CASP 1.2软件分析测量对照组彗星头部荧光强度为84.21± 9.76,尾部荧光强度4.87±0.58,彗星无拖尾迁移现象发生;药物作用6、12和24h后,头部荧光强度
分别为43.2±5.32、38.46±5.74、18.52±3.21,尾部荧光强度分别为23.2±3.12、31.46±4.64、38.52 ±6.21;彗星尾部长度依次为(26.21±2.47)、(28.42±3.14)、(31.22±5.31)μm,差异具有统计学意义(P<0.05)。研究证实,5 μmol·L-1华蟾毒配基可诱发HepG2细胞DNA双链断裂。
2.3 华蟾毒配基对HepG2细胞DNA损伤感应基因Mre11、Nbs1、Rad50和p53 mRNA表达的影响通过相对定量法(2-△△Ct)计算各实验组HepG2细胞的相关基因表达(Tab 2),5 μmol·L-1华蟾毒配基作用HepG2细胞6、12和24 h 3个检测点中,Mre11基因水平分别是对照组的1.29、2.53和7.67倍;Nbs1基因水平分别是对照组的1.16、1.34和1.72倍;Rad50基因水平分别是对照组的1.49、2.97和3.71倍;p53基因水平分别是对照组1.37、3.58和5.94倍。结果显示,5 μmol·L-1华蟾毒配基可明显上调DNA损伤感应相关基因Mre11、Rad50、Nbs1和p53 mRNA表达(P<0.05)。

Fig 2 Levels of DNA double-strand breaks in HepG2 cells treated with 5 μmol·L-1 cinobufagin for different time by SCGE(×400)
Tab 2 Mre11,Nbs1,Rad50 and p53 detected in HepG2 treated with 5 μmol·L-1cinobufogenin by Real time PCR±s)
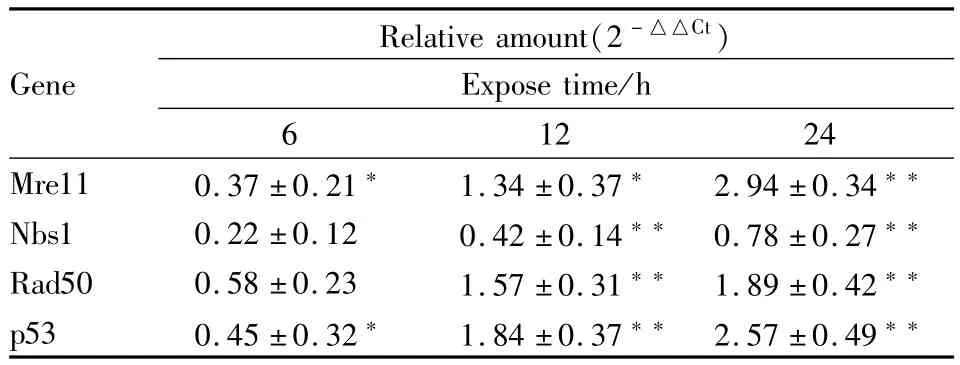
Tab 2 Mre11,Nbs1,Rad50 and p53 detected in HepG2 treated with 5 μmol·L-1cinobufogenin by Real time PCR±s)
*P<0.05;**P<0.01 vs control group
Relative amount(2-△△Ct)Gene Expose time/h 6 12 24 Mre11 0.37±0.21* 1.34±0.37* 2.94±0.34**Nbs1 0.22±0.12 0.42±0.14** 0.78±0.27**Rad50 0.58±0.23 1.57±0.31** 1.89±0.42**p53 0.45±0.32* 1.84±0.37** 2.57±0.49**
2.4 华蟾毒配基对HepG2细胞DNA损伤感应基因Mre11、Nbs1、Rad50和p53蛋白表达的影响Western blot结果显示(Fig 3),与对照组细胞相比,5 μmol·L-1华蟾毒配基作用HepG2细胞后,可上调DNA损伤感应基因Mre11、Nbs1、Rad50和p53蛋白表达,差异有统计学意义(P<0.05),以作用24 h处理组差异更为明显(P<0.01)。
2.5 流式细胞仪检测HepG2细胞周期变化 Fig 4所示,流式细胞术分析细胞周期对照组S期细胞比例为(21.32±4.21)%,5 μmol·L-1华蟾毒配基处理6 h后为(33.25±5.72)%,处理12 h后为(56.72±6.29)%,作用24 h后为(67.32± 9.42)%,结果显示5 μmol·L-1华蟾毒配基引起HepG2细胞发生S期阻滞现象,差异具有统计学意义(P<0.05)。

Fig 3 Mre11,Nbs1,Rad50 and p53 protein levels in HepG2 treated with 5 μmol·L-1cinobufagin for different time by Western blot

Fig 4 Effect of cell cycle on HepG2 cells treated with 5 μmol·L-1cinobufogenin for different time by flow cytometry
3 讨论
蟾酥及相关制剂作为抗肿瘤中药在我国广泛用于肝癌、结肠癌、乳腺癌和胃癌等恶性肿瘤的中晚期治疗,疗效显著,蟾酥的主要抗癌有效成分为蟾毒配基类,如华蟾毒配基(cinobufagin)和蟾蜍灵(bufa-lin)等,属于强心甾类固醇(cardiotonic steroids,CTS)。以华蟾素(混合制剂)为代表的药物在市场中占有重要份额,国际上关于CTS抗癌作用研究取得重要进展,比利时从非洲植物大牛角瓜中提取的CTS经半合成得到的新型钠钾ATP酶抑制剂UN-BS1450,作为高活性抗癌药进入欧洲临床,显示了巨大潜力[7-9]。
研究显示[1-3],钠钾ATP酶α1亚单位在正常组织和肿瘤组织呈现出差异化表达,在人前列腺癌PC-3、DU-145细胞系,非小细胞肺癌A549细胞系,神经胶质瘤Hs683、U373-MG、U87-MG和T98G细胞系中钠钾ATP酶α1亚单位都呈现出高表达状态,课题组研究发现在肝癌组织中钠钾ATP酶α1亚单位亦呈现高表达状态,我们前期应用哇巴因与华蟾毒配基作用肝癌细胞后,细胞内游离Ca2+和氧自由基(reactive oxygen species,ROS)浓度增加,损伤细胞DNA,以Cyclin D1为代表的细胞周期调控蛋白生成减少和细胞周期抑制因子p21CIP1引起细胞周期S期阻滞。华蟾毒配基可抑制钠钾ATP酶活性,继发性引起细胞内K+浓度减少,同时伴随Na+浓度增加,从而使细胞膜Na+-Ca2+交换器启动,诱发细胞内Ca2+持续性升高,破坏线粒体膜电位,氧自由基浓度升高。这些细胞内离子物质是损伤细胞DNA的主要物质[10-12]。
由细胞DNA损伤转变成细胞周期阻滞信号并引起周期阻滞过程,主要有DNA损伤的识别(感受损伤)和效应蛋白分子变化(效应器蛋白)两个部分构成[13-14]。本研究发现华蟾毒配基可引起肝癌细胞DNA分子双链断裂,损伤感受蛋白Mre11,Nbs1 和Rad50基因和细胞周期负调控因子p53表达上调。而Mre11/Rad50/Nbs1(MRN)复合体能将检测到的DNA损伤的情况传递给效应器蛋白分子ATM激酶,其对DNA双链断裂产生应答反应,可将信息传导到p53蛋白,p53激活,半衰期延长,促进p21CIP1表达,p21CIP1与CyclinA/CDK2/PCNA激酶复合体结合,抑制其活性,产生细胞出现S期阻滞现象,争取更多的修复时间,在修复无法完成时细胞走向最终的凋亡途径。
综上所述,以华蟾毒配基为代表的钠钾ATP酶抑制因子可能将成为一类新的抗肝癌候选药物,通过破坏癌细胞离子平衡、能量供应,损伤癌细胞DNA分子,引起细胞周期阻滞,诱导细胞凋亡。
(致谢:本文实验在武警后勤学院中心实验室完成,徐瑞成主任为研究项目国家自然科学基金项目负责人,徐忠伟老师为主要实验操作人员,王凤梅主任负责肝癌与癌旁组织样本实验检测,王聪聪老师完成实验数据统计分析与论文审校工作。)
[1] Fernandez-Moncada I,Barros L F.Non-preferential fuelling of the Na(+)/K(+)-ATPase pump[J].Biochem J,2014,460(3):353-61.
[2] Magpusao A N,Omolloh G,Johnson J,et al.Cardiac glycoside activities link Na(+)/K(+)ATPase ion-transport to breast cancer cell migration via correlative SAR[J].ACS Chem Biol,2015,10(2):561-9.
[3] Mijatovic T,Roland I,Van Quaquebeke E,et al.The α1 subunit of the sodium pump could represent a novel target to combat non-small cell lung cancers[J].J Pathol,2007,212(2):170-9.
[4] Lefranc F,Kiss R.The sodium pump α1 subunit as a potential target to combat apoptosis-resistant glioblastomas[J].Neoplasia,2008,10(3):198-206.
[5] 高默洁,徐忠伟,王凤梅,等.钠钾泵抑制剂通过调节细胞周期相关蛋白的生成介导肝癌HepG2细胞周期S期阻滞与凋亡[J].中国药理学通报,2010,26(4):452-6.
[5] Gao M J,Xu Z W,Wang F M,et al.The linkage between cell cycle S phase arrest and apoptosis on human hepatocellular carcinoma HepG2 induced by Na+,K+-ATPase inhibitors via regulating pro-teins associated with cell cycle[J].Chin Pharmacol Bull,2010,26(4):452-6.
[6] 买 霞,徐忠伟,陈小义,等.土槿乙酸抑制人卵巢癌SKOV_3细胞增殖并诱导G_2/M期阻滞[J].中国药理学通报,2012,28(4):508-12.
[6] Mai X,Xu Z W,Chen X Y,et al.Growth inhibition and G2/M phase arrest in human ovarian cancer SKOV3 cells induced by pseudolaric acid B[J].Chin Pharmacol Bull,2012,28(4):508 -12.
[7] Xu Z W,Wang F M,Gao M J,et al.Targeting the Na+/K+-ATPase α1 subunit of hepatoma HepG2 cell line to induce apopto-sis and cell cycle arresting[J].Biol Pharm Bull,2010,33(5):743-51.
[8] Mijatovic T,Van Quaquebeke E,Delest B,et al.Cardiotonic steroids on the road to anti-cancer therapy[J].Biochimica Bio-physica Acta,2007,1776(1):32-57.
[9] Prassas I,Diamandis EP.Novel therapeutic applications of cardiac glycosides[J].Nat Rev Drug Discov,2008,7(11):926-35.
[10]徐瑞成,王 娜,徐忠伟,等.哇巴因抑制钠泵β1亚单位和VE-cadherin减弱血管内皮细胞连接功能[J].中国药理学通报,2008,25(8):701-5.
[10]Xu R C,Wang N,Xu Z W,et al.Ouabain reduces the function of cell junction in vascular endothelial cells through inhibiting the ex-pression of Na+,K+-ATPase β1 subunit and VE-cadherin[J].Chin Pharmacol Bull,2008,25(8):701-5.
[11]徐瑞成,张 敏.哇巴因信号的传递及其对细胞生长和死亡的影响[J].中国药理学通报,2005,21(2):149-52.
[11]Xu R C,Zhang M.The ouabain signal transduction and its role in cell growth and death[J].Chin Pharmacol Bull,2005,21(2):149-52.
[12]陈小义,徐忠伟,王 娜,等.哇巴因对血管内皮细胞ECV304细胞凋亡及胞内游离钙离子和活性氧浓度的影响[J].中国药理学与毒理学杂志,2010,24(4):241-8.
[12]Chen X Y,Xu Z W,Wang N.Effect of ouabain on human vascu-lar endothelial ECV304 cell apoptosis and on concentrations of in-tracellular free calcium ion and reactive oxygen species[J].Chin J Pharmacol Toxicol,2010,24(4):241-8.
[13]Deng Y,Guo X,Ferguson D O,et al.Multiple roles for MRE11 at uncapped telomeres[J].Nature,2009,460(7257):914-8.
[14]Hopfner K P.DNA double-strand breaks come into focus[J].Cell,2009,139(1):25-7.
Na+,K+-ATPase inhibitor induces cell cycle arrest in liver cancer HepG2 cells by regulating expression of DNA damage Mre11/Rad50/Nbs1 complex
XU Zhong-wei1,WANG Feng-mei2,WANG Cong-cong1,SHAN Na-na1,XU Rui-cheng1,3
(1.Logistics University of People’s Armed Police Force,Tianjin 300309,China;2.Dept of Gastroenterology and Hepatology,Tianjin Third Central Hospitaln,Tianjin 300170,China;3.Tianjin Key Laboratory for Biomarkers of Occupational and Environmental Hazard,Tianjin 300309,China)
Aim To explore the relationship between Mre11/Rad50/Nbs1(MRN)complex focus formation and DNA double-strand breaks(DSBs)caused by cinob-ufagin in human hepatocellular carcinoma HepG2 cells.Methods The Na+,K+-ATPase α1 subunit expression level in liver cancer tissues was detected by immunohis-tochemistry.After HepG2 cells were treated with 5 μmol·L-1cinobufagin for 6,12 and 24 h,the drug-in-duced DSBs were assessed by single cell gel electro-phroesis(SCGE),the gene transcription and protein levels of Mrel1,Nbs1,Rad50 and p53 were evaluated by Real time-PCR and Western blot.The cell cycle in parallel was analyzed by flow cytometry.Results The Na+,K+-ATPase α1 subunit expression level in liver cancer tissues was significantly increased compared with the tissue adjacent to carcinoma(P<0.05).The 5 μmol·L-1cinobufagin could induce the DSBs in a time-dependent manner(P<0.05),and it could up-regulate the gene expression levels of Mre11,Nbs1,Rad50 and p53 in HepG2 cells(P<0.05).The pro-portions of HepG2 cells in S phase were(21.32± 4.21)%in the control group,and(33.25±5.72)%,(56.72±6.29)%and(67.32±9.42)%in HepG2 cells treated with 5 μmol·L-1cinobufagin for 6,12 and 24 h,respectively.The proportions of cells in S phase in cinobufagin groups were significantly increased compared with the control group(P<0.05).Conclu-sion Cinobufagin could induce the cell cycle arrest in liver cancer HepG2 cells by activation of Mre11/Rad50/Nbs1 Complex.
cinobufagin;HepG2 cells;DNA double-strand breaks;Na+,K+-ATPase;cell cycle;cell cycle associated proteins
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.012.html
10.3969/j.issn.1001-1978.2016.03.006
A
1001-1978(2016)03-0323-05
R284.1;R282.74;R329.28;R342.3;R735.7;R977.3;R979.1
2015-11-09,
2015-12-24
国家自然科学基金资助项目(No 81273552);武警后勤学院博士启动金项目(No WHB201501)
徐忠伟(1980-),男,博士,讲师,研究方向:中药药理学,Tel:022-84876424,E-mail:xzw113@hotmail.com;徐瑞成(1968-),男,硕士,教授,研究方向:细胞信号转导,通讯作者,Tel:022-84876451,E-mail:xu_rc@sohu.com