大黄酸调控Rac1/LIMK1/cofilin信号通路抑制卵巢癌细胞运动与侵袭
唐 敏,李 鸿,周国梅,谢一泓,阮和云,黎丹戎
(广西医科大学附属肿瘤医院,广西南宁 530021)
大黄酸调控Rac1/LIMK1/cofilin信号通路抑制卵巢癌细胞运动与侵袭
唐 敏,李 鸿,周国梅,谢一泓,阮和云,黎丹戎
(广西医科大学附属肿瘤医院,广西南宁 530021)
目的 探讨大黄酸对卵巢癌淋巴结高转移SKOV3-PM4细胞运动和侵袭能力的影响,揭示大黄酸调控Rac1/LIMK1/cofilin信号通路与抑制卵巢癌细胞运动侵袭作用的机制。方法 划痕实验观察大黄酸对卵巢癌细胞运动的影响,Matrigel-Transwell方法检测细胞侵袭能力,激光共聚焦扫描显微镜和扫描电镜观察大黄酸对卵巢癌细胞形态和细胞骨架超微结构的影响,Western blot分别检测Rac1/LIMK1/cofilin通路上Rac1、LIMK1、PAK1、cofilin蛋白的表达。结果与空白对照组相比,大黄酸能抑制SKOV3-PM4细胞侵袭和迁移能力,浓度为8.8、17.60、26.40 μmol·L-1的大黄酸处理24 h后,细胞体外迁移和侵袭能力均明显下降(P<0.05);细胞出现伪足减少,细胞内微丝断裂、分布紊乱,质膜凹凸不平、细胞间的间隙变宽等超微结构改变;Western blot结果表明大黄酸能明显下调Rac1蛋白的表达水平,并呈浓度依赖性。卵巢癌细胞经大黄酸及Rac1抑制剂处理后,磷酸化LIMK1、cofilin、PAK1蛋白水平与空白对照组比较明显下降,且大黄酸联合Rac1抑制剂处理后的磷酸化蛋白下调更为明显(P<0.05);而Rac1激活剂联合大黄酸组比大黄酸组磷酸化蛋白上调明显(P<0.05)。结论 大黄酸为潜在的Rac1小分子抑制剂,其作用机制可能是调控Rac1/LIMK1/cofilin信号通路,抑制卵巢癌淋巴结转移细胞运动和侵袭的能力。
卵巢癌;大黄酸;Rac1/LIMK1/cofilin信号通路;细胞骨架;转移与侵袭;Rac1抑制剂;Rac1激活剂
卵巢癌是女性生殖系统常见的恶性肿瘤之一,病死率居妇科恶性肿瘤首位。卵巢癌早期发病隐匿,60%患者就诊时已出现腹腔转移特别是淋巴道转移的晚期症状,且70%患者虽经过手术和放化疗但仍在2年内复发并伴有远处转移[1]。肿瘤细胞经侵袭、转移侵入外周正常组织引起癌症的扩散,是恶性肿瘤患者死亡的主要原因,近40年来卵巢癌晚期患者5年存活率所占比例不足30%。临床上卵巢癌常以直接蔓延和种植播散的方式侵袭子宫、骨盆和腹腔,也可经淋巴道转移至腹腔外的重要器官。淋巴结转移是卵巢恶性肿瘤的重要生物学特性,50%以上晚期卵巢癌病例发现主动脉旁和盆腔淋巴结转移。阳性淋巴结转移患者的总生存期比阴性淋巴结转移患者的总生存期明显缩短,淋巴结转移是卵巢癌患者预后不良的重要指标。而目前对淋巴结转移的治疗既无特异的靶点,更无特效的药物。临床上卵巢癌化疗所采用的铂类与紫杉醇联合化疗标准方案更多的是针对卵巢癌细胞的恶性生物学特征,现有靶向治疗药物贝伐单抗和奥拉帕尼主要是抑制血管内皮生长因子(VEGF)的生物效应和用于治疗携带BRCA突变基因的卵巢癌患者。因此,寻找卵巢癌淋巴结转移的潜在靶点,发现对卵巢癌转移具有抑制作用的药物及其作用机制具有重要的意义[2]。
大量研究发现[3],Rac1具有潜在的转化和致细胞癌变能力,直接参与肿瘤的发生、发展过程。低血清培养的细胞内,若持续表达活化的Rac1能促进细胞的生长,接种到裸鼠体内可导致肿瘤形成,异常活化的Rac1能启动肿瘤细胞无限增殖、侵润和转移的特性。Rac1/LIMK1/cofilin信号通路中Rac1可通过PAK1激活LIMK1,调节细胞骨架蛋白,参与微丝肌动蛋白应力纤维和黏着斑形成,调节微丝骨架系统从而影响肿瘤细胞的迁移与转移。文献报道大黄酸(Rhein,4,5-Dihydroxyanthraquinone-2-car-boxylicacid)能抑制乳腺癌、结肠癌和肺癌细胞等多种肿瘤细胞的增殖和促进肿瘤细胞的凋亡[4]。本课题组前期发现,大黄酸对淋巴结高转移的卵巢癌细胞具有明显的生长增殖抑制作用,但其抑制细胞的运动和侵袭能力的作用机制及涉及的信号传导通路尚不清楚。因此本文采用具有淋巴结高转移的卵巢癌细胞SKOV3-PM4进行体外实验,观察大黄酸靶向调控Rac1/LIMK1/cofilin信号通路的作用,为发现抑制肿瘤细胞侵袭转移的先导化合物和治疗卵巢癌新靶点提供实验依据。
1 材料与方法
1.1 材料 大黄酸(南京朗泽医药科技有限公司),以二甲亚砜(DMSO)(北京索莱宝公司)溶解至17.60mmol·L-1,常温保存。RPMI 1640(美国Hyclon公司);胎牛血清(美国Gibco公司);兔多克隆Phospho-cofilin(Ser3)抗体(美国Cell Signaling公司);鼠单克隆抗体LIMK1、兔多克隆抗体LIMK1 (phospho T508)、兔多克隆PAK1、兔多克隆PAK1 (phospho T212)、兔多克隆cofilin抗体、GAPDH内对照抗体、二抗(美国Abcam公司);鼠单克隆抗体Rac1(美国Millipore公司);Matrigel基质胶(BD公司);ActinGreenTM488 ReadyProbes®Reagent(美国life公司);DAPI染液和抗荧光淬灭封片剂(上海碧云天公司);Rac1抑制剂NSC23766(美国Selleck公司);Rac1激活剂PMA(美国Cayman化工公司)。
1.2 细胞处理 人卵巢癌淋巴结定向高转移细胞系(SKOV3-PM4)为本课题组构建,并经生物学鉴定[5]。人卵巢癌淋巴结高转移细胞(SKOV3-PM4)常规培养于含有10%的胎牛血清RPMI 1640培养液中,置于37℃、5%CO2饱和湿度培养箱中培养。取指数生长细胞,待细胞生长密度达90%以上进行实验,实验共分2组:空白对照组(DMSO的浓度低于2.5 ml·L-1)和不同浓度加药处理组(药物浓度对细胞的抑制率均低于10%)。
1.3 细胞体外迁移能力测定 在6孔板中加入呈指数生长的SKOV3-PM4细胞悬液,贴壁形成单层细胞后,用消毒后的200 μL枪头均匀划2条竖线,用PBS洗细胞3次,去除悬浮的细胞。每组每孔分别加入对细胞生长抑制率低于10%的3个浓度梯度,即含终浓度为8.80、17.60、26.40 μmol·L-1的大黄酸的无血清培养基。在37℃、5%CO2培养箱孵育0、12、24、48 h后,在显微镜下拍照,测量划痕闭合宽度。
1.4 细胞体外侵袭能力测定 取对数生长期的细胞分别经终浓度为8.80、17.60、26.40 μmol·L-1大黄酸的无血清培养基培养24 h,消化各组细胞制成单细胞悬液并计数,每孔2×107个/升,重复3孔,分别接种于含Matrigel胶的Transwell小室上层,在下层小室加入含有10%胎牛血清的RPMI 1640完全培养基。37℃、5%CO2孵育24 h后取出滤膜,擦去Matrigel胶,甲醇固定15 min,苏木精染色10 min。显微镜观察并计数穿膜细胞数。
1.5 扫描电镜观察细胞的超微结构变化 取细胞浓度为2×107个·L-1对数生长期的细胞制备细胞爬片,每孔分别加入终浓度为8.80、26.40 μmol· L-1大黄酸的无血清培养基,在37℃、5%CO2培养箱孵育2、6、12 h后,弃培养液,PBS快速清洗1遍,预冷3%戊二醛固定10 min,PBS清洗3×10 min,50%酒精脱水10 min,70%酒精脱水至少4h等处理,在扫描电镜下观察细胞形态和细胞骨架超微结构变化。
1.6 激光共聚焦扫描显微镜观察细胞骨架的变化取对数生长期的SKOV3-PM4细胞,将细胞浓度调整为2×107个·L-1制备细胞爬片,每孔分别加入终浓度为8.80、26.40 μmol·L-1大黄酸的无血清培养基,在37℃、5%CO2培养箱孵育12 h后,弃培养液,PBS快速清洗1遍,4%多聚甲醛固定后,PBS清洗3次,每次10 min,并用0.5%Triton X-100透膜室温孵育3 min;PBS洗涤后加入ActinGreenTM488 ReadyProbes®Reagent标记F-actin,室温避光孵育120 min,PBS洗涤3次,DAPI染色剂避光孵育10 min后,PBS洗涤3次,使用抗荧光淬灭剂封片。采用激光共聚焦扫描显微镜观察细胞形态及细胞骨架变化情况。
1.7 Western blot检测Rac1、cofilin、P-cofilin、LIMK1、P-LIMK1、PAK1、P-PAK1蛋白的表达水平 对数生长期的SKOV3-PM4细胞分别经不同浓度的大黄酸、Rac1抑制剂、Rac1激活剂、大黄酸联合Rac1抑制剂、大黄酸联合Rac1激活剂孵育细胞12 h后,收集细胞并裂解,提取蛋白,采用BCA法测定蛋白浓度。取蛋白(60~100)μg加入上样缓冲液混匀后,进行SDS-PAGE电泳。电泳结束后,冰浴150 mA恒流条件下电转150 min,将蛋白转移到PVDF膜上后用封闭液封闭PVDF膜至少2 h,以Rac1(1∶250)、cofilin(1∶250)、P-cofilin(1∶200)、LIMK1(1∶500)、P-LIMK1(1∶100)、PAK1 (1∶500)、P-PAK1(1∶250)或GAPDH一抗(1∶6 000),于摇床孵育PVDF膜4℃过夜,PBST洗膜3次,每次5 min。于辣根过氧化物酶共价的二抗(1∶2 000)室温孵育PVDF膜2 h,PBST洗膜3次,每次10 min,后滴入化学发光液,凝胶图像处理系统观察并分析结果。
1.8 统计学方法 采用Adobe Photoshop软件进行图像处理;SPSS 16.0统计学软件对各实验结果进行分析。数据用±s表示,多组比较采用方差分析;细胞划痕实验的数据采用重复测量方差分析。
2 结果
2.1 细胞体外迁移能力测定 采用细胞划痕实验检测了不同浓度的大黄酸处理后,对SKOV3-PM4细胞迁移的距离进行测量分析,大黄酸能抑制细胞的迁移,而且呈时间和剂量的依赖效应。浓度越高、孵育时间越长,细胞的迁移能力越弱(Fig 1)。

Fig 1 Effect of Rhein on migrating ability of SKOV3-PM4 cells
2.2 细胞体外侵袭能力测定 SKOV3-PM4细胞经大黄酸0、8.80、17.60、26.40 μmol·L-1浓度药物处理24 h后,穿膜细胞数目分别为(37.8±1.72)、(25.4±1.84)、(16.6±1.85)和(12.6±2.57)。经不同浓度的大黄酸处理SKOV3-PM4,随着药物浓度的升高,体外迁移能力随之明显降低(P<0.05,P<0.01),见Fig 2。
2.3 扫描电镜结果 电镜观察结果可见,未经大黄酸处理的SKOV3-PM4细胞形态多样,表面有丰富的纤毛和伪足(Fig 3红色箭头所示),细胞表面有具有纵横交错的皱褶,呈指状或嵴状突起。与空白组相比,浓度8.80 μmol·L-1大黄酸处理的细胞纤毛和伪足变化不明显,而浓度为26.40 μmol·L-1大黄酸处理12h后细胞收缩明显,出现圆钝样突起,纤毛、伪足、指状或嵴状突起均减少,细胞之间间隙变大,出现质膜边缘凹凸不平,明显翻折现象(Fig 3白色箭头所示)。
2.4 激光共聚焦扫描显微镜观察细胞骨架变化结果 分别观察SKOV3-PM4细胞经不同浓度大黄酸处理12 h后对细胞骨架的影响。细胞内绿色荧光标志为F-actin,蓝色荧光标志为细胞核。从Fig 4可见空白组的SKOV3-PM3细胞骨架微丝按细胞极性成束状分布,质膜边缘上分布着丰富细长纤毛和伪足(Fig 4红色箭头示),质膜结构完整,线条明显和细胞骨架稳固,绿色荧光强。随着药物浓度增高,纤毛伪足收缩或消失,细胞骨架微丝分布紊乱,部分微丝断裂形成点状分布于胞质中(Fig 4白色箭头示),质膜边缘凹凸不平。
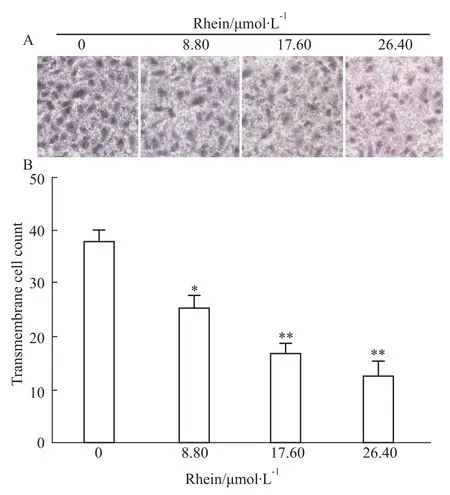
Fig 2 Inhitive of invasive ability of SKOV3-PM4 cells by Rhein
2.5 Rac1/LIMK1/cofilin信号通路上各蛋白表达情况 从Western blot检测的结果Fig 5(A1,A2)可见,随着大黄酸的浓度升高,Rac1蛋白表达逐渐降低,位于其下游的PAK1、LIMK1和cofilin的总蛋白没有明显变化,但磷酸化的PAK1、LIMK1和cofilin表达逐渐降低,且在大黄酸与Rac1抑制剂的共同作用下,磷酸化蛋白表达比单独使用大黄酸降低更明显,结果见Fig 5(B1,B2);而Rac1激活剂处理后的细胞,磷酸化的PAK1、LIMK1和cofilin蛋白表达明显增高,Rac1激活剂联合大黄酸使用与单用大黄酸相比,Rac1/LIMK1/cofilin信号通路中Rac1蛋白及相关磷酸化蛋白PAK1、LIMK1表达也升高,结果见Fig 5(C1,C2)。

Fig 3 Effect of Rhein on cell morphology of SKOV3-PM4 cells under scanning electron microscope(×2 000)
3 讨论
Rac1也称Ras相关的C3肉毒素底物1,大小约为21 ku,是Ras超家族中小分子量G蛋白的成员之一,不仅参与肿瘤新生血管形成、细胞的分化与凋亡和肿瘤细胞的运动与迁移,而且它的激活或者抑制状态,可调控下游LIM激酶、肌球蛋白轻链以及肌球蛋白轻链磷酸酶等,从而调节肌动蛋白细胞骨架动力学,影响肿瘤细胞骨架重排和促进肿瘤细胞转移、侵袭。多项研究表明LIMK1、PAK1、cofilin蛋白分子在结肠癌、乳腺癌、肺癌、卵巢癌、前列腺癌等多种肿瘤细胞中高表达,且Rho/Rock/LIMK1/cofi-lin通路上Rac1、LIMK1、PAK1、cofilin能介导肿瘤细胞的侵袭和转移[6-9]。LIMK1属于丝氨酸/苏氨酸蛋白激酶,主要参与癌细胞中微管的拆卸和侵袭转移,可被Rac1通过PAK1激活,其磷酸化状态对co-filin蛋白的活性具有不同的调控作用,充当细胞功能改变的“开关”。Cofilin是低分子肌动蛋白结合蛋白,能维持细胞形态及极性,促进胞质分裂、细胞运动与游走,参与血管新生和肿瘤的转移功能[10]。Cofilin能通过自身磷酸化位点Ser3的磷酸化和Rho家族小G蛋白Rac下游的效应分子PAK1和PAK4分别对LIMK1第508位和LIMK2第505位苏氨酸片段的磷酸化[11]而发挥作用。活化的cofilin是通过肌动蛋白(actin)骨架的解聚和聚合,使多聚体纤维状肌动蛋白(F-actin)转化为单体的球状肌动蛋白(G-actin),影响细胞片状伪足形成而影响细胞迁移。当位于上游的Rac1受到抑制时,LIMK1和PAK1磷酸化cofilin氨基端Ser3,磷酸化的cofilin活性丧失,F-actin解聚成G-actin能力减弱,从而改变细胞形态和抑制细胞的运动。可见cofilin调控ac-tin骨架的重塑,在肿瘤细胞的迁移中起到了中枢的作用,Rac1/LIMK1/cofilin信号通路是调控细胞迁移、运动和侵袭作用的重要途径。
本课题组前期通过建立裸鼠体内荷人卵巢癌SKOV3细胞并在其淋巴结转移灶中克隆出亚细胞系,筛选出具有淋巴结定向高转移潜能的亚克隆第四代SKOV3-PM4细胞,利用该细胞模型,我们发现大黄酸处理卵巢癌SKOV3-PM4细胞后,细胞的纤毛和伪足减少,质膜突起和膜皱褶减少,胞质局部微丝出现溶解或断裂现象,出现断裂点的点状分布等细胞形态和骨架的超微结构改变,细胞迁移和侵袭实验证实细胞的迁移和侵袭能力也随之受到抑制。同时大黄酸处理后的卵巢癌细胞Rac1蛋白表达下降,引起其下游LIMK1、PAK1和cofilin蛋白的磷酸化表达水平下调的连锁反应,尤其cofilin的磷酸化表达水平明显下降,可能是细胞向前运动能力降低的主要原因。为了明确大黄酸的抗肿瘤细胞转移的作用靶点,本研究发现大黄酸联合Rac1抑制剂,比单用大黄酸更能引起LIMK1、PAK1和cofilin蛋白的磷酸化表达水平明显下调。而Rac1激活剂联合大黄酸使用,Rac1和磷酸化LIMK1、PAK1、cofilin蛋白表达明显低于单用Rac1激活剂组和空白组,单独大黄酸处理的细胞其磷酸化LIMK1和PAK1蛋白表达低于Rac1激活剂和大黄酸的联合组,初步证实大黄酸可作为潜在的Rac1分子抑制剂,参与调控Rac1/LIMK1/cofilin信号通路,通过降低Rac1/LIMK1/co-filin通路相关蛋白磷酸化水平,引起cofilin蛋白的活性降低,影响肌动蛋白(actin)骨架的解聚和聚合,最终导致肿瘤细胞迁移和侵袭能力的降低,推测Rac1蛋白可能是调控卵巢癌细胞运动迁移能力的重要靶点。此外在实验中还观察到,大黄酸作用卵巢癌细胞后,Rac1/LIMK1/cofilin信号通路上,LIMK1、PAK1、cofilin磷酸化的蛋白表达与总蛋白表达水平相差较大,这从另一个角度说明蛋白调控呈多层次、多时空、多类型的特点。Rac1激活剂联合大黄酸与单用大黄酸比较,磷酸化cofilin的表达差异并没有统计学意义,可能是大黄酸在对抗Rac1激活剂时,还存在其他的信号通路调控机制。

Fig 4 Effect of Rhein on cytoskeleton of SKOV3-PM4 cells(×600)
大黄酸是从大黄、何首乌、虎杖等多种传统中药分离纯化的有效成分,属于蒽醌类化合物,具有抗肿瘤、抗炎和泻下等药理作用[12]。有文献报道,大黄酸能诱导舌癌、结肠癌、乳腺癌和神经胶质瘤细胞凋亡,抑制细胞增殖[13-14],能在乏氧条件下可抑制肿瘤细胞新生血管生成[15-16],Huang等[17]证实在乳腺癌细胞中大黄酸能诱导产生细胞毒性,并涉及细胞骨架调节、蛋白质折叠、糖酵解途径和转录控制的失调等过程[17]。大黄酸还可通过TLR4/NF-κB通路减少脂多糖诱导肠道损伤,降低白细胞介素(IL)-1β、IL-6、IL-8和肿瘤坏死因子α的表达[18]。而本研究结果证实,大黄酸能抑制卵巢癌细胞Rac1蛋白的表达,抑制细胞的迁移与侵袭,靶向调控Rac1/LIMK1/cofilin通路上相关蛋白磷酸化的表达水平,大黄酸可能是潜在的Rac1蛋白的小分子抑制剂。
(致谢:本文实验在广西医科大学区域性高发肿瘤早期防治研究教育部重点实验室完成,特此致谢。)
[1] 白 萍,舒 桐,孙 慧.靶向治疗对复发性耐药性卵巢癌的治疗价值[J].中国实用妇科与产科杂志,2015(03):211-6.
[1] Bai P,Shu T,Sun H.The therapeutic role of targeted therapy in the treatment for recurrent platinum-resistant ovarian cancer[J].Chin J Pract Gynecol Obstet,2015(03):211-6.
[2] 田 红,于 鹏,吴小茗,等.卵巢癌的治疗药物研究进展[J].现代药物与临床,2015(01):103-7.
[2] Tian H,Yu P,Wu X M,et al.Research progress on drugs in treat-ment of ovarian cancer[J].Drugs Clin,2015(01):103-7.
[3] 雷艳萍,何 洁,苏 琦.Cofilin与分化的研究进展[J].中国药理学通报,2014,30(2):164-7.
[3] Lei Y P,He J,Su Q.Research development of Cofilin and differ- entiation[J].Chin Pharmacol Bull,2014,30(2):164-67.
[4] 杨 娜,隋 峰,李沧海,等.大黄酸对Caco-2细胞多药耐药蛋白转运体表达的影响[J].中国实验方剂学杂志,2011(09):133-6.
[4] Yang N,Sui F,Li C H,et al.Effects of Rhein on expression of multi-drug resistance protein in Caco-2 cells[J].Chin J Exp Tradit Med Formul,2011(09):133-6.
[5] 阮和云,黎丹戎,李 力,等.卵巢上皮性癌淋巴道定向高转移细胞系的建立及其生物学特性的鉴定[J].中华妇产科杂志,2007(07):482-6.
[5] Ruan H Y,Li D R,Li L,et al.Establishment of human ovarian carcinoma cell lines with directional highly lymphatic metastasis and study of their biological characteristics[J].Chin J Obst Gyne-col,2007(07):482-6.
[6] Chen P,Zeng M,Zhao Y,Fang X.Upregulation of Limk1 caused by microRNA-138 loss aggravates the metastasis of ovarian cancer by activation of Limk1/cofilin signaling[J].Oncol Rep,2014,32 (5):2070-6.
[7] Jang I,Jeon B T,Jeong E A,et al.Pak1/LIMK1/Cofilin pathway contributes to tumor migration and invasion in human non-small cell lung carcinomas and cell lines[J].Korean J Physiol Pharma-col,2012,16(3):159-65.
[8] Li H,Zhang B,Liu Y,Yin C.EBP50 inhibits the migration and invasion of human breast cancer cells via LIMK/cofilin and the PI3K/Akt/mTOR/MMP signaling pathway[J].Med Oncol,2014,31(9):162.
[9] Zhou Y,Su J,Shi L,et al.DADS downregulates the Rac1- ROCK1/PAK1-LIMK1-ADF/cofilin signaling pathway,inhibiting cell migration and invasion[J].Oncol Rep,2013,29(2):605-12.
[10]Bravo-Cordero J J,Magalhaes M A,Eddy R J,et al.Functions of cofilin in cell locomotion and invasion[J].Nat Rev Mol Cell Biol,2013,14(7):405-15.
[11]Bernard O.Lim kinases,regulators of actin dynamics[J].Int J Biochem Cell Biol,2007,39(6):1071-6.
[12]刘理静,钱 红,张 平.大黄素对肺纤维化大鼠的保护作用及部分机制研究[J].中国药理学通报,2015,31(2):266-72.
[12]Liu L J,Qian H,Zhang P.Protective effect of emodin on rats with pulmonary fibrosis and its partial mechanisms[J].Chin Pharma-col Bull,2015,31(2):266-72.
[13]Lai W W,Yang J S,Lai K C,et al.Rhein induced apoptosis through the endoplasmic reticulum stress,caspase-and mitochon-dria-dependent pathways in SCC-4 human tongue squamous cancer cells[J].In Vivo,2009,23(2):309-16.
[14]Hsia T C,Yang J S,Chen G W,et al.The roles of endoplasmic reticulum stress and Ca2+on rhein-induced apoptosis in A-549 hu-man lung cancer cells[J].Anticancer Res,2009,29(1):309-18.
[15]Du Q,Bian X,L Xu,et al.Role of mitochondrial permeability transition in human hepatocellular carcinoma Hep-G2 cell death induced by rhein[J].Fitoterapia,2013,91:68-73.
[16]Fernand V E,Losso J N,Truax R E,et al.Rhein inhibits angio-genesis and the viability of hormone-dependent and-independent cancer cells under normoxic or hypoxic conditions in vitro[J].Chem Biol Interact,2011,192(3):220-32.
[17]Zhang K,Jiao X F,Li J X,Wang X W.Rhein inhibits lipopolysac-charide-induced intestinal injury during sepsis by blocking the toll-like receptor 4 nuclear factor-kappaB pathway[J].Mol Med Rep,2015,12(3):4415-21.
[18]Huang H J,Lin C C,Chou H C,et al.Proteomic analysis of rhein-induced cyt:ER stress mediates cell death in breast cancer cells [J].Mol Biosyst,2014,10(12):3086-100.
Rhein inhibits the movement and invasion of human ovarian carcinoma cells through Rac1/LIMK1/cofilin signaling pathway
TANG Min,LI Hong,ZHOU Guo-mei,XIE Yi-hong,RUAN He-yun,LI Dan-rong
(Affiliated Tumor Hospital of Guangxi Medical University,Nanning 530021,China)
Aim To investigate the effect of Rhein on the movement and invasiveness of human ovarian carci-noma cells with directional high lymphatic metastasis SKOV3-PM4 cells and explore the role of Rac1/LIMK1/cofilin signaling pathway.Methods Migration assay and invasion assay were used to observe the effect of Rhein on the metastatic and invasive ability of SK-OV3-PM4 cells in vitro.The effect of Rhein on the morphology and cytoskeleton ultrastructure of ovarian cancer cells was observed by laser scanning confocal microscope and scanning electron microscope.The protein expression level of Rac1,LIMK1,PAK1 and co-filin were detected by Western blot,respectively.Re-sults Rhein inhibited the abilities of cell invasion and migration of SKOV3-PM4 cells,and the inhibitory rate increased along with the increase of the concentration and treatment duration.After treated with 8.80 μmol· L-1,17.60 μmol·L-1,26.40 μmol·L-1of Rhein for 24 h,the abilities of migration and invasion of SK-OV3-PM4 cells were inhibited(P<0.05);the mor-phology and cytoskeleton ultrastructure of SKOV3-PM4 cells were changed,cellular pseudopod reduced,cell microfilament fractured and its distribution disordered,plasma membrane was uneven and cell gap widened.After treatment of Rhein and Rac1 inhibitor,Rac1 protein expression and the expression of P-LIMK1,P-PAK1 and P-cofilin notably decreased in a dose-de-pendent manner compared with the control group(P<0.05).After Rhein and Rhein plus Rac1 inhibitor treatment,P-LIMK1,P-cofilin,P-PAK1 protein levels of SKOV3-PM4 cells significantly decreased compared with the control group,and the group of Rac1 inhibi-tor plus Rhein treatment,the phosphorylated protein decreased more significantly(P<0.05).After Rac1 activator plus Rhein treatment,phosphorylated protein expression of P-LIMK1,P-PAK1 and P-cofilin upregu-lated significantly(P<0.05).Conclusions Rhein may be a potential inhibitor of Rac1 and can inhibit the migrating and invasive capabilities of directional high lymphatic metastasis SKOV3-PM4 cells through down-regulating the phosphorylation of Rac1/LIMK1/cofilin pathway associated protein.
ovarian neoplasms;Rhein;Rac1/LIMK1/cofilin signaling pathway;cytoskeleton;mi-gration and invasion;Rac1 inhibitor;Rac1 activator
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.028.html
10.3969/j.issn.1001-1978.2016.03.014
A
1001-1978(2016)03-0366-07
R284.1;R329.24;R73-37;R737.310.22
2015-11-04,
2015-12-21
国家自然科学基金资助项目(No 81360502);广西自然科学基金资助项目(No 2014GXNSFAA118161);区域性高发肿瘤早期防治研究教育部重点实验室专项经费(No GKE2015-ZZ17)
唐 敏(1989-),女,硕士生,研究方向:抗肿瘤药物,E-mail:361669785@qq.com;黎丹戎(1963-),女,硕士,教授,硕士生导师,研究方向:抗肿瘤药物,通讯作者,Tel:0771-5358131,E-mail:dan-rongli@163.com