采用大孔树脂分离纯化核桃青皮中多酚
马乐,韩军岐,白欢欢,张有林
(陕西师范大学 食品工程与营养科学学院, 陕西 西安,710119)
采用大孔树脂分离纯化核桃青皮中多酚
马乐,韩军岐*,白欢欢,张有林
(陕西师范大学 食品工程与营养科学学院, 陕西 西安,710119)
摘要通过吸附、解吸试验,筛选适合分离纯化核桃青皮多酚的大孔树脂,并对分离纯化条件进行优化。以没食子酸、原儿茶素等9种标准品绘制标准曲线,采用HPLC对所得核桃青皮多酚物质进行定性和定量分析。结果表明:NKA-9树脂是分离纯化核桃青皮多酚的最佳树脂,吸附条件为上样液多酚浓度0.574 mg/mL,pH 1.0,上样速率1.3 mL/min,吸附率可达90.1%;洗脱条件为体积分数50%的乙醇洗脱剂,pH 3.0,洗脱速率0.43 mL/min,解吸率达87.9%。经 HPLC鉴定和分析,核桃青皮酚类物质主要由原儿茶素、绿原酸、咖啡酸、表儿茶素、阿魏酸、芦丁等单体组成,其中含量较高的为表儿茶素、原儿茶素和芦丁。
关键词核桃青皮;多酚;大孔树脂;分离纯化
核桃(JuglansregiaL.)是一种经济价值较高的核桃属植物,我国核桃资源丰富,截至2010年,核桃栽培面积达到400万hm2,产量可达128万t[1]。核桃青皮(walnut green husk)又名青龙衣,是核桃外部一层厚厚的绿色果皮,其味辛、苦,性平、涩,早在1 200多年前,唐朝《食疗本草》中记载核桃青皮有药用价值[2]。植物多酚类化合物具有抗肿瘤、抗氧化、抗辐射、抗病毒、抗癌、抑菌等多种活性[3]。目前研究表明,核桃青皮中含有没食子酸、阿魏酸、绿原酸、芦丁、槲皮素等多种多酚类物质[4],因此具有较强的抗氧化作用。大孔吸附树脂具有吸附量大,操作简单,安全,能耗较低,有利于大规模生产的实现且树脂可再生节约成本等特点[5]。苏晓东等[6]通过优化大孔树脂吸附解吸条件,获得纯化荔枝果肉多酚的最佳工艺; WU等[7]通过试验筛选出D101树脂对枸杞类黄酮具有很好的分离纯化效果等。但很少见此方法应用于分离纯化核桃青皮多酚的相关报道。本研究通过采用不同性能大孔树脂(见表1)进行吸附、解吸试验,筛选适宜树脂种类,对核桃青皮多酚分离纯化条件进行优化,以获得最佳纯化效果。
1材料与方法
1.1材料与试剂
青皮核桃:于8月中旬采摘于陕西省蓝田县,将青皮核桃取青皮,切碎,经冷冻干燥后研磨粉碎,过60目筛,密封盛装于棕色玻璃瓶内,冷藏备用。

表1 4种大孔树脂的基本性能
大孔吸附树脂:AB-8、S-8、NKA-9、D-101,西安蓝晓科技新材料股份有限公司。
单酚标准品没食子酸、原儿茶素、绿原酸、香草酸、咖啡酸、表儿茶素、阿魏酸、芦丁、槲皮素,均为美国Sigma 公司所产。
Na2WO4、Li2SO4、Na2MO4、浓H3PO4、浓HCl、NaOH、无水乙醇、无水Na2CO3固体(分析纯),天津富宇化工有限公司;溴水(分析纯),成都市科龙试剂厂;乙腈,色谱纯,美国Fisher公司;甲酸(色谱纯),天津市科密欧化学试剂有限公司。
1.2主要仪器设备
数控超声波清洗器(KQ3200DE型),昆山市超声仪器有限公司;旋转蒸发仪(RE-52型),上海安亭实验仪器有限公司;数显恒温水浴锅(HH-S型),江苏省金坛市医疗仪器厂;紫外可见分光光度计(UV-1100型),上海美谱达仪器有限公司;恒温振荡器(SHZ-82型),金坛市富华仪器有限公司;恒流泵(HL-2S型),上海沪西分析仪器厂有限公司;精密pH计(PHS-3C型),上海精密科学仪器有限公司;电子天平(JA1203型),上海精密科学仪器有限公司;冷冻干燥机(LGJ-18C型),北京四环科学仪器厂;高相液相色谱仪(Breeze1525型),美国Waters公司。
1.3实验方法
1.3.1样品溶液的制备
称量一定量的核桃青皮干粉,用体积分数50%乙醇,在温度35 ℃,料液比 1∶17(g∶mL)条件下超声提取30 min,提取2次。提取液真空抽滤,取滤液旋转蒸发,得核桃青皮多酚粗提液,稀释至相应浓度, 4 ℃冷藏备用。
1.3.2多酚含量的测定
核桃青皮中多酚总含量测定采用Folin-Ciocaileu[8-9]法,以没食子酸作为标准品。称取没食子酸0.250 0 g,定容至50 mL,分别移取0,0.5,1.0,1.5,2.5,5.0 mL没食子酸溶液到50 mL容量瓶中,用去离子水定容。从上面不同浓度的标准溶液中分别移取0.2 mL,加入到10 mL容量瓶中,加入0.5 mL FC试剂,混合均匀,在1 min内加入1.5 mL 20%Na2CO3溶液,混合,用去离子水定容,将上述溶液在40 ℃下暗放置2 h后,以不加标准液的溶液做为空白对照,在760 nm波长下测定吸光度值。
1.3.3大孔树脂的预处理
大孔树脂用质量分数4% NaOH 溶液浸泡处理4 h,蒸馏水不断冲洗至中性;然后用质量分数4% HCl 溶液浸泡4 h,蒸馏水洗树脂至中性;最后再用体积分数95%乙醇浸泡处理4 h,蒸馏水洗至无醇味为止,备用。
1.3.4大孔树脂静态吸附与解吸
(1) 静态吸附实验: 称取1.0 g 各湿树脂于50 mL三角瓶中,加入样品液30 mL,密封置于175 r/min摇床上,25 ℃下振荡12 h,从上清液中取样,测定多酚含量。据以下公式计算吸附量和吸附率[8,10]。
qe=(c0-c1)×V1/m
(1)
E/% =[(c0-c1)/ C0]×100
(2)
式中:qe,吸附量,mg/g;E,吸附率, %; c0,起始浓度,mg/mL;c1,平衡浓度,mg/mL;V1,吸附溶液体积,mL;m,树脂的质量,g。
(2) 静态解吸实验: 将已充分吸附后的树脂用蒸馏水清洗,直至表面无样品液残留,再用滤纸吸干水分,置于三角瓶中,加入30mL不同浓度乙醇溶液,密封放置于175r/min振荡器中,25 ℃下解吸12h,从上清液中取样,测多酚含量。据以下公式计算解吸率和解吸量[8,11-13]:
D/% = (c2×V2×100)/[(c0-c1)×V1]
(3)
qd=c2×V2/m
(4)
式中:D,解吸率, %;qd,解吸量, mg/g;c0,起始浓度, mg/mL;c1,平衡浓度, mg/mL;c2,解吸液中多酚浓度, mg/mL;V1,吸附溶液体积,mL;V2,解吸溶液体积,mL;m,树脂取量, g。
1.3.5大孔树脂动态吸附与解吸
将预处理好的树脂湿法装入(16 mm×500 mm)层析柱中,用蒸馏水平衡后,将样品液以一定的速率上样并收集流出液,每10 mL为一管,检测并计算流出液浓度,确定流速、体积等条件,得到最佳吸附条件,绘制动态吸附曲线。
将已吸附饱和的树脂进行解吸实验,用蒸馏水洗至无样品液残留,以一定的流速用适当浓度乙醇溶液进行洗脱,收集洗脱液,计算流出液浓度,确定洗脱流速、体积等条件,得到最佳洗脱条件,绘制动态洗脱曲线。
1.4核桃青皮单体酚组成及含量 HPLC 分析
通过大孔树脂分离纯化后的核桃青皮多酚提取物采用HPLC法测定其单体酚的组成及含量。具体方法为:Diamonsil C18柱(5 μm,250 mm×4.6 mm);检测波长 280 nm;流速1.0 mL/min;柱温 30 ℃;进样量 20 μL;流动相A(0.1%甲酸高纯水)和流动相B(0.1%甲酸乙腈);梯度洗脱程序:93%A,7%B,0 min;82%A,18%B,30 min;78%A,22%B,40 min;50%A,50% B,45 min;50%A,50% B,50 min。样品峰保留时间与标准品保留时间进行对比,判断单体酚种类,按照峰面积计算单体酚含量,结果以(μg/g)核桃青皮干粉计。
1.5统计分析
试验重复3次,以(均值±标准差)表示,采用Excel和DPS软件对数据进行统计分析。
2结果与分析
2.1标准曲线的绘制
以没食子酸标准品浓度为横坐标(X,mg/L),吸光度值为纵坐标(Y),绘制标准曲线,得回归方程为:Y=0.002 8X-0.000 9,R2=0.999 5,说明该曲线在0~350 mg/L有良好的线性关系。
2.2树脂筛选结果
由于树脂的结构、孔结构、表面化学性质及被吸附分子的大小、极性等不同是影响树脂吸附性能的主要因素。
由图1可知,NKA-9对核桃青皮多酚的吸附量最高,可达17.39 mg/g;其次是AB-8吸附量为16.15 mg/g;D101、S-8分别为14.19 mg/g和11.7 mg/g。通过4种大孔树脂解吸性能试验可知,NKA-9对多酚的解吸性能最好,解吸率达84.56%;其次AB-8为80.5%;S-8的解吸率最差仅有44.96%。这一现象说明,大孔树脂对核桃青皮多酚类物质的吸附和解吸存在一定的选择性。而NKA-9的吸附量明显高于其他几种树脂,可能是由于树脂与核桃青皮多酚分子大小相近、极性相似。因此,选NKA-9大孔树脂作为纯化的最佳树脂。

图1 4种大孔树脂静态吸附和解吸性能的比较分析Fig.1 The static adsorption and desorption analysis of 4 macroporous resins
2.3静态吸附与解吸条件的优化
2.3.1树脂对粗提液多酚的吸附性能
在NKA-9大孔树脂中加入多酚粗提液进行静态吸附,不同时间测定多酚浓度,计算多酚吸附量。再将吸附饱和的树脂进行一段时间的静态解吸,计算多酚解吸量,以横坐标为时间(h),纵坐标为吸附量(mg/g),绘制静态吸附和解吸动力学曲线。
从图2可知,静态吸附起始阶段NKA-9树脂对多酚的吸附量上升速度快,随着时间的增加,吸附量逐渐达到饱和。当到达4 h时树脂基本到达吸附平衡,如果再延长吸附时间,吸附量变化不大。通过解吸曲线可知,解吸初期随着时间的增加解吸量不断增大,当处在2h时树脂解吸量已达较大,再延长解吸时间变化不太明显,由此表明2 h后就可达到解吸平衡态。
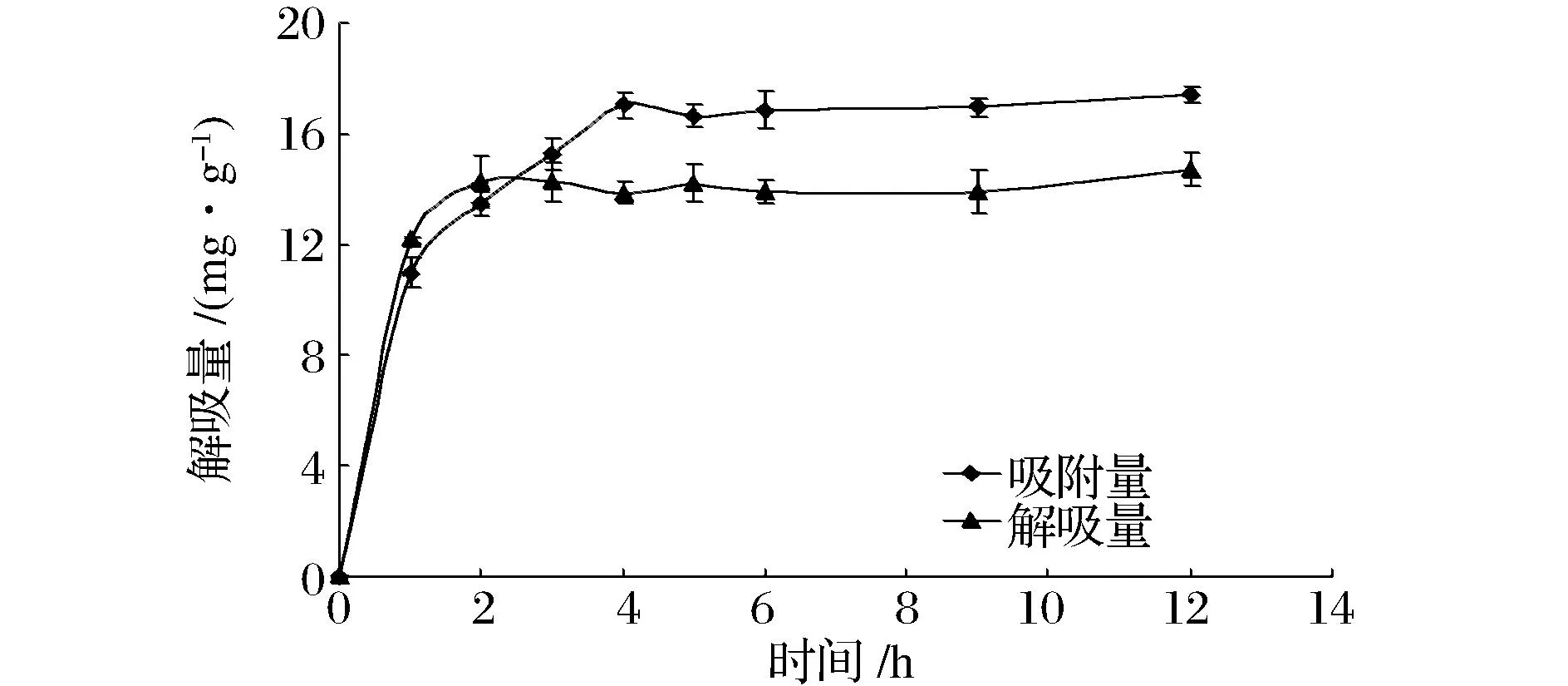
图2 NKA-9树脂静态吸附和解吸动力学曲线Fig.2 The static adsorption and desorption kinetic curve of NKA-9 resin
2.3.2粗提液pH值对树脂吸附效果的影响
将粗提液pH值分别调节为1.0,2.0,3.0,4.0,5.0,6.0,7.0,树脂经一段时间静态吸附,测多酚含量,计算吸附率。
吸附要达到良好效果就必须使吸附过程中吸附质保持容易被吸附的状态。核桃青皮多酚在酸性条件下能够保持此状态,有利于NKA-9树脂吸附。如图3所示,当pH 1.0时,树脂吸附多酚效果较佳,随着pH逐渐升高,多酚吸附量逐渐下降,这是由于多酚类化合物具有酚羟基结构,具备一定的酸性,其中—OH基团中的氢离子可以解离出来,以离子的形式存在于水中,此时不易被树脂吸附[14]。因此选择pH 1.0作为粗提液多酚吸附的较佳pH值。
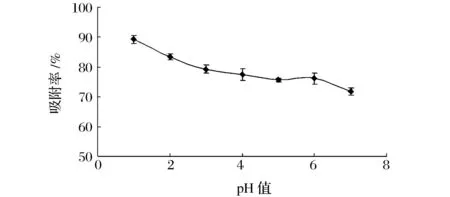
图3 pH对多酚吸附率的影响Fig.3 The effect of pH on adsorption ratio of polyphenols
2.3.3粗提液多酚浓度对树脂吸附效果的影响
配制多酚质量浓度为0.246~0.708 mg/mL粗提液,对树脂进行静态吸附试验,测定吸附后多酚含量,计算吸附率。
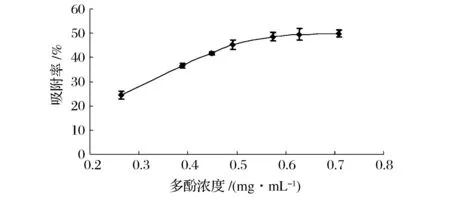
图4 不同浓度多酚静态吸附曲线Fig.4 Static adsorption curve of different polyphenols concentration
由图4可知,多酚浓度较低条件下,随着溶液浓度提高,多酚的吸附率逐渐增加,当多酚浓度达到0.574 mg/mL左右时,吸附率上升逐渐变缓,这是因为多酚与杂质同时竞争对树脂的吸附从而达到动态平衡,且高浓度多酚溶液溶解性降低不利于与树脂的结合,以及高浓度下分子扩散受抑制导致树脂吸附能力下降,容易使其他恒定条件的控制难度增加以及容易造成上样困难[15]。所以试验选用上样浓度为0.574 mg/mL。
2.3.4乙醇浓度对树脂解吸效果的影响
将不同浓度的乙醇溶液分别加入到吸附饱和的树脂中,经过一段时间的静态解吸测定解吸多酚浓度,计算解吸率,结果如图5所示。
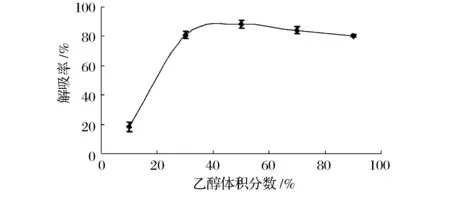
图5 乙醇浓度对多酚解吸效果的影响Fig.5 Effect of ethanol concentration on desorption rate of polyphenols
核桃青皮多酚一般用于医药及食品领域,所以从安全、简便角度考虑,试验选用乙醇作为洗脱剂,考察乙醇浓度对树脂洗脱效果的影响。由图5可知,随乙醇浓度增加,多酚解吸率逐渐增大。当乙醇体积分数达到50%后,再进一步增加乙醇浓度,解吸率增加变缓,这是由于洗脱剂的极性在一定程度上可能会影响吸附质的解吸作用。考虑到成本节约和减少浪费,故选体积分数50%乙醇作为最佳浓度的洗脱剂。
2.3.5解吸液pH值对树脂解吸效果的影响
将解吸液pH值分别调节为1.0、2.0、3.0、4.0、5.0、6.0、7.0,对树脂进行静态解吸试验,测定多酚含量,计算解吸率。

图6 pH对多酚解吸率的影响Fig.6 Effect of pH on desorption rate of polyphenols
由图6可知,随着pH值的逐渐升高,多酚的解吸率逐渐增加,pH 3.0时已达到最大值,随着pH值升高至中性时,解吸率反而不断下降。这说明在中性条件下,酚类化合物结构发生不可逆变化,使其性质发生改变,导致多酚解吸率减低。而在pH 3.0的条件下,由于树脂和多酚之间作用强度较弱容易被解吸,所以解吸率可达最大。
2.4动态吸附与解吸条件的优化
2.4.1上柱流速对树脂吸附效果的影响
将大孔树脂湿法装柱, 粗提液多酚分别以0.43、1.3、2.17 mL/min的流速上样, 收集流出液,检测并计算流出液浓度,绘制动态吸附曲线。
由于上样流速主要影响粗提液多酚向树脂的扩散效果,也因此决定最终吸附的效果。为使扩散有效进行,离子交换过程中大孔树脂和粗提液多酚就必须要充分接触。如果流速过快,树脂和粗提液不能够充分接触,致使部分酚类物质流出柱子,降低其吸附量;如果流速过慢,虽有利于树脂对酚类物质的吸附,但却会降低生产效率,影响生产周期。由图7可知,在0.43 mL/min和1.3 mL/min 2种上样流速下树脂吸附量均优于流速为2.17 mL/min的情况。在0.43、1.3 mL/min速率下,树脂吸附能力相差不大(P>0.05),试验选用1.3 mL/min为较佳的上样流速。

图7 流速对树脂吸附效果的影响Fig.7 Influence of flowing rates on adsorption effect
2.4.2洗脱剂流速对树脂解吸效果的影响
将吸附饱和的树脂,用体积分数50%乙醇溶液进行洗脱,洗脱流速分别为0.43、1.3、2.17 mL/min,收集洗脱液,测定乙醇溶液对饱和树脂的动态洗脱效果,绘制动态洗脱曲线。
一般来说,洗脱速度对解吸效果有显著影响。洗脱流速要求慢,但如果流速过慢,则会引起解吸时间延长,且在流动过程中被洗脱的多酚可能会被重新吸附,两相间会重新建立动态平衡,降低解吸量;如果流速过快,则会导致洗脱剂不能和吸附饱和的树脂充分接触而快速流出,使得解吸量降低,生产效率下降[16]。由图8可知,随着洗脱流速的加快,解吸量不断降低,当洗脱流速在0.43 mL/min时解吸效果较好,故采用此流速为洗脱流速。
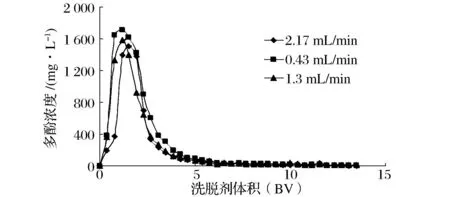
图8 洗脱剂流速对树脂解吸效果的影响Fig.8 Influence of eluting rates on desorption effect
2.5核桃青皮多酚单体组成及含量的比较
以9种单体酚为混标,通过采用HPLC法对核桃青皮粗多酚及NKA-9纯化后的提取物检测并进行统计分析。核桃青皮中共检测到7种单体酚类物质,单体酚种类及纯化前后的含量如表2所示。NKA-9树脂能较好的分离纯化核桃青皮中的酚类物质,由表2可知,经纯化后其中含量较高的为表儿茶素、原儿茶素和芦丁,且三者占总酚含量的70.58%。NKA-9纯化前后的核桃青皮多酚提取物 HPLC谱见图9,核桃青皮多酚纯化前保留时间2~5 min和48~50 min之间的杂峰经过纯化后被降低,且纯化前后剩余峰基本被保留,说明此种树脂适用于初步纯化核桃青皮多酚。此次试验检测出7种单体酚,尚余留一些未知峰尚有待做进一步的分离纯化,再经核磁或高分辨质谱等手段鉴定分析。
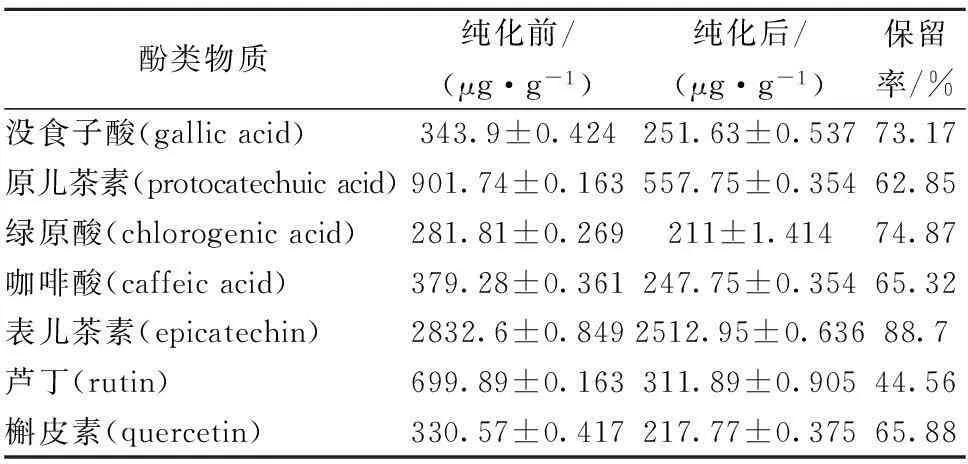
表2 NKA-9大孔树脂纯化前后核桃青皮单体
注:含量以 μg/ g核桃青皮粉计,均值±标准差 保留率:核桃青皮单体酚纯化后与纯化前含量的比值。
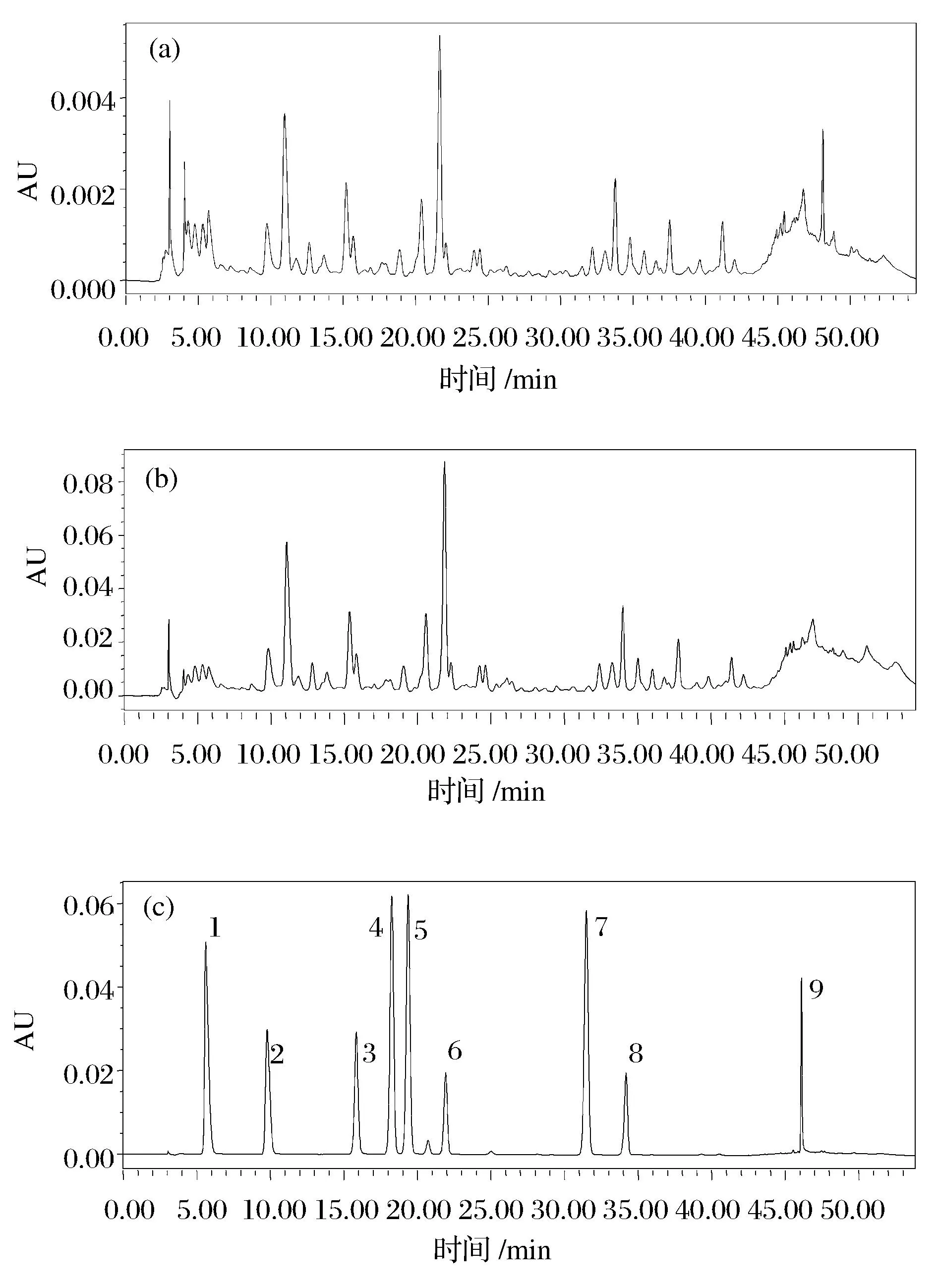
a-纯化前;b-纯化后;c-多酚混合标准品1-没食子酸;2-原儿茶素;3-绿原酸;4-香草酸;5-咖啡酸;6-表儿茶素;7-阿魏酸;8-芦丁;9-槲皮素图9 NKA-9大孔树脂纯化前、后的核桃青皮提取物HPLC图及多酚混合标准品HPLC图Fig.9 Effects of NKA-9 resin on HPLC spectrum of walnut green husk extract and theHPLC chromatogram of polyphenols standards
3结论
试验对4种不同型号的大孔树脂进行筛选,得到NKA-9树脂具有良好的吸附和解吸性能,通过考察核桃青皮多酚质量浓度、pH值、洗脱剂浓度以及上样液流速等影响因素,初步确定了分离纯化条件。 最佳吸附和解吸条件:提取液多酚浓度为0.574 mg/mL,pH 1.0时,以1.3 mL/min流速上样,此条件下树脂对多酚的吸附率最高,可达90.1%; 体积分数50%乙醇洗脱剂,pH 3.0时,流速0.43 mL/min洗脱,解吸效果较好,解吸率达87.9%。青皮多酚中主要由没食子酸、原儿茶素、绿原酸、咖啡酸、表儿茶素、芦丁和槲皮素等7种酚类物质组成,经过树脂纯化后含量较高的为表儿茶素、原儿茶素和芦丁。结果表明,NKA-9树脂作为核桃青皮多酚初步纯化材料是可行的,且分离纯化条件也可为工业生产提供理论参考。
参考文献
[1]许新桥,孟丙南.我国核桃产业潜力及发展对策研究[J].林业经济,2013,11(2):35-39.
[2]王红萍,尹江艳.核桃青皮的有效成分及综合利用[J].安徽农业科学,2013,41(24):10 129-10 133.
[3]ATHANASIOS V,THOMAIS V.Plant polyphenols:recent advances in epidemiological research and other studies on cancer prevention[J].Studies in Natural Products Chemistry,2013,39:269-295.
[4]万政敏.核桃青皮中多酚类物质及其抗氧化性的分析[D].呼和浩特:内蒙古农业大学,2007.
[5]刘丹.亲水性多酚分离纯化技术研究[D].大连:大连理工大学,2010.
[6]苏东晓,张瑞芬,张名位,等.荔枝果肉酚类物质大孔树脂分离纯化工艺优化[J].中国农业科学,2014,47(14):2 897-2 906.
[7]WU Song-hai,WANG Yan-yan,GONG Gui-li,et al.Adsorption and desorption properties of macroporous resins for flavonoids from the extract of Chinese wolfberry (LyciumbarbarumL.)[J].Food and Bioproducts Processing,2014,93(1):465-472.
[8]LIN Lian-zhu,ZHAO Hai-feng,DONG Yi,et al.Macroporous resin purification behavior of phenolics and rosmarinic acid from Rabdosia serra (MAXIM.) HARA leaf [J].Food Chemistry,2012,130(2):417-424.
[9]PAULO J M,JOANA S V,LUS M.Goncalves et al.Isolation of phenolic compounds from hop extracts using polyvinylpolypyrrolidone:Characterization by high-performance liquid chromatography-diode array detection-electrospray tandem mass spectrometry [J].Journal of Chromatography A,2010,1217(19):3 258-3 268.
[10]SUN Yan,YUAN Hong-yan,HAO Li-li,et al.Enrichment and antioxidant properties of flavone C-glycosides from trollflowers using macroporous resin [J].Food Chemistry,2013,141(1):533-541.
[11]XIONG Qing-ping,ZHANG Qiang-hua,ZHANG Dan-yan,et al.Preliminary separation and purification of resveratrol from extract of peanut(Arachishypogaea) sprouts by macroporous adsorption resins[J].Food Chemistry,2014,145(15):1-7.
[12]曹增梅,黄和.大孔树脂纯化番石榴多酚的工艺优化[J].食品工业科技,2013,34(7):215-218.
[13]熊何健,吴国宏.大孔吸附树脂分离纯化葡萄多酚的研究[J].食品研究与开发,2007,28(11):74-76.
[14]叶春,张婧.大孔树脂对野菊花总黄酮吸附分离特性的影响[J].食品科学,2010,31(12):127-131.
[15]焦岩,王振宇.大孔树脂纯化大果沙棘果渣总黄酮的工艺研究[J].食品科学,2010,31(16):16-20.
[16]赵平,宋学娟,张月萍.大孔树脂对葡萄籽原花青素的吸附研究[J].中国中药杂志,2007,32(20):2 196-2 201.
Separation and purification of polyphenols from walnut green husk by macroporous resin
MA Le, HAN Jun-qi*, BAI Huan-huan, ZHANG You-lin
(Shaanxi Normal University College of Food Engineering and Nutritional Science,Xi'an 710119, China)
ABSTRACTThe appropriate macroporous for separation and purification of polyphenols in walnut green husk was chosen by the adsorption and desorption experiment. The separation and purification condition was also optimized. Then the polyphenols from walnut green husk were qualitatively and quantitatively analyzed by HPLC (high performance liquid chromatography) using gallic acid and protocatechuic acid as standards. Results showed that macroporous resin NKA-9 was suitable for purification of walnut green husk polyphenols. The absorption condition was: polyphenols 0.574 mg/mL, pH 1.0, feeding rate 1.3 mL/min. Under the above conditions, the adsorption could reach to 90.1%. The desorption of walnut green husk polyphenols could be obtained when the elution rate was 0.43 mL/min with 50% ethanol, pH 3.0. The desorption ratio was 87.9%. Moreover, the HPLC test showed that polyphenols in walnut green husk contained protocatechuic acid, chlorogenic acid, caffeic acid, epicatechin, ferulic acid and rutin. Among those polyphenols, Epicatechin, protocatechuic acid and rutin content were higher.
Key wordswalnut green husk; polyphenols; macroporous resin; separation and purification
收稿日期:2015-09-02,改回日期:2015-10-14
基金项目:西安市农业创新计划项目(NC1505.4)资助
DOI:10.13995/j.cnki.11-1802/ts.201603042
第一作者:硕士研究生(韩军岐博士为通讯作者)。

