D-松醇原药对大鼠肝脏的毒性作用*?
曾奇兵,徐玉艳,张 婷,唐艳明,李 敏,洪 峰,王 荣
(贵州医科大学公共卫生学院环境污染与疾病监控重点实验室,贵州贵阳 550025)
D-松醇原药对大鼠肝脏的毒性作用*?
曾奇兵,徐玉艳*,张婷,唐艳明,李敏,洪峰,王荣
(贵州医科大学公共卫生学院环境污染与疾病监控重点实验室,贵州贵阳550025)
[摘要]目的:探讨D-松醇原药对大鼠肝脏的毒性。方法: 4~6周龄健康清洁级SD大鼠80只(雌雄各半),随机分成D-松醇原药低剂量组、中剂量组、高剂量组及对照组,每组20只,雌雄各10只,低、中、高剂量组分别喂饲390.63 mg/kg、1 562.50 mg/kg和6 250.00 mg/kg的D-松醇原药饲料,对照组喂饲普通标准饲料,连续喂饲90 d;观察4组大鼠的一般情况、体重变化;第90天时,各组大鼠心脏取血检测天冬氨酸氨基转换酶(AST)、丙氨酸氨基转换酶(ALT)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、血糖(GLU)、总胆固醇(CHO)、总胆红素(TBLL)、胆碱酯酶(CHE) 10项肝功能指标,取各组大鼠肝脏计算肝脏脏体比及观察肝脏病理组织学改变。结果: D-松醇原药低、中、高剂量组雄性大鼠实际染毒量分别为33.58 mg/kg、149.39 mg/kg、543.98 mg/kg;雌性大鼠实际染毒剂量分别为30.88 mg/kg、127.06 mg/kg、483.88 mg/kg。高剂量组雌性大鼠GLO、TP低于对照组(P<0.05) ;中、高剂量组雌性大鼠CHE高于对照组(P<0.05) ;中、高剂量组雄性大鼠TBLL高于对照组(P<0.05)。结论: D-松醇原药90 d经口喂养最大无作用剂量,雄性为30.88 mg/kg、雌性为33.58 mg/kg。雄性大鼠摄入D-松醇原药127.06 mg/kg以及雌性大鼠摄入D-松醇原药149.39 mg/kg时可以引起大鼠肝脏损伤。
[关键词]药物毒性;农药; D-松醇;大鼠,Sprague-Danley;肝脏
网络出版时间: 2016-02-23网络出版地址: http: / /www.cnki.net/kcms/detail/52.5012.R.20160223.2014.036.html
近年来,农药引起的安全问题已经受到社会各界的广泛重视,农药暴露可引起生物体多器官、多系统损害。肝脏作为机体生物合成、加工与解毒的重要器官,血液供应丰富,极易受到农药的毒性作用[1-2]。D-松醇(分子式C7H14O6)又名咳宁醇,是一种新型的植物源杀菌剂[3-4]。目前,国内外对D-松醇的毒性研究较少,本研究通过大鼠90 d亚慢性经口毒性试验,探讨D-松醇原药对大鼠肝脏的亚慢性毒性效应,为D-松醇原药安全性评价提供依据。
1 材料与方法
1.1试验动物及分组
选择4~6周龄健康清洁级SD大鼠80只,雌雄各半,雌性112~130 g、雄性114~134 g,由第三军医大学动物实验中心提供(SCXK渝2012-0003)。所有试验前SD大鼠适应性饲养1周,随机分成4组: D-松醇原药低剂量组、中剂量组、高剂量组及对照组。每组20只,雌雄各10只。参考GB15670-1995《农药登记毒理学试验方法》[5]设计剂量,以D-松醇原药大鼠急性经口毒性半数致死剂量(LD50)为标准,LD50的1/10是500.00 mg/ kg·bw,设为高剂量组的药物含量,按4倍等比级数设低、中剂量组,药物含量分别为31.25 mg/kg ·bw和125.00 mg/kg·bw,由重庆第三军医大学实验动物中心按大鼠进食量是其体重的8%的原则,配制D-松醇原药动物饲料,饲料中D-松醇原药的浓度分别为低浓度390.63 mg/kg、中浓度1 562.50 mg/kg和高浓度6 250.00 mg/kg。
1.2给药方法及饲养条件
各组各性别大鼠分别喂养,喂饲法给药,低、中、高3个剂量组大鼠每天分别自由摄取低、中、高D-松醇原药浓度的饲料,对照组每天自由摄取普通标准饲料,连续喂饲90 d。动物饲养环境温度22 ~24℃,湿度60%~70%,持续空调送风系统换气,保持良好通风,空气洁净度10 000级,噪声小于60 dB,人工昼夜12/12 h。
1.3观察指标
1.3.1一般情况及体重每天观察大鼠的外观体征、行为活动、进食量、粪便性状、中毒症状及死亡情况,每周称取大鼠体重1次,第90天时实测大鼠每周饲料消耗量,根据饲料消耗量计算D-松醇原药的实际摄入量。
1.3.2肝功能指标第90天时,用戊巴比妥钠麻醉大鼠,心脏取血并分离血清,用奥林巴斯AU400全自动生化分析仪检测血清天冬氨酸氨基转换酶(AST)、丙氨酸氨基转换酶(ALT)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、血糖(GLU)、总胆固醇(CHO)、总胆红素(TBLL)和胆碱酯酶(CHE) 10项肝功能指标。
1.3.3肝脏组织留取血液标本后处死动物,分离肝脏,用电子天平称重,计算肝脏脏体比(肝脏脏体比=肝脏脏器重量/体重×100%)。将称重后的肝脏用10%中性福尔马林固定、常规脱水、石蜡包埋、切片及HE染色,组织细胞学检查。
1.4统计学方法
采用SPSS(V13.0)统计软件处理,计量资料以均数±标准差(±s)表示,组间比较用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1一般情况
4组大鼠饮水、进食正常,粪便性状正常。对照组与低剂量组大鼠未见明显异常表现,高、中剂量组大鼠在染毒第6~9周开始出现烦躁不安、背毛蓬松、会阴污秽。对照组及各剂量组雌、雄性大鼠体重增长,差异均无统计学意义(P>0.05),见图1、2。
2.2染毒量
根据大鼠每周饲料实际消耗量计算D-松醇原药的实际摄入量。低剂量组雌、雄性大鼠D-松醇原药实际染毒量为33.58 mg/kg、30.88 mg/ kg;中剂量组雌、雄性大鼠D-松醇原药实际染毒量为149.39 mg/kg、127.06 mg/kg;高剂量组雌、雄性大鼠D-松醇原药实际染毒量为543.98 mg/ kg、483.88 mg/kg。
2.3肝功能
高剂量组雌性大鼠GLO、TP低于对照组(P<0.05) ;中、高剂量组雌性大鼠CHE高于对照组(P <0.05) ;中、高剂量组雄性大鼠TBLL高于对照组(P<0.05)。其余肝功能指标4组比较,差异无统计学意义(P>0.05)。见表1、2。
2.4肝脏组织变化
4组雌、雄大鼠肝脏脏体比差异无统计学意义(P>0.05),见表3。4组雌、雄大鼠肝脏结构正常,肝小叶清晰可见,肝细胞以中央静脉为中心,单行排列成板状结构,核椭圆形,可见一个或多个核,胞浆嗜酸性。肝细胞索之间可见肝血窦,血窦壁可见内皮细胞和肝巨噬细胞。汇管区内动、静脉及胆管形态正常。未见明显病理改变。
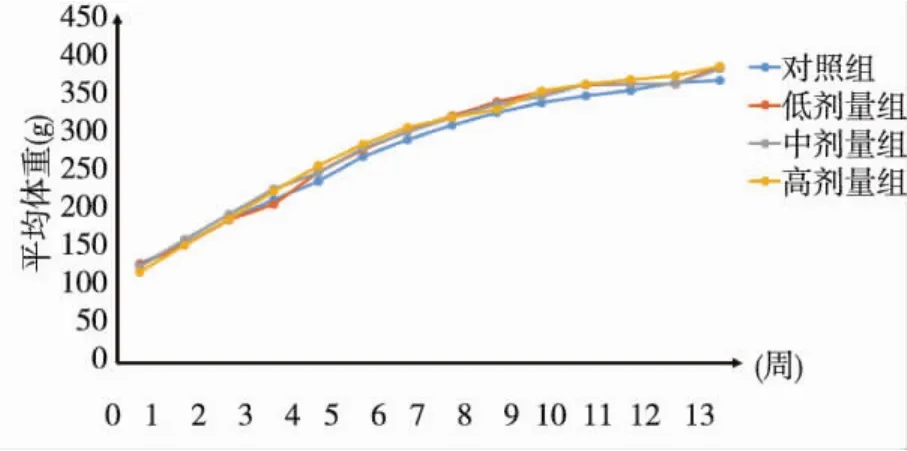
图1 D-松醇原药各剂量组雄性大鼠体重变化趋势Fig.1 Weight change trend of male rats in each D-pinitol dose group

图2 D-松醇原药各剂量组雌性大鼠体重变化趋势Fig.2 Weight change trend of female rats in each D-pinitol dose group
表1 各组大鼠毒性试验90 d时血清AST、ALT、ALP、ALB及GLO结果(±s) Tab.1 AST、ALT、ALP、ALB and GLO levels of rats in each group on 90 d
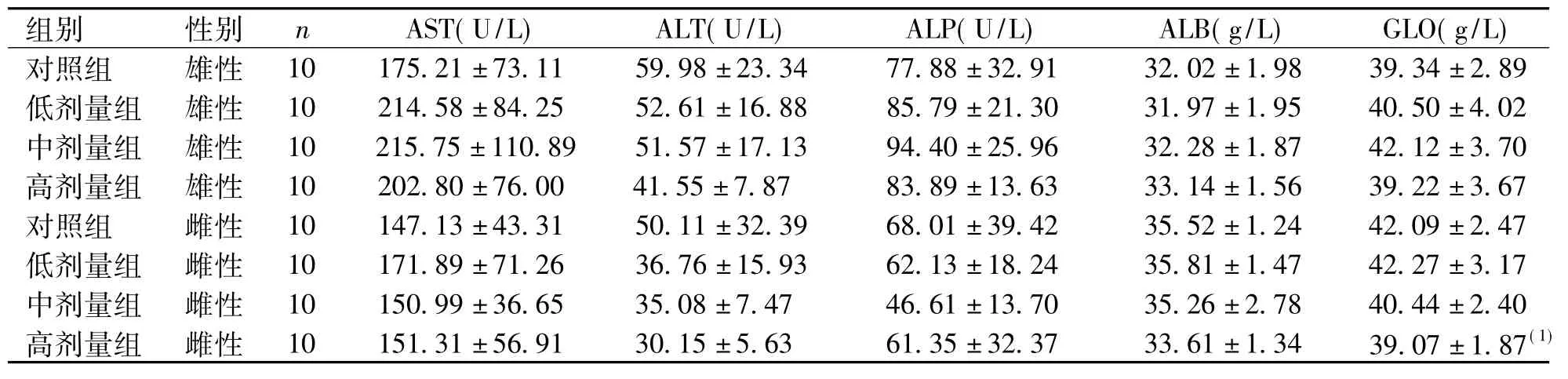
表1 各组大鼠毒性试验90 d时血清AST、ALT、ALP、ALB及GLO结果(±s) Tab.1 AST、ALT、ALP、ALB and GLO levels of rats in each group on 90 d
(1)与对照组比较,P<0.05
组别 性别 n AST(U/L) ALT(U/L) ALP(U/L) ALB(g/L) GLO(g/L)对照组 雄性 10 175.21±73.11 59.98±23.34 77.88±32.91 32.02±1.98 39.34±2.89低剂量组 雄性 10 214.58±84.25 52.61±16.88 85.79±21.30 31.97±1.95 40.50±4.02中剂量组 雄性 10 215.75±110.89 51.57±17.13 94.40±25.96 32.28±1.87 42.12±3.70高剂量组 雄性 10 202.80±76.00 41.55±7.87 83.89±13.63 33.14±1.56 39.22±3.67对照组 雌性 10 147.13±43.31 50.11±32.39 68.01±39.42 35.52±1.24 42.09±2.47低剂量组 雌性 10 171.89±71.26 36.76±15.93 62.13±18.24 35.81±1.47 42.27±3.17中剂量组 雌性 10 150.99±36.65 35.08±7.47 46.61±13.70 35.26±2.78 40.44±2.40高剂量组 雌性 10 151.31±56.91 30.15±5.63 61.35±32.37 33.61±1.34 39.07±1.87(1)
表2 各组大鼠毒性试验90 d时血清CHE、TP、CHO、GLU及TBLL结果(±s)Tab.2 CHE、TP、CHO、GLU and TBLL levels of rats in each group on 90 d

表2 各组大鼠毒性试验90 d时血清CHE、TP、CHO、GLU及TBLL结果(±s)Tab.2 CHE、TP、CHO、GLU and TBLL levels of rats in each group on 90 d
(1)与对照组比较,P<0.05
组别 性别 n CHE(U/L) TP(g/L) CHO(mmol/L) GLU(mmol/L) TBLL(μmol/L)对照组 雄性 10 0.20±0.10 71.35±4.36 1.08±0.52 4.42±2.03 1.79±0.65 4.46±1.20 1.21±0.53 0.55±0.62低剂量组 雄性 10 0.21±0.07 72.47±5.13 1.51±0.66 4.39±3.33 0.63±0.36中剂量组 雄性 10 0.22±0.07 74.40±4.29 1.45±0.39 3.80±2.42 1.16±0.36(1)高剂量组 雄性 10 0.21±0.09 72.36±4.51 1.48±0.46 3.45±1.28 1.27±0.63(1)对照组 雌性 10 0.63±0.16 77.62±3.24 1.92±0.83 3.01±2.17 1.47±0.79低剂量组 雌性 10 0.63±0.13 78.08±4.43 1.43±0.62 3.60±1.35 1.48±0.85中剂量组 雌性 10 0.86±0.16(1) 75.70±5.10 1.60±0.38 4.83±1.54 0.95±0.43高剂量组 雌性 10 0.82±0.24(1) 72.68±3.04(1)
表3 各组大鼠毒性试验90 d时肝脏脏体比(±s) Tab.3 Liver body-organ ratio of rats in 4 groups on 90 d

表3 各组大鼠毒性试验90 d时肝脏脏体比(±s) Tab.3 Liver body-organ ratio of rats in 4 groups on 90 d
组别 性别 n 肝脏脏体比(×10-3)对照组 雄性10 29.14±2.57低剂量组 雄性 10 28.34±2.17中剂量组 雄性 10 29.42±1.57高剂量组 雄性 10 27.41±2.90对照组 雌性 10 30.58±4.37低剂量组 雌性 10 28.02±1.30中剂量组 雌性 10 28.71±1.83高剂量组 雌性10 28.73±1.85
3 讨论
D-松醇作为一种新型植物源杀菌剂,应用前景非常广阔,目前国内外关于D-松醇毒性的研究较少。本实验通过SD大鼠亚慢性经口染毒,观察D-松醇原药对其肝脏的毒性作用。体重变化是反映机体各个器官对毒物反映的最基本指标[6],本试验表明,对照组及各剂量组雌、雄大鼠体重增长差异无统计学意义,提示在该暴露水平下,D-松醇原药对大鼠的体重影响较小。ALB、GLO主要在肝脏中合成,当肝脏的合成功能障碍时,可以使血清白蛋白减少,白蛋白/球蛋白比例倒置[7]。同时,肝脏也是一个酶工厂,有着生物体代谢活动的许多酶类如ALP、AST、ALT等,这些生物酶在血液中含量的变化反映肝实质细胞受损的情况,常作为反映肝功能的重要酶学指标[8]。本研究发现,高剂量组雌性大鼠GLO、TP低于对照组,提示高剂量组雌性大鼠肝脏的合成功能已经受损;而高剂量雄性大鼠GLO、TP改变与对照组比较差异均无统计学意义,考虑D-松醇原药对大鼠肝脏的合成功能可能存在性别差异。CHE是一类糖蛋白,广泛存在于神经胶质细胞、血浆、肝、肾、肠中,当肝脏蛋白质合成增加时,CHE可以增高。本研究中、高剂量组雌性大鼠CHE高于对照组,提示中、高剂量组雌性大鼠蛋白质合成增加,其原因有待于进一步探索。TBIL为直接胆红素和间接胆红素的总和,当肝脏受损时,血清中TBIL升高,因此血清中TBIL可作为判断肝脏受损的一个辅助指标[9]。中、高剂量组雄性大鼠TBLL高于对照组,提示中、高剂量组大鼠肝脏已经受损。结合肝脏脏体比及组织病理学检查发现,各剂量组雌、雄大鼠肝脏脏体比及组织病理学均未见明显改变,提示在该剂量下,D-松醇原药尚不能引起肝脏组织学改变,仅表现为肝功能的改变,但不排除随着染毒周期的延长,肝脏会发生不同程度的病理改变。
综上,在本实验条件下,D-松醇原药经口喂养90 d试验中的最大无作用剂量:雄性为30.88 mg/ kg、雌性为33.58 mg/kg。雄性大鼠摄入D-松醇原药127.06 mg/kg、雌性大鼠摄入D-松醇原药149.39 mg/kg时可以引起大鼠肝脏损伤,主要表现为对肝脏合成功能的影响。
4 参考文献
[1]胡云平,周志俊,孙运光,等.乐果对培养乳鼠心肌细胞的毒作用[J].卫生毒理学杂志,2000(4) : 209-211.
[2]徐玉艳,曾奇兵,洪峰.95%氨氯吡啶酸对大鼠肝脏的损害作用[J].湖北农业科学,2013(9) : 2041-2043.
[3]王丹丹,陈佳,陈义娟,等.D-松醇原药及其水剂对黄瓜白粉病的作用方式[J].农药,2012(4) : 292-295.
[4]Chaubal R,Pawar PV,Hebbalkar GD,et al.Larvicidal activity of Acacia nilotica extracts and isolation of D-pinitol-a bioactive carbohydrate[J].Chem Biodivers,2005 (5) : 684-688.
[5]国家技术监督局.GB 15670-1995中国标准书号[S].北京:中国标准出版社,1995.
[6]何国平,贾菠,郭昌烜,等.90 d喂养氟磺唑草胺原药对大鼠毒性作用的研究[J].毒理学杂志,2013(4) : 277-279.
[7]刘树业,段樱,李娴.代谢组学的进展及肝脏代谢组学[J].分子诊断与治疗杂志,2009(3) : 197-202.
[8]马晓明,宋祥福,薛茗方,等.碘甲烷对大鼠肝脏合成功能的影响[J].中国比较医学杂志,2013(9) : 19-22.
[9]陈文彬,潘祥林.诊断学[M].7版.北京:人民卫生出版社,2008: 363-365.
(2015-06-18收稿,2015-12-31修回)
中文编辑:戚璐;英文编辑:赵毅
·临床研究·
D-pinitol Technical Grade Toxicity on Rats Liver
ZENG Qibing,XU Yuyan,ZHANG Ting,TANG Yanming,LI Min,HONG Feng,WANG Rong
(Key Laboratory of Environment Pollution Monitoring and Disease Control,School of Public Health,Guizhou Medical University,Guiyang 550025)
[Abstract]Objective: To investigate D-pinitol technical grade toxicity on rats liver.Methods: Eighty healthy SD rats of 4 to 6 weeks of age (equal male and female number),randomly divided into D-pinitol technical grade low,medium and high dose groups and control group,with 10 male and 10 female rats each; low,medium and high dose groups were fed with 390.63 mg/kg,1 562.50 mg/kg and 6 250.00 mg/kg D-pinitol technical grade,control group was fed with normal standard stuff,continuous fed for 90 days; observing general condition of 4 groups and weight change; on 90th day,heart blood testing on liver function index of AST,ALT,ALP,TP,ALB,GLO,GLU,CHO,TBLL and CHE.Extracting rats'liver to calculate liver ratio and liver pathological changes.Results: The actual intoxicated amount of male rats in low,middle and high dose group were 33.58 mg/kg,149.39 mg/kg and 543.98 mg/kg; and the actual intoxicated amount of female rats were 30.88 mg/kg,127.06 mg/ kg,483.88 mg/kg.Globulin (GLO),total protein (TP) of female rats in high dose group was less than that of control group (P<0.05).Cholinesterase (CHE) of female rats in middle and high dose group was higher than that of control group (P<0.05).Conclusion: D-pinitol technical grade fed for 90 days no-effect levels were as follows: 127.06 mg/kg for male rats and 149.39 mg/kg for femal rats of D-pinitol technical grade can would cause liver damage in rats.
[Key words]drug toxicity; pesticide; D-pinitol; rats,Sprague-Danley; liver
*通信作者E-mail: 284497349@ qq.com
[中图分类号]R595.5
[文献标识码]A
[文章编号]1000-2707(2016) 02-0190-04

