AG490抑制DOCI-LY8和Raji细胞生长及与STAT3信号的关系*
李品浩,杨文秀,陈 琴,裴媛媛
(贵州医科大学病理学教研室,贵州贵阳 550004)
AG490抑制DOCI-LY8和Raji细胞生长及与STAT3信号的关系*
李品浩,杨文秀**,陈琴,裴媛媛
(贵州医科大学病理学教研室,贵州贵阳550004)
[摘要]目的:研究AG490对伯基特淋巴瘤(BL) Raji细胞和弥漫大B细胞淋巴瘤(DLBCL) OCI-LY8细胞生长的影响及分子机制。方法:用不含AG490(对照组)和不同浓度(25、50、75及100 mg/L) AG490(试验组)分别培养Raji细胞和OCI-LY8细胞24、48及72 h,用MTT法检查2株细胞的代谢生长情况,RT-qPCR检测对照组和各试验组培养48 h时2株细胞STAT3、TIMP-1的mRNA表达;用Western blot检测AG490 50 mg/L培养48 h时Raji细胞的STAT3、p-STAT3及TIMP-1蛋白的表达,流式细胞术检测2株细胞的细胞周期变化。结果:在2株细胞中加入AG490后,细胞生长较对照组明显减弱(P<0.05) ;与相应对照组比较,AG490试验组的Raji细胞和OCI-LY8细胞的G1期细胞都明显增多(P<0.05),处于S期的Raji细胞无明显改变、而OCI-LY8细胞则明显减少(P<0.05),G2-M期的Raji细胞明显减少(P<0.05)、G2-M期的OCI-LY8细胞亦有减少的趋势; STAT3和TIMP-1的mRNA表达明显降低,且呈现出药物浓度依赖关系(P<0.05) ; 2株细胞内TIMP-1与STAT3的mRNA表达呈正相关关系(Raji r = 0.744,P = 0.034; OCI-LY8 r = 0.984,P = 0.000) ; AG490组Raji细胞中p-STAT3、STAT3和TIMP-1蛋白表达较对照组明显降低。结论: AG490对Raji细胞和OCI-ly8细胞生长有明显抑制作用,TIMP-1的表达可能与SATA3的活化有关,STAT3活化及其下游靶基因TIMP-1的上调表达可能是AG490影响2株细胞生长的重要分子机制。
[关键词]淋巴瘤,B细胞;伯基特淋巴瘤;信号转导和转录激活因子;基质金属蛋白酶组织抑制因子-1; AG490;生长抑制物
**通信作者E-mail: ypq1964@163.com
网络出版时间: 2016-02-23网络出版地址: http: / /www.cnki.net/kcms/detail/52.5012.R.20160223.2003.026.html
侵袭性的弥漫大B细胞淋巴瘤(Diffuse large B cell lymphoma,DLBCL)和高侵袭性的伯基特淋巴瘤(Burkitt lymphoma,BL)的发生和演进过程是一个多分子事件,涉及到很多信号转导通路的异常。信号转导和转录激活因子(signal transducers and activators of transcriptions,STATs)是胞浆蛋白家族[1],它可被不同的细胞因子受体激活,转入细胞核内与相应DNA靶点结合,具有转录调控和信号转导的双重功能,STAT3则是该家族的重要成员。临床研究发现STAT3活性的高频率异常活化在多种恶性肿瘤中存在,且活化程度与肿瘤的不良预后有关[2-8]。STAT3持续性的激活可诱导与细胞增殖、分化、凋亡密切相关的一系列基因的异常高表达,是EGFR、IL-6/JAK、Src等多个致癌性酪氨酸激酶信号通道的汇聚焦点[9],与抗凋亡基因Bcl-xl和Mcl-1、细胞周期调控基因CyclinD1和cmyc、血管内皮细胞生长因子编码基因VEGF等都密切相关。阻断STAT3转导通路可以阻断多种导致肿瘤发生的相关机制,这是肿瘤治疗研究所关注的热点[10]。有研究发现部分BL和DLBCL中均发现STAT3分子的异常高表达,但其活化对BL和DLBCL影响的分子机制尚未完全清楚[11-12]。本研究通过观察STAT3特异性抑制剂AG490对BLRaji细胞和DLBCL-OCI-LY8细胞生长的影响,探讨STAT3和基质金属蛋白酶组织抑制因子-1(tissue inhibitors of metalloproteinase-1,TIMP-1)的活化是否与AG490对两种淋巴瘤细胞的生长抑制作用有关,为寻找临床治疗BL和DLBCL的基因靶点提供实验依据。
1 材料和方法
1.1实验材料
BL-Raji细胞株购自中国科学院上海细胞库,DLBCL-OCI-LY8细胞株由复旦大学肿瘤医院周晓燕教授惠赠。细胞培养基RPMI1640购自Hyclone公司,总RNA试剂盒购自上海碧云天公司,RTPCR试剂盒购自Invitrogen公司,抗STAT3(单克隆抗体)、抗TIMP-1和抗β-actin抗体购自Santa Cruz公司,抗p-STAT3抗体购自CST公司,,IL-6购自Pepro TECH公司,PCR引物由上海生工合成。
1.2方法
1.2.1细胞培养和分组分别将Raji细胞和OCI-LY8细胞置于RPMI1640培养液(10%胎牛血清和1%青霉素/链霉素)及混合培养基(10%胎牛血清、90% IMDM和1%双抗)中,在37℃、5% CO2饱和湿度的恒温培养箱中培养,每2~3 d换液1次,待细胞计数>1×106/mL时,按1∶2~1∶3传代培养。收集细胞并调节浓度为2×105/mL,2株细胞分别加入不含AG490(对照组)和不同浓度的AG490(不同浓度AG490组,AG490分别为25、50、75及100 mg/L)中,继续培养24、48及72 h。
1.2.2检测细胞活力用MTT法检测Raji和OCI-LY8细胞生长活力。分别于培养24、48及72 h时收集对照组和不同浓度AG490试验组的Raji和OCI-ly8细胞于无血清培养基中培养24 h,同步化后于96孔板布板。每孔加入0.5% MTT 20 μL,继续培养4 h,加入三联溶剂(SDS 10 g、异
丁醇5 mL和10 mol/L HCl 0.1 mL,用双蒸水溶解配成100 mL溶液) 150 μL,置摇床上低速振荡10 min。镜下观察结晶物溶解后,用酶联免疫检测仪490 nm处检测各孔的吸光值A,每组5个复孔,实验重复3次。
1.2.3检测STAT3和TIMP-1的mRNA提取细胞mRNA,测定RNA260/280光密度比值。逆转录为cDNA后进行PCR扩增。PCR循环参数:95℃10 min、90℃15 s、60℃1 min,40个循环。结果用2-ΔΔCT表示,用β-actin作为内参照。mRNA相对表达量2-ΔΔCt= 2-[实验组(Ct目的基因-Ct管家基因)-对照(Ct目的基因-Ct管家基因)]。PCR引物序列和产物见表1。

表1 RT-qPCR引物序列及相应产物Tab.1 Primer sequence of RT-qPCR and corresponding products
1.2.4检测STAT3,p-STAT3和TIMP-1蛋白检测
收集加入AG490(最佳浓度取50 mg/L)培养48 h的Raji细胞,用预冷的PBS洗涤3次,加入一定量的细胞裂解液及蛋白酶抑制剂,冰上充分裂解30 min,12 000 r/m离心5 min后取上清液。蛋白样品采用BCA法进行定量,加入Loading Buffer变性之后进行PAGE凝胶电泳。上样量为每孔30 mg,10%聚丙烯酰胺凝胶电泳,转至PVDF膜上,p-STAT3用5% BSA封闭,其他目的蛋白用5%脱脂牛奶封闭后,分别加一抗孵育过夜(稀释度: 抗STAT3、抗p-STAT3、抗TIMP-1均为1∶500,抗βactin 1∶1 000),二抗稀释比例为1∶5 000,洗膜,再加辣根过氧化酶偶联的二抗孵育1.5 h,再洗膜。加ECL发光液显色,暗室曝光,得到STAT3、p-STAT3及TIMP-1的条带胶片,胶片扫描后用Gelpro32软件分析。
1.2.5检测细胞周期分别将Raji细胞和OCILY8细胞以70 000/mL接种于6孔板中,加入AG490(浓度为50 mg/L)培养细胞48 h后收集Raji细胞和OCI-LY8细胞,用流式细胞仪检测细胞周期。
1.3统计学方法
使用SPSS 20.0统计软件包。STAT3,TIMP-1 的mRNA及蛋白表达水平采用两独立样本t检验,药物作用的多组间比较采用单因素方差分析,多组间均数的两两比较采较用SNK q检验,多组均数与一个对照样本均数比较采用Dunnett t检验。各药物浓度组间两分子表达的关系及分子表达与药物浓度的相关性关系采用Pearson相关性分析,以P <0.05为差异有统计学意义。
2 结果
2.1细胞活力
与相应的对照组比较,Raji和OCI-ly8细胞490 nm处吸光度值在加入AG490后明显降低(P <0.05),Raji和OCI-ly8细胞吸光度值与AG490呈现出药物浓度依赖关系,r和P依次为(-0.984,0.030)和(-0.978,0.004)。见图1。
2.2 STAT3、TIMP-1的mRNA表达
mRNA的A260/A280光密度比值为1.8~2.0,符合后续试验要求。RT-qPCR结果显示,与相应的对照组比较,2株细胞的STAT3和TIMP-1在试验组中表达明显降低,不同AG490浓度试验组Raji细胞和OCI-ly8细胞的之间STAT3和TIMP-1的mRNA表达有显著差异(P<0.05),且2种基因mRNA表达都呈现出药物浓度依赖关系(Raji细胞AG490与STAT3 r =-0.976,P = 0.024,AG490与TIMP-1 r =-0.990,P = 0.010; OCI-ly8细胞AG490与STAT3 r =-0.987,P = 0.013,AG490与TIMP-1 r =-0.994,P =0.006)。2株细胞TIMP-1与STAT3的mRNA表达呈正相关(r =0.744,P =0.034; r =0.984,P =0.000)。见表2。
2.3 Raji细胞p-STAT3、STAT3、TIMP-1蛋白表达
与对照组比较,Raji细胞的p-STAT3,STAT3 及TIMP-1蛋白在AG490组明显降低(P分别为0.001,0.017,0.002)。见图2。
2.4细胞周期
与相应对照组比较,AG490试验组Raji细胞和OCI-LY8细胞的G1期细胞都明显增多(P = 0.026、P =0.018)。S期Raji细胞细胞无明显改变(P =0.967),而S期OCI-LY8细胞明显减少(P = 0.045)。G2-M期的Raji细胞明显减少、G2-M期的OCI-LY8细胞亦有减少的趋势(P = 0.02、P = 0.09)。见表3。
表2 AG490培养48 h时Raji和OCI-LY8细胞中STAT3 mRNA和TIMP-1mRNA表达(±s)Tab.2 mRNA expression of STAT3 and TIMP-1 in Raji and OCI-LY8 cells treated with AG490 for 48 h
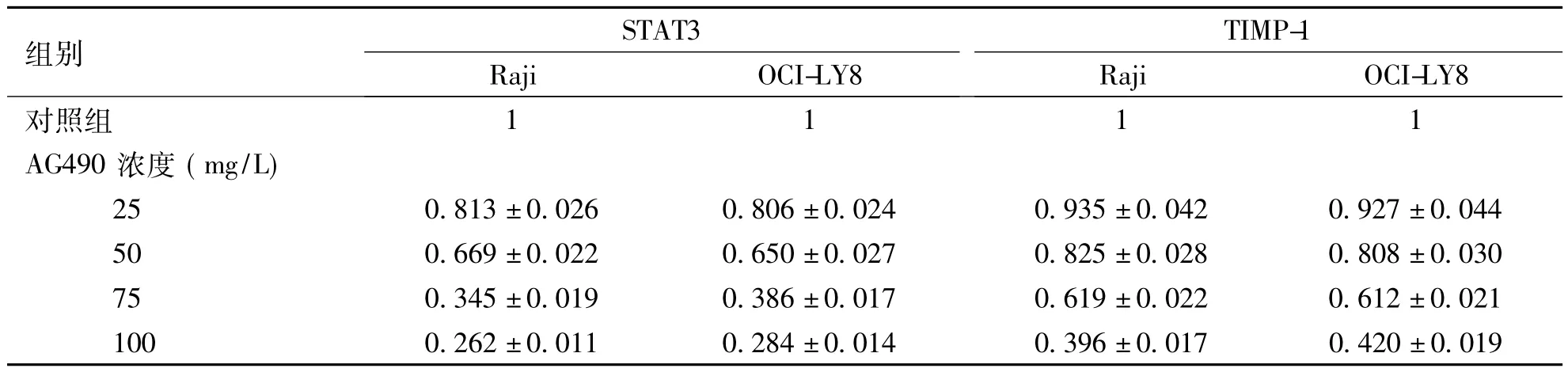
表2 AG490培养48 h时Raji和OCI-LY8细胞中STAT3 mRNA和TIMP-1mRNA表达(±s)Tab.2 mRNA expression of STAT3 and TIMP-1 in Raji and OCI-LY8 cells treated with AG490 for 48 h
组别STAT3TIMP-1 Raji OCI-LY8Raji OCI-LY8对照组1111 AG490浓度(mg/L) 25 0.813±0.026 0.806±0.024 0.935±0.042 0.927±0.044 50 0.669±0.022 0.650±0.027 0.825±0.028 0.808±0.030 75 0.345±0.019 0.386±0.017 0.619±0.022 0.612±0.021 100 0.262±0.011 0.284±0.014 0.396±0.0170.420±0.019
表3 50 mg/L AG490培养Raji和OCI-LY8细胞48 h的细胞周期变化Tab.3 Cell cycle changes of Raji and OCI-LY8 cells treated with 50 mg/L AG490(±s)
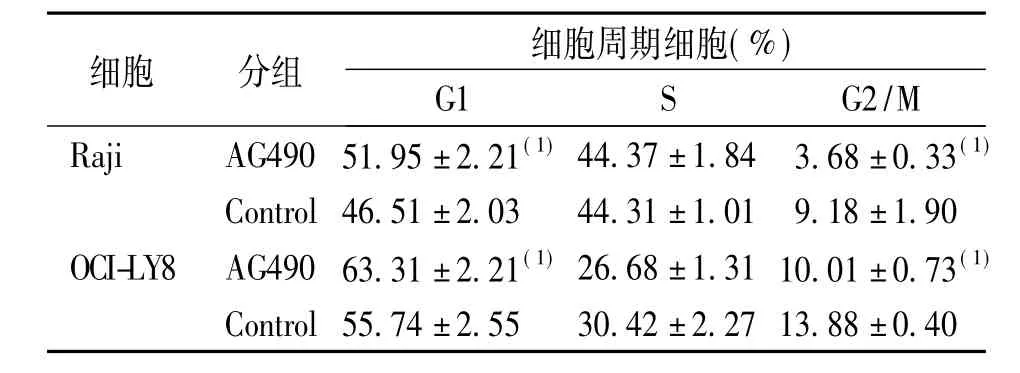
表3 50 mg/L AG490培养Raji和OCI-LY8细胞48 h的细胞周期变化Tab.3 Cell cycle changes of Raji and OCI-LY8 cells treated with 50 mg/L AG490(±s)
(1)与对照组比较,P<0.05
细胞 分组 细胞周期细胞(%) G1 S G2/M Raji AG490 51.95±2.21(1)44.37±1.84 3.68±0.33(1)Control 46.51±2.03 44.31±1.01 9.18±1.90 OCI-LY8 AG490 63.31±2.21(1)26.68±1.31 10.01±0.73(1)Control 55.74±2.55 30.42±2.27 13.88±0.40
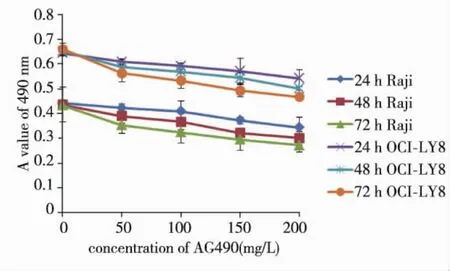
图1 AG490对Raji、OCI-LY8细胞生长的影响Fig.1 The effects of AG490 at different concentrations on the growth of Raji and OCI-LY8 cells
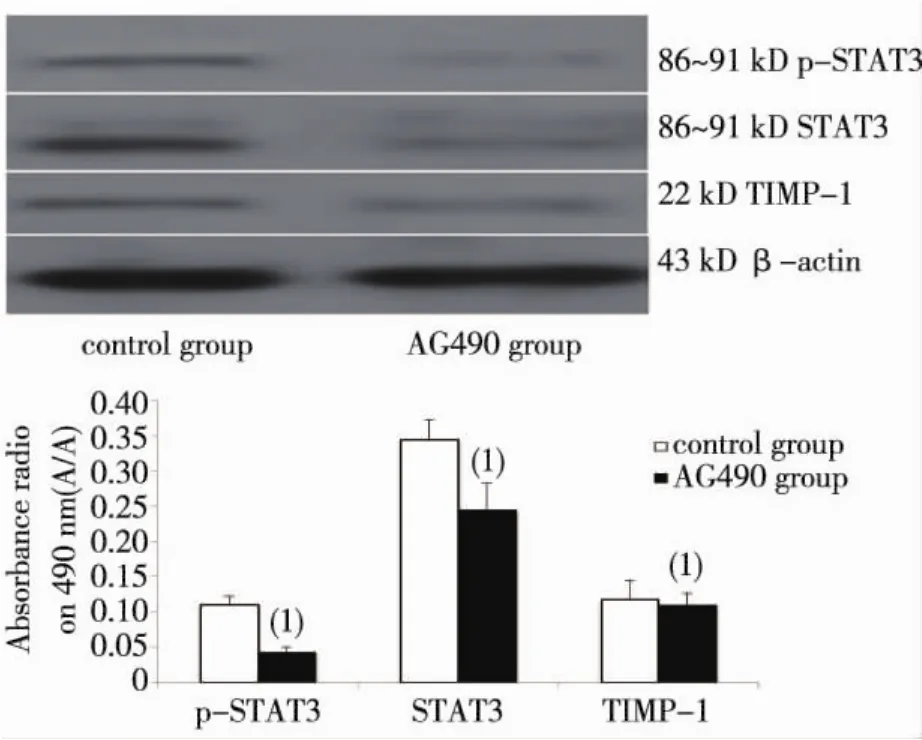
图2 Raji细胞中STAT3,p-STAT3,TIMP-1蛋白表达Fig.2 The protein expression of STAT3,p-STAT3 and TIMP-1 of Raji cells
3 讨论
由于DLBCL的高度异质性,联合化疗只能使约40%左右的患者达到持续缓解。高侵袭的BL临床过程和预后很差,而且成人患者治疗效果更不好。这些情况都说明淋巴瘤的发生和发展是多种病因和分子遗传学改变的结果。针对不同的病因和遗传学异常采用不同的治疗方法是肿瘤治疗的发展趋势。有研究发现,JAK/STAT3信号转导通路在多种淋巴瘤的侵袭及转移过程中发挥重要作用,该通路持续激活可导致细胞异常增殖或恶性转化,但具体机制并不明确[13-15]。TIMPs是基质金属蛋白酶(matrix metalloproteinase,MMPs)的内源性特异性抑制因子。现已发现脊椎动物TIMPs家族由四个结构相关的成员组成,即TIMP-1、TIMP-2、TIMP-3、TIMP-4。其中TIMP-1是一个由184个氨基酸和6个分子间二硫键组成的糖蛋白,其分子质量为28 kDa。TIMP-1分两个功能区,其N端功能区的半胱氨酸残基与MMPs的锌离子活性中心结合,C端功能区与MMPs的其他部位结合,以1∶1的比例形成MMP-TIMP复合体,从而阻断MMPs与底物结合,抑制MMPs的活化及其对细胞外基质(extracellular matrix,ECM)的降解,抑制ECM中相关凋亡蛋白的释放,从而调节细胞凋亡及促进肿瘤细胞生长[16]。TIMP-1也被看作是一种MMPs基因转录的抑制剂。关于TIMP-1研究还有不同的报道[17-19]: TIMP-1基因位于JAK/STAT信号通路的下游,其蛋白表达水平受JAK/STAT信号通路调控; JAK/STAT信号通路可通过上调TIMP-1的表达而抑制大鼠肾小球系膜细胞的调亡; TIMP-1和JAK/STAT的表达在人红白血病细胞存在双向调控作用;敲除STAT3基因之后,CCl4引起的肝纤维化模型中TIMP-1的高表达消失。同时有研究发现TIMP-1可以由淋巴瘤细胞自分泌或旁分泌产生,通过B细胞生长分化因子IL-10以及原癌基因bclxL来抑制细胞程序性死亡,从而延长正常扁桃体B细胞、Burkitt淋巴瘤细胞的寿命[20]。另外还有研究发现TIMP-1与非霍奇金淋巴瘤的临床分级相关[21]。
AG490是一种苯亚甲基丙二腈的脂类衍生物,是JAK/STAT通路的特异性抑制剂[22]。通过和受体酪氨酸激酶竞争结合位置,作用于多种肿瘤细胞而发挥抗瘤作用的研究陆续见诸报道。本研究在培养的Raji和OCI-LY8细胞中加入不同浓度AG490后,发现2株细胞生长活力均降低,呈现出药物浓度依赖关系。细胞周期检测发现AG490处理后G1期Raji细胞和OCI-LY8细胞都明显增多,在S期Raji细胞细胞无明显改变但OCI-LY8细胞明显减少,G2-M期的Raji细胞明显减少,G2-M期的OCI-LY8细胞亦有减少的趋势。结果表明,AG490对Raji和OCI-LY8细胞的生长活力和细胞周期产生都产生明显的影响。由于有部分DLBCL 和BL中存在STAT3的异常活化,推测在DLBCL发生过程中TIMP-1可能是STAT3作用的下游靶基因之一。检测发现,用AG490处理的两细胞株中STAT3和TIMP-1基因的mRNA表达水平均显著降低,且STAT3和TIMP-1的mRNA表达都呈现出药物浓度的依赖关系。与对照组相比,Raji细胞内p-STAT3,STAT3和TIMP-1蛋白表达在AG490组显著降低,且STAT3,p-STAT3与TIMP-1蛋白变化趋势表现出一致性,提示TIMP-1的蛋白表达可能与STAT3的活化有关。研究结果表明,用JAK/ STAT的特异性抑制剂AG490处理细胞后能明显抑制Raji及OCI-LY8细胞的生长代谢和阻断细胞周期的运行,其机制可能与AG490抑制STAT3的活化有关。AG490抑制了细胞内STAT3活化后,其下游靶基因TIMP-1分子表达受到影响,从而抑制了淋巴瘤细胞的生长。因此,TIMP-1的表达下调可能是肿瘤细胞内STAT3信号转导途径活化的结果。STAT3的活化抑制及其下游靶基因TIMP-1表达降低可能是AG490抑制DOCI-LY8和Raji细胞生长的重要分子机制。
4 参考文献
[1]Fu XY,Schindler C,Improta T,et al.The proteins of ISGF-3,the interferon alpha-induced transcriptional activator,define a gene family involved in signal transduction [J].Proc Natl Acad Sci USA,1992(16) : 7840-7843.
[2]Zhong Z,Wen Z,Darnell JE Jr.Stat3 and Stat4: members of the family of signal transducers and activators of transcription[J].Proc Natl Acad Sci USA,1994(11) : 4806-4810.
[3]Morikawa T,Baba Y,Yamauchi M,et al.STAT3 expression,molecular features,inflammation patterns,and prognosis in a database of 724 colorectal cancers[J].Clin Cancer Res,2011(6) : 1452-1462.
[4]Becker C,Fantini M C,Schramm C,et al.TGF-beta suppresses tumor progression in colon cancer by inhibition of IL-6 trans-signaling[J].Immunity,2004(4) :491-501.
[5]Grivennikov S,Karin E,Terzic J,et al.IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer[J].Cancer Cell,2009(2) : 103-113.
[6]Lou W,Ni Z,Dyer K,et al.Interleukin-6 induces prostate cancer cell growth accompanied by activation of Stat3 signaling pathway[J].Prostate,2000(3) : 239-242.
[7]Berishaj M,Gao S P,Ahmed S,et al.Stat3 is tyrosinephosphorylated through the interleukin-6/glycoprotein 130/Janus kinase pathway in breast cancer[J].Breast Cancer Res,2007(3) : R32.
[8]Kim D Y,Cha S T,Ahn D H,et al.STAT3 expression in gastric cancer indicates a poor prognosis[J].J Gastroenterol Hepatol,2009(4) : 646-651.
[9]侯嘉杰,孙倍成.STAT3:慢性炎症介导肿瘤发生和进展的关键节点[J].生物化学与生物物理进展,2014 (1) : 69-78.
[10]Jing N,Tweardy DJ.Targeting STAT3 in cancer therapy [J].Anticancer Drugs,2005(6) : 601-607.
[11]Soldini D,Montagna C,Schüffler P,et al.A new diagnostic algorithm for Burkitt and diffuse large B-cell lymphomas based on the expression of CSE1L and STAT3 and on MYC rearrangement predicts outcome[J].Ann Oncol,2013(1) : 193-201.
[12]Mizowaki T,Sasayama T,Tanaka K,et al.STAT3 activation is associated with cerebrospinal fluid interleukin-10 (IL-10) in primary central nervous system diffuse large B cell lymphoma[J].Journal of neuro-oncology,2015(2) : 165-174.
[13]Al Zaid Siddiquee K,Turkson J.STAT3 as a target for inducing apoptosis in solid and hematological tumors[J].Cell Res,2008(2) : 254-267.
[14]Siveen KS,Sikka S,Surana R,et al.Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors[J].Biochim Biophys Acta,2014(2) : 136-154.
[15]Lam LT,Wright G,Davis RE,et al.Cooperative signaling through the signal transducer and activator of transcription 3 and nuclear factor-κB pathways in subtypes of diffuse large B-cell lymphoma[J].Blood,2008 (7) : 3701-3713.
[16]Udayakumar TS,Stratton MS,Nagle RB,et al.Fibroblast growth factor-1 induced promatrilysin expression through the activation of extracellular-regulate kinases and STAT3[J].Neoplasia,2002(4) : 60-67.
[17]温文斌,林洪丽,吴泰华,等.JAK/STAT通路在金属蛋白酶1组织抑制剂抑制肾小球系膜细胞凋亡中的作用[J].中华肾脏病杂志,2008(1) : 24-29.
[18]Lambert E,Boudot C,Kadri Z,et al.Tissue inhibitor of metalloproteinases-1 signalling pathway leading to erythroid cell survival[J].Biochem J,2003(3) : 767-74.
[19]Wang H,Lafdil F,Wang L,et al.Tissue inhibitor of metalloproteinase 1 (TIMP-1) deficiency exacerbates carbon tetrachloride-induced liver injury and fibrosis in mice: involvement of hepatocyte STAT3 in TIMP-1 production[J].Cell&bioscience,2011(1) : 14.
[20]樊嵘,金冶宁.TIMP-1在乳腺癌中的作用机制和临床意义[J].现代肿瘤学,2009(1) : 154-158.
[21]Oelmann E,Herbst H,Zühlsdorf M,et al.Tissue inhibitor of metalloproteinases 1 is an autocrine and paracrine survival factor,with additional immune-regulatory functions,expressed by Hodgkin/Reed-Sternberg cells[J].Blood,2002(1) : 258-67.
[22]何平,李丹,李德天,等.乙肝病毒X蛋白通过激活JAK2/STAT3信号通路调节肾小管上皮细胞凋亡[J].中国病理生理杂志,2014(8) : 1451-1460.
(2015-12-13收稿,2015-12-31修回)
中文编辑:戚璐;英文编辑:赵毅
·专题研究(二)·
AG490 Inhibition Effect on Growth of DABCL and Burkitt Lymphoma Cells and the Correlation with Activation of STAT3
LI Pinhao,YANG Wenxiu,CHEN Qin,PEI Yuanyuan
(Department of Pathology,Guizhou Medical University,Guiyang 550004,Guizhou,China)
[Abstract]Objective: To investigate the effect and molecular mechanism of AG490 on the growth of Burkitt lymphoma (BL) cell line Raji and Diffuse large B cell lymphoma (DLBCL) cell line OCILY8.Methods: Raji and OCI-LY8 cells were cultured by non AG490 (control group) and varied concentration AG490 experiment group(25,50,75 and 100 mg/L) for 24,48 and 72 h.Cell viability was assayed by MTT.The expressions of STAT3 and TIMP-1 at mRNA level were detected by real time RT-PCR.STAT3,pSTAT3 and TIMP-1 protein expression of Raji cell cultivated by AG490 50 mg/L for 48 h were detected by Western blotting.2 strains of cell cycle was examined by flow cytometry.
[Key words]lymphoma,B cell; Burkitt lymphoma; single transducer and transcription activator-3; tissue inhibitors of metalloproteinase-1; AG490; growth inhibitor
*[基金项目]国家自然科学基金(No.81160299) ;贵州省优秀人才省长基金(No.2011.125)
[中图分类号]R559; R34
[文献标识码]A
[文章编号]1000-2707(2016) 02-0130-05
Results: Comparing with corresponding control group,cell viability was decreased in the two cell strains treated with AG490(P<0.05).The opposite change was found in AG490 experiment group,Raji cells and OCI-LY8 cells of phase G1 had a trend to significantly increase(P<0.05) ; the OCILY8 cells of phase S decreased significantly(P<0.01),while Raji cells had no obvious change (P<0.01) ; Raji cells of phase G2-M decreased significantly(P<0.01),OCI-LY8 cells showed tendency of reducing; mRNA expression of STAT3 and TIMP-1 reduced significantly and indicated concentration-dependence relationship(P<0.05) ; mRNA expressions of STAT3 and TIMP-1 in 2 strains of cell presented positive correlation (Raji r = 0.744,P = 0.034; OCI-LY8 r = 0.984,P = 0.000) ; p-STAT3,STAT3 and TIMP-1 protein expression of AG490 group were obviously reduced compared with those of control group.Conclusions: AG490 obviously inhibits the growth of Raji and OCI-LY8 cells.The expression of TIMP-1 may be associated with STAT3 activation.The activation of STAT3 and upregulated expression of TIMP-1 might be the essential molecular mechanism of AG490 influence over the growth of 2 strains of cells.

