非洲紫罗兰组织培养体系的建立1)
尹立辉 武术杰 刘亚亮 王雪松
(长春大学,长春,130012) (吉林省技秾种业有限公司) (中邦园林股份有限公司)
非洲紫罗兰组织培养体系的建立1)
尹立辉武术杰刘亚亮王雪松
(长春大学,长春,130012)(吉林省技秾种业有限公司)(中邦园林股份有限公司)
摘要以紫色白边单瓣花的非洲紫罗兰叶片为试材进行了组织培养技术的研究。结果表明:以叶片为外植体进行组织培养时,愈伤组织诱导最适培养基为MS+0.2 mg/L NAA+0.5 mg/L 6-BA,培养3周左右诱导率达100%;继代增殖时最适培养基为MS+0.02 mg/L NAA+0.1 mg/L 6-BA;无需生根培养,直接瓶外炼苗,栽植于以m(草炭土)∶m(珍珠岩)=1∶1的基质中生长最好,成活率可达95%以上。
关键词非洲紫罗兰;幼嫩叶片;组织培养;再生体系
分类号S682.1+9
Establishing the Tissue Culture System forSaintpauliaIonantha
Yin Lihui, Wu Shujie
(Changchun University, Changchun 130012, P. R. China); Liu Yaliang(Jilin Jinong Seed Industry Limited Company); Wang Xuesong(Zhongbang Garden Limited Company)//Journal of Northeast Forestry University,2016,44(4):31-33.
We studied the tissue culture technology ofSaintpauliaIonanthawith the purple petals of white edge and single flower. The tissue culture was conducted with the leaves as explants. The inducing medium for callus was MS+0.2 mg/L NAA+0.5 mg/L 6-BA. The induction rate after three weeks was 100%. The most suitable medium for subculture was MS+0.02 mg/L NAA+0.1 mg/L 6-BA. The outk-tube rooting rate were relatively better without taking root in the bottle. The best matrix for planting effect was peat soil and perlite with the mixed proportion of 1∶1 and the survival rate of >95%.
KeywordsSaintpauliaIonantha; Young leaves; Tissue culture; Regeneration system
非洲紫罗兰为苦苣苔科植物,植株矮小,花型花色丰富,花期长,多季开花,是极好的室内观赏植物。非洲紫罗兰不易得到种子,且种子也不易萌发,因此常用叶插繁殖,但叶插殖周期长,易染菌腐烂,且其繁殖系数很低[1-2]。而组织培养的繁殖方式能更好地保留母株的遗传特性,对非洲紫罗兰育种的研究有着重大的意义。近年来关于非洲紫罗兰组织培养技术的研究逐渐增多,耿明清、朱立明、纪丽丽、程云清等均以叶片进行了组培快繁技术的研究,确定各阶段培养基,但对其炼苗移栽少有提及或不详细[3-6]。本研究目的在于优化再生体系,提供适宜的炼苗移栽方法,为工厂化生产提供科学依据,也为良种选育打下基础。
1材料与方法
1.1材料与培养条件
非洲紫罗兰紫色白边单瓣花品种,取植株中部健康、完整的叶片。各阶段培养以MS为基础培养基,附加不同质量浓度的6-BA、IBA、NAA、2,4-D和30 g/L蔗糖及9 g/L琼脂等,pH=5.8。培养条件:温度(25±1)℃、光照1 500~2 000 lx、光照时间12 h/d。
1.2方法
外植体的建立:剪取生长良好的非洲紫罗兰健壮叶片为外植体,用洗衣粉液清洗,然后用自来水冲洗30 min。浸泡于75%的酒精水溶液中约30 s,无菌去离子水冲洗后,放进0.1%的升汞(加2滴吐温)中浸泡叶片约7~8 min,再用无菌去离子水冲洗4~6次。最后用无菌水浸泡,以备接种。
诱导培养:将非洲紫罗兰叶片切成1 cm×1 cm小块,接种于诱导培养基上,培养期间观察萌芽及生长状况。培养条件同1.1。
诱导分化率=(已分化的外植体数/接种外植体总数量)×100%;
将表面温源加热装置升温至目标温度点,分别计算各测量温度点位置1、位置2、位置3、位置4测量结果与该测量前后相邻两次位置0测量结果平均值的差值,取这4个值绝对值的最大值为相应温度点表面温源的温度均匀性。
增殖系数=继代后的芽苗数/继代前的芽苗数量;
生根率=(生根的外植体数/接种外植体数量)×100%。
继代培养:将诱导培养基上萌发的芽苗切下,将切块再转接到继代培养基中培养。培养期间观察芽的增殖及生长状况。培养条件同1.1。
生根培养:当继代培养中芽苗直径长至0.5 cm以上时,转至生根培养基中,观察生根状况。培养条件同1.1。
2结果与分析
2.1诱导培养
将处理好的外植体接种到诱导培养基上,接种30瓶,每瓶4个接种块。期间观察愈伤组织情况,培养条件同1.1,结果见表1。可见,培养15~20 d,便出现淡绿色的愈伤组织和众多的不定芽(图1),这两者往往同时出现,且大多先从切口边缘长出不定芽。经过3~4周的观察,在所给出的培养基上,愈伤组织的诱导率达100%;但从试管苗的长势上看,在MS+0.2 mg/LNAA+0.5 mg/L 6-BA培养基上,芽苗多、大,长势好。但整个实验过程中,污染率达30%~40%。

表1 不同培养基对非洲紫罗兰诱导培养的影响
注:++表示试管苗发育较好;+++表示试管苗发育良好;++++表示试管苗发育很好。

图1 愈伤组织和不定芽
将诱导芽切去再转接到继代培养上,30 d左右继代一次。继代增殖培养中,6-BA的质量浓度范围为0.05~0.70 mg·L-1,NAA的质量浓度范围为0.02~0.20 mg·L-1。经不同质量浓度的配比组合试验,观察生根情况,培养条件同1.1,结果见表2。可见,经过4周的初代培养,大部分的愈伤组织长成单株小苗,此时将初代培养的试管苗进行继代增殖培养,经继代培养90 d后,各处理增殖倍数达到最大(见图2)。分别对30、60、90 d丛生芽平均增殖倍数进行统计,可以看出非洲紫罗兰苗分化率都较高,其中以MS+0.02 mg/L NAA+0.1 mg/L 6-BA培养基和MS+0.02 mg/L NAA+0.05 mg/L 6-B培养基增殖倍数最大,在6倍左右;继代培养90 d后,每个愈伤组织上分化产生的芽可达100余个。

表2 不同培养基对非洲紫罗兰继代增殖的影响
注:++表示苗量较多,长势一般;+++表示苗量多,单株长势健壮;++++表示苗量多,长势健壮。

图2 继代增殖
不同培养基上非洲紫罗兰愈伤组织分化率都较高,但培养基上单株苗长势不同。从芽苗长势及结合增殖倍数看,以MS+0.02 mg/L NAA+0.1 mg/L 6-BA培养基上苗量多,长势健壮,为最适增殖培养基。
2.3生根培养
将生长健壮,高1~2 cm的幼苗转入生根培养基中,每瓶接芽苗5个,共30瓶。观察生根情况,培养条件同1.1。培养20 d后,结果见表3。可见,上述培养基中生根率均较高,都达96%以上,说明非洲紫罗兰极易生根,且1/2MS+0.2 mg/L NAA培养基有较好的生根效果。试验发现,因非洲紫罗兰极易生根,可将继代增殖苗直接移至瓶外进行炼苗,省去生根培养步骤,移栽后依然可以较好地生长。这样大大缩短了出苗时间,也为生产者节省大量资金。
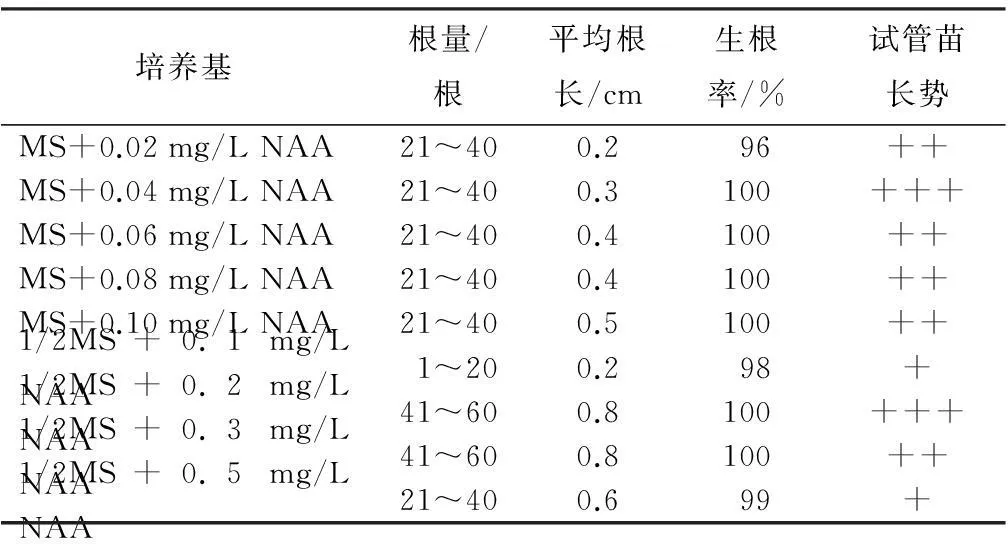
表3 不同培养基对非洲紫罗兰生根的影响
注:+表示长势一般;++表示长势较好;+++表示长势好。
2.4炼苗与移栽
将壮苗后的试管苗置于室温下炼苗2~4 d,去掉封口膜直接炼苗的方式较易染菌,不利于移栽苗成活;而洗净根部培养基后,浸泡于装满水的小盒中炼苗效果较佳,成活率能达到95%以上。炼苗后即可移植到消毒后的基质(1/2草炭+1/2珍珠岩)上,密植于长条形花盆中,上罩透明塑料薄膜,保持透气,缓苗4周后(见图3),即可去除塑料布。待小苗长至拥挤时,即可定植于12 cm口径花盆中进行养护(见图4);定植后的盆苗,经过约3个月的管护,即可开花(图5)。

图3 移栽于基质中

图4 定植后30 d

图5 定植3个月后
3结论
消毒时间过长对紫罗兰叶片的伤害很大,易导致大量外植体褐变死亡;而消毒时间过短则污染率高。因此,以75%的酒精水溶液+0.1%的升汞水溶液,加2滴吐温,对非洲紫罗兰外植体消毒时间7~8 min为宜。
叶片愈伤组织诱导最适培养基为MS+0.2 mg/L NAA+0.5 mg/L 6-BA,培养3周左右诱导率达100%,绝大多数愈伤组织上都有芽的分化;继代培养适宜培养基为MS+0.02 mg/L NAA+0.1 mg/L 6-BA,继代培养90 d后,每个愈伤组织上分化产生的芽可达100余个。
非洲紫罗兰试管苗瓶外较易生根,故无需通过生根培养基诱导其生根,在m(草炭土)∶m(珍珠岩)=1∶1的基质中驯苗,成活率可达95%以上,可有效缩短出苗时间,降低非洲紫罗兰工厂化育苗的生产成本。
参考文献
[1]王丹,舒钰.非洲紫罗兰叶片外植体诱导分化研究[J].黑龙江农业科学,2015(5):23-25.
[2]龚宇舟,刘清波,雷洁琼,等.非洲紫罗兰愈伤组织诱导及植株再生[J].农业工程,2013,3(3):120-122,151.
[3]耿明清.非洲紫罗兰组织培养[J].生物学通报,2012,47(4):49-50.
[4]朱立明.大花重瓣型非洲紫罗兰组培苗生根培养研究[J].中国园艺文摘,2011(4):3-4.
[5]纪丽丽,韩雪,王海霞.大花、重瓣型非洲紫罗兰组织培养技术研究[J].林业实用技术,2011(4):49-50.
[6]程云清,刘剑锋,钟雪,等.非洲紫罗兰叶片外植体再生技术体系的建立[J].中国农学通报,2010,26(10):212-216.
收稿日期:2015年5月20日。
作者简介:第一尹立辉,女,1978年11月生,长春大学园林学院,讲师。E-mail:51442591@qq.com。
1)吉林省技术开发(委托)项目(2010220001000250)。
责任编辑:戴芳天。

