氧化还原反应试题分析与启示
◇ 湖北 杜 峥
(作者单位:湖北省宜昌市夷陵区东湖高级中学)
氧化还原反应试题分析与启示
◇ 湖北 杜 峥
氧化还原反应是高中化学的核心内容,在高中阶段的学习主要是建立在初中化学的理论之上,所以在学习中有诸多和初中化学同类型的综合题型.有许多可进行实验的内容,当然这也是化学学科的显著特点,所以,实验类题型也是重要组成部分.另外一点就是,化学的实际运用,现在的考题越来越倾向于将知识点建立在实际生活的情境中进行考查,这应该是未来的主流趋势.本文对氧化还原反应试题进行了简要分析,得出试题的特点为高中化学教学提供一些建议.
1 化学方程式书写是基础教学
化学方程式的书写是化学中的最基础部分,也是整个学科学习的必备技能,所以在教学中,这一块是基础也是重点,正所谓“九层之台,起于垒土”,方程式书写就是化学的第一块基石.

A 用KIO3氧化酸性溶液中的KI:
B 加热氢氧化钠和碳酸氢铵的混合溶液:
C 在冷氨水中逐步加入二氧化硫,直至过量:
D 用稀硝酸洗涤试管内壁的银镜:
分析 这就是非常纯粹的方程式书写问题,并且本题以元素化合物基础和生活内容为背景,考查考生的基本功.答案为C.

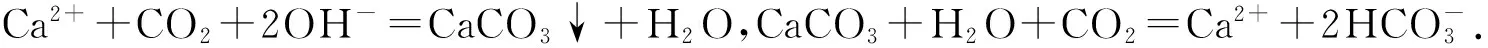
2 增加综合实验操作题注重实践教学
增加实践操作教学,可以先从一些相关的题目入手,让学生通过这些题目熟悉相关的实验要点之后,再进行实践操作.

A Cu与Cu2O 的物质的量之比为2∶1;
B 硝酸的物质的量浓度为2.6 mol·L-1;
C 产生的NO在标准状况下的体积为4.48 L;
D Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
分析 本题是一道基础的实验题,主要考查的是实验计算.根据题中给出的已知条件可以明确NaNO3是反应后溶液中的溶质,且和后来加入的NaOH的物质的量应该相等,才能使溶液保持中性,即NaNO3的量为1 mol.0.2 mol Cu和0.1 mol Cu2O被硝酸氧化时共失去(0.4+0.2) mol e-,则还原生成NO共消耗了0.2 mol硝酸,硝酸总的量为1.2 mol,浓度是2.4 mol·L-1,所以答案为B.

图1
再如,硝酸在高中化学中十分常见,其无色透明,易溶于水,具有很强的腐蚀性以及氧化性.为了对硝酸性质进行深入教学,某教师设计了如图1所示的实验.在常温环境下,制备等量的浓硝酸和稀硝酸,并向2份硝酸中加入等量的铁片,进而观察实验反应.
根据题意和图示可以得出,2组实验中的气球都会发生膨胀,但是2个气球的膨胀速率并不一致,而是有快有慢,产生的气体也不一样多.其中稀硝酸反应方程式为Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O.而铁与浓硝酸会发生钝化.在试管口设置气球的目的是:1)通过气球膨胀速率对比分析2组实验反应快慢; 2)收集反应产生的气体避免其对空气造成污染.铁片与足量稀硝酸反应,铁元素由0价升为+3价,被氧化,所以铁是还原剂,部分氮元素由+5价降为+2价,被还原,则HNO3是氧化剂.
3 生活中的实际问题成为常用出题情境
要加强教学活动的有效性,需要从实际问题出发,通过一些常用生活情境的题目,提升教学有效性.

A 点制豆腐; B 食物腐败;
C 燃放鞭炮; D 金属冶炼
分析 食物腐败是空气中的氧气和食物中的成分发生氧化反应,导致其发生腐败.燃放鞭炮也是通过点火引燃火药,最终引发爆炸.金属冶炼主要是通过还原剂将某种金属元素从化合物中还原出来.这3种现象都属于氧化还原反应.而豆腐的点制属于胶体的聚沉,是物理变化,答案为A.

(1) 上述反应中氧化剂是________.
(2) 根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:① 水;② 碘化钾淀粉试纸;③ 淀粉;④ 白酒;⑤ 食醋,则必须选用的物质有________.
(3) 请配平以下化学方程式:__Al+__NaNO3+__NaOH=__NaAlO2+__N2↑+__H2O.若反应过程中转移5 mol e-,则生成标准状况下N2的体积为____L.
分析 (1)由于N元素化合价降低,因此NaNO2在反应中是氧化剂.(2) 根据上述反应,NaNO2在酸性溶液中,能将I-氧化成I2,淀粉遇I2变蓝色.所以,首先需要选择水将NaNO2和NaCl进行溶解,其次需要选择酸性物质对其进行氧化,最后需要选择淀粉试纸鉴定碘.因此,必须选用的物质有①、②、⑤.(3)根据化合价升降配平:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O.根据关系式N2~10e-,若反应过程中转移5 mole-,则生成标准状况下N2的体积为11.2 L.
通过分析发现,化学更加注重考查考生的实践能力和生活观察能力,所以,在平时教学中,要注重实验与学习情境的创设,让学生在生活中学习化学,再将化学运用到生活中.
(作者单位:湖北省宜昌市夷陵区东湖高级中学)

