次氯酸和氯气的氧化性强弱比较
◇ 甘肃 毛宗华
(作者单位:甘肃省华亭县第一中学)
次氯酸和氯气的氧化性强弱比较
◇ 甘肃 毛宗华
在中学阶段,往往根据氧化还原反应的强弱来判断物质的氧化性或还原性的强弱.例如,在氯水中存在反应Cl2+H2OH++Cl-+HClO,根据强弱规律,Cl2氧化性大于HClO.但将浓盐酸和次氯酸钠溶液混合,发生的反应H++ClO-=Cl2+H2O(pH<7.5时HClO稳定,pH>7.5时ClO-稳定,所以该反应的离子反应方程式应写成上述形式),根据强弱规律,HClO氧化性又大于Cl2.那么,Cl2和HClO的氧化性到底谁强呢?弄清上述2个反应自发进行的条件和强弱规律的适用条件方可解决这一问题.
1 歧化反应自发进行的条件
氧化还原反应是由2个或2个以上氧化还原电对的半反应组成的.若把由两电对组成的氧化还原反应设计成原电池,则两电对分别在两电极上发生氧化反应和还原反应.电池的电动势EMF就是电对的电极电势差,即EMF=E正-E负,当EMF>0时,反应能自发进行,当EMF<0时,反应不能自发进行.
歧化反应是特殊的氧化还原反应.判断歧化反应能否自发进行的方法有多种,比较简便的方法是根据元素电势图判断,即把同一元素的各种氧化态(或部分氧化态)按照高低顺序排成横行,在2种氧化态之间若构成一个电对,就用一条直线把它们连接起来,并在上方标出这个电对所对应的标准电极电势.

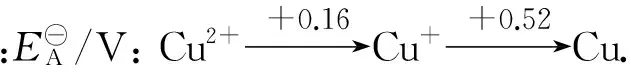
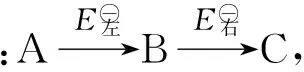
2 强弱规律的适用条件
强弱规律适用于自发的氧化还原反应,不适用非自发的氧化还原反应.如对自发的歧化反应2Cu+=Cu2++Cu,根据强弱律,Cu+氧化性大于Cu2+,Cu+还原性大于Cu,它和根据Cu2+/Cu+电对与Cu+/Cu电对的电极电势高低判断出的氧化还原能力一致,是正确的.对非自发的歧化反应3Fe2+=2Fe3++Fe,根据强弱规律,Fe2+氧化性大于Fe3+,Fe2+还原性大于Fe,它和根据Fe3+/Fe2+电对与Fe2+/Fe电对的电极电势高低判断出的氧化还原能力是相反的.
3 Cl2和HClO氧化性强弱比较

当pH<4.6时, HClO/Cl2电对的电极电势大于Cl2/Cl-电对的电极电势.此时,E右>E左, Cl2不能自发发生歧化反应生成HClO和HCl,而逆反应H++Cl-+HClO=Cl2+H2O能自发发生,根据强弱律可判断出氧化性HClO大于Cl2.当pH>4.6时, HClO/Cl2电对的电极电势将小于Cl2/Cl-电对的电极电势.此时,E左>E右, Cl2能自发发生歧化反应生成HClO和HCl,反应Cl2+H2O=H++Cl-+HClO能自发进行,根据强弱律可判断出Cl2氧化性大于HClO.所以,当pH<4.6时,HClO氧化性大于Cl2;当pH>4.6时,Cl2氧化性大于HClO.
(作者单位:甘肃省华亭县第一中学)

