氨基胍对氧-糖剥夺大鼠皮质神经元一氧化氮及半胱氨酸天冬氨酸蛋白酶3表达的影响研究
唐仕军,赵 冬,朱立仓,李晓天,朱文学,杨 鹏,王业忠
832000新疆石河子市,石河子大学医学院第一附属医院神经外科
·论著·
氨基胍对氧-糖剥夺大鼠皮质神经元一氧化氮及半胱氨酸天冬氨酸蛋白酶3表达的影响研究
唐仕军,赵 冬,朱立仓,李晓天,朱文学,杨 鹏,王业忠
832000新疆石河子市,石河子大学医学院第一附属医院神经外科
【摘要】目的探讨氨基胍对氧-糖剥夺大鼠皮质神经元一氧化氮(NO)及半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表达的影响。方法2014年11月—2015年7月选取新生24 h内SD大鼠12只,分离及培养大鼠皮质神经元,取原代培养8 d的皮质神经元,分为3组:正常对照组、氧-糖剥夺组、氨基胍组。正常对照组皮质神经元采用Neurobasal培养液+2%B27培养液添加剂培养,氧-糖剥夺组皮质神经元缺氧、缺糖处理45 min后,换Neurobasal培养液+2%B27培养液添加剂培养;氨基胍组皮质神经元缺氧、缺糖处理45 min后,换Neurobasal培养液+2%B27培养液添加剂培养的同时加入终浓度为10 mmol/L的氨基胍溶液。各组培养2、6、12 h,采用硝酸还原法检测细胞上清液中NO表达水平,采用Western blotting法检测Caspase-3表达水平。结果各组培养2、6、12 h时细胞上清液中NO、Caspase-3表达水平比较,差异均有统计学意义(P<0.05);其中氧-糖剥夺组、氨基胍组不同时间点细胞上清液中NO、Caspase-3表达水平较正常对照组升高(P<0.05);氨基胍组不同时间点细胞上清液中NO、Caspase-3表达水平较氧-糖剥夺组降低(P<0.05)。结论氨基胍可抑制氧-糖剥夺大鼠皮质神经元NO及神经元凋亡相关基因Caspase-3表达水平,从而抑制皮质神经元的凋亡,对皮质神经元具有保护作用。
【关键词】神经元;一氧化氮;半胱氨酸天冬氨酸蛋白酶3;氨基胍
唐仕军,赵冬,朱立仓,等.氨基胍对氧-糖剥夺大鼠皮质神经元一氧化氮及半胱氨酸天冬氨酸蛋白酶3表达的影响研究[J].中国全科医学,2016,19(12):1429-1434.[www.chinagp.net]
Tang SJ,Zhao D,Zhu LC,et al.Effect of aminoguanidine on the expression of NO and Caspase-3 in rat cortical neurons after oygen glucose deprivation[J].Chinese General Practice,2016,19(12):1429-1434.
缺血性脑血管病是由于各种原因导致部分脑组织的血流减少或中断,引起神经元功能障碍和结构损害的一组疾病。《中国脑卒中防治报告(2015)》[1]显示,脑卒中已经成为我国人口死亡和致残的第一原因,脑卒中具有高发病率、高病死率和高致残率,给我国的社会经济发展带来了沉重负担。如何预防和治疗脑血管病,寻求一种合适的药物减轻脑损伤,一直是全社会共同关注的问题。动物实验显示,缺血、缺氧可诱导脑组织产生一氧化氮(NO),过量的NO与脑损伤有关[2]。在体外培养皮质神经元中,氧-糖剥夺可导致皮质神经元产生过量NO,并造成神经元的损伤,缺氧、缺糖环境下所产生的NO在神经元凋亡中可能发挥着重要作用[3]。因此,本研究以体外原代培养皮质神经元为实验对象,采用氨基胍对氧-糖剥夺大鼠皮质神经元进行干预,观察培养液中NO表达水平与神经元凋亡相关基因半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表达水平的时相变化,探讨氨基胍在氧-糖剥夺大鼠皮质神经元凋亡中的作用。
1材料与方法
1.1动物2014年11月—2015年7月选取新生24 h内SD大鼠12只,其中雄性8只,雌性4只;体质量35~50 g;购于新疆医科大学实验动物中心。
1.2仪器二氧化碳(CO2)细胞恒温培养箱(美国Thermo Forma),Thermo超净工作台(美国Thermo Electron Corporation),缺氧培养箱(浙江省新安江分析仪器二厂),倒置相差显微镜及照相系统(Olympus),半干式转印系统(Bio-Rad公司),全能型凝胶成像分析系统(Bio-Rad公司)。
1.3主要试剂DMEM高糖培养液(HyClone公司),胎牛血清(杭州四季青集团公司),DMEM无糖培养液、Neurobasal培养液、2%B27培养液添加剂、0.25%胰酶、氨基胍、青霉素和链霉素(10 000 U/ml)、L-谷氨酰胺(GIBCO公司),神经元特异性烯醇化酶(NSE)多克隆抗体、Caspase-3抗体(Abcam 公司),L-多聚赖氨酸(PDL)、磷酸盐缓冲液(PBS)〔生工生物工程(上海)股份有限公司〕,NO试剂盒(南京建成生物工程研究所)。接种培养基:DMEM高糖培养液+10%胎牛血清+双抗(青霉素和链霉素,100 U/ml);无血清培养液:Neurobasal培养液+2%B27培养液添加剂+0.5 mmol/L L-谷氨酰胺+双抗(青霉素和链霉素,100 U/ml);L-多聚赖氨酸溶液(PLL,1 mg/ml):25 mg PDL溶于250 ml PBS中,0.22 μm滤器滤菌,4 ℃冰箱保存备用。
1.4方法
1.4.1大鼠皮质神经元分离及培养在文献[4]基础上稍作改动,取出生24 h内的新生乳鼠12只,在盛有75%乙醇溶液的烧杯中清洗2次,1 min/次,在超净台下迅速断头取脑,置入预冷的玻璃皿中。在体视显微镜下小心剥离皮质表面的脑膜和血管,换用另一把眼科镊小心夹取额部一薄层皮质组织,置于盛有1 ml DMEM高糖培养液的培养皿中,培养皿置于冰上。用眼科剪将皮质组织剪成约1 mm×1 mm碎块,加入0.25%胰酶,使其终浓度为0.125%,充分混匀胰酶,在37 ℃CO2细胞恒温培养箱中消化15 min,5 min时轻轻摇晃培养皿,15 min时加入等量接种培养基终止消化。用1 ml进口枪头轻轻吹打细胞,将吹打后的细胞悬液用200目筛网过滤,4 ℃ 1 000 r/min离心5 min(离心半径13.5 cm),弃上清液,加入2 ml接种培养基重悬细胞,以≥1×106/ml接种到提前经PLL包被的6孔板中,使每孔有2 ml接种培养基,沿前后、左右、左上左下、右上右下方向充分混匀细胞,置于37 ℃ CO2细胞恒温培养箱中培养。4 h后用无血清培养液全量换液1次,以后每3 d半量换液。
1.4.2皮质神经元的鉴定培养8 d的皮质神经元,以抗NSE多克隆抗体作为一抗,采用免疫荧光双重染色方法鉴定皮质神经元:(1)用0.01%预冷的PBS浸洗细胞爬片2次,吸尽PBS,4%多聚甲醛溶液固定5 min,PBS浸洗2次,5 min/次;(2)3%H2O2溶液封闭30 min以消除内源性过氧化物酶活性;(3)PBS浸洗3次,5 min/次;(4)山羊血清封闭30 min;(未浸洗)加入一抗(NSE,1∶500),4 ℃冰箱孵育隔夜(约12 h);(5)PBS浸洗3次,5 min/次,加入二抗;(6)避光孵育60 min后PBS浸洗3次,5 min/次;(7)滴加碘化丙啶(PI)染液(1∶1 000稀释)100 μl,30 s后用PBS浸洗2次,2 min/次;(8)甘油(约30 ml)封固,激光共聚焦显微镜下观察。
1.4.3实验分组分为3组:正常对照组、氧-糖剥夺组、氨基胍组。正常对照组皮质神经元采用Neurobasal培养液+2%B27培养液添加剂培养;氧-糖剥夺组皮质神经元缺氧、缺糖处理45 min后,换Neurobasal培养液+2%B27培养液添加剂培养;氨基胍组皮质神经元缺氧、缺糖处理45 min后,换Neurobasal培养液+2%B27培养液添加剂培养的同时加入终浓度为10 mmol/L氨基胍溶液。
1.4.4氧-糖剥夺模型的建立参照文献[5-6],培养8 d的皮质神经元,吸尽培养液,用PBS轻轻冲洗3次,换用DMEM无糖培养液造成缺糖环境,在细胞缺氧培养箱(37 ℃,充满95%N2和5%CO2)中培养45 min,换Neurobasal培养液+2%B27培养液添加剂培养,在37 ℃ CO2细胞恒温培养箱中培养。实验重复6次。
1.4.5NO表达水平测定分别在培养2、6、12 h时留取各组细胞培养液上清液,置于-80 ℃冻存,采用硝酸还原酶法测定各组不同时间点细胞上清液中NO表达水平,按照试剂盒说明书操作进行。
1.4.6Western blotting法检测Caspase-3表达水平提取蛋白,用BCA法进行蛋白定量,取50 μg总蛋白上样行10%十二烷基磺酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),然后电转至聚偏二氟乙烯(PVDF)膜上,5%脱脂牛奶封闭1 h后加入一抗Caspase-3(1∶1 000),4 ℃孵育过夜,用TBS洗涤6次,5 min/次,加入辣根过氧化物酶标记的二抗(山羊抗兔IgG抗体1∶20 000)室温孵育2 h。再用TBS洗涤6次,5 min/次,加入化学发光试剂(ECL)显色。以β-actin为内参照。实验重复6次,目的条带为32 Ku。采用全能型凝胶成像分析系统Quantity One软件对蛋白条带灰度值进行分析。

2结果
2.1皮质神经元形态学观察皮质神经元接种时形态小,透亮,呈圆形,单个散在分布(见图1A,本文图1、2彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。皮质神经元接种后有少量皮质神经元开始贴壁,2h左右皮质神经元贴壁较多,少量皮质神经元伸出短小的突起,4h左右皮质神经元已基本贴壁,大量皮质神经元伸出突起,周围光晕明显。3d时皮质神经元突起明显伸长,相互交织,皮质神经元透亮,立体感强,呈圆形、椭圆形、梭形(见图1B)。5~6d时皮质神经元细胞体增大,突起交织成网状(见图1C)。7~8d时,皮质神经元细胞体饱满,细胞质透亮,细胞核大而明显,细胞体周围折光性强,立体感好,突起交织成致密的网状结构(见图1D)。
2.2免疫荧光双重染色法鉴定皮质神经元培养8d的皮质神经元,经NSE和PI染液免疫荧光双标染色呈强阳性,激光共聚焦显微镜下观察,细胞质和轴突被染成绿色且细胞核被染成红色的为皮质神经元,细胞核被染成红色而细胞质无染色的为非皮质神经元。经鉴定此分离培养的是皮质神经元,且纯度高、密度大,皮质神经元细胞核染色清晰,形态呈网状结构,阳性率为(93.5±2.3)%(见图2)。
2.3各组不同时间点细胞上清液中NO表达水平比较各组不同时间点细胞上清液中NO表达水平比较,差异均有统计学意义(P<0.05);其中氧-糖剥夺组、氨基胍组不同时间点细胞上清液中NO表达水平较正常对照组升高,差异均有统计学意义(P<0.05);氨基胍组不同时间点细胞上清液中NO表达水平较氧-糖剥夺组降低,差异均有统计学意义(P<0.05,见表1)。
2.4各组不同时间点Caspase-3表达水平比较各组不同时间点Caspase-3表达水平比较,差异均有统计学意义(P<0.05);其中氧-糖剥夺组、氨基胍组不同时间点Caspase-3表达水平较正常对照组升高,差异均有统计学意义(P<0.05);氨基胍组不同时间点,Caspase-3表达水平较氧-糖剥夺组降低,差异均有统计学意义(P<0.05,见表2、图3)。

注:A为接种1 d,B为接种3 d,C为接种5~6 d,D为接种7~8 d
图1倒置相差显微镜下不同时期皮质神经元形态观察(×200)
Figure 1Morphological changes of rat cortical neurons at different time points under inverted phase contrast microscope

注:A为绿光下NSE对神经元染色;B为白光下神经元形态;C为PI染液对细胞核染色;D为混合光下神经元染色
图2免疫荧光双重染色法鉴定皮质神经元(×400)
Figure 2Identification of cortical neurons by immunofluorescence double staining method
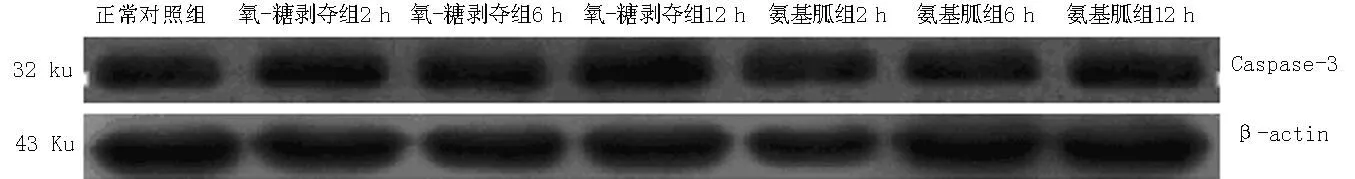
注:Caspase-3=半胱氨酸天冬氨酸蛋白酶3
图3Western blotting法检测Caspase-3表达水平
Figure 3Caspase-3 expression detected by Western blotting method

Table1ComparisonofNOexpressionincellsupernatantatdifferenttimepointsamongthethreegroups

组别2h6h12h正常对照组4.22±0.504.22±0.504.22±0.50氧-糖剥夺组8.67±0.49a11.11±0.79a17.31±0.61a氨基胍组6.89±0.10ab8.89±0.79ab14.44±0.79abF值108.711136.709630.960P值<0.001<0.001<0.001
注:与正常对照组比较,aP<0.05;与氧-糖剥夺组比较,bP<0.05

Table2ComparisonofCaspase-3expressionatdifferenttimepointsamongthethreegroups

组别2h6h12h正常对照组0.20±0.010.20±0.010.20±0.01氧-糖剥夺组0.46±0.04a0.53±0.04a0.70±0.01a氨基胍组0.39±0.01ab0.46±0.01ab0.55±0.02abF值117.185216.266588.428P值<0.001<0.001<0.001
注:与正常对照组比较,aP<0.05;与氧-糖剥夺组比较,bP<0.05
3讨论
研究表明,NO在缺血性脑损伤中存在双重作用,与组织损伤发展进程和产生的一氧化氮合酶(nitric oxide synthase,NOS)的类型有关,根据其来源不同,既表现为对神经的保护作用,又表现为对神经的毒性作用[7-8],生理剂量的NO可以降低血管张力、改善微循环、抑制血小板聚集和黏附、降低白细胞黏附和迁移等,大剂量的NO可与超氧阴离O2-结合形成具有极强细胞毒性的ONOO-[9]。NOS是体内合成NO的关键和唯一的限速酶,有3种类型:神经源型(nNOS)、内皮型(eNOS)、诱导型(iNOS)[10],在脑缺血早期因eNOS激活产生的NO可通过鸟氨酸环化酶使环磷酸鸟苷(cGMP)水平升高,扩张脑血管,从而增加缺血区脑血流量,对抗凋亡,保护脑组织,而由nNOS及iNOS激活产生的NO激活凋亡级联反应通向细胞死亡的最后通路,诱导细胞凋亡[11]。iNOS被激活后催化合成大量的NO,高浓度的NO可以与超氧阴离子反应生成超氧亚硝酸阴离子,并进一步分解为OH和NO2等自由基,可对神经元产生神经毒性,最终引起细胞死亡[12]。在氧-糖剥夺20 min离体脑片模型中,iNOS的活性在缺血损伤后2 h开始出现。如仅剥夺10 min,iNOS的活性在缺血损伤后3 h开始出现,在210 min达到高峰[13]。因此,在脑缺血缺氧早期,iNOS活性的激活以及产生的过量NO对神经的毒性作用是缺血缺氧对脑组织损伤的重要因素。
细胞凋亡即程序化细胞死亡,是细胞的一种自杀方式,其信号转导通路主要有3种:死亡受体通路、内质网通路、线粒体通路[14-15]。这3种信号转导通路均不可逆,且均与Caspase有关,而在Caspase家族中,Caspase-3是所有凋亡级联反应中最为关键的终末凋亡执行蛋白[16-17],因此通过测定Caspase-3的表达水平可间接反映细胞的凋亡。
氨基胍是一种iNOS特异性抑制剂,其对iNOS的抑制能力比NG-甲基-L-精氨酸(L-NAME)更有效[18],其抑制作用是L-NAME的7倍[19],氨基胍通过抑制iNOS 的活性,可减少NO 水平,降低NO 的毒性损伤作用[20]。实验研究提示,氨基胍对缺氧、缺糖损伤体外培养人脑微血管内皮神经元具有保护作用[21],氨基胍可以改善糖尿病视网膜病变,且作用途径与选择性iNOS有关[22]。氨基胍抑制iNOS的机制可能是:(1)与催化部位的血红素铁结合,从而改变活性集团的构象。(2)Bryk等[23]研究发现,氨基胍通过在活性位点上与血红素残基共价结合,并将被修饰的亚铁血红素残基以共价键形式结合于蛋白的活性位点,从而对iNOS起明显的抑制作用。(3)氨基胍可产生大量的自杀性产物来抑制iNOS的产生。
目前,国内外对于氨基胍的神经元保护作用研究主要集中于动物体内实验,而在体外细胞实验中很少。因此,本文以体外原代培养的皮质神经元为实验对象,在皮质神经元经氧-糖剥夺后给予氨基胍进行干预,观察不同时间点NO表达水平及细胞凋亡因子Caspase-3表达水平的变化,从而探讨氨基胍在皮质神经元损伤中的作用。
本研究结果显示,在2、6、12 h氧-糖剥夺组皮质神经元NO表达水平均较正常对照组升高;氨基胍组皮质神经元各时间点NO表达水平均较氧-糖剥夺组降低。提示,缺氧、缺糖引起了皮质神经元的损伤,使NO过度表达,随着时间的延长,NO表达水平逐渐增加,皮质神经元的损伤逐渐加重;氨基胍干预后,NO表达水平在各时间点均明显降低,说明皮质神经元的损伤有所减轻。本研究证实,氨基胍可以减少皮质神经元损伤后NO的过度表达,从而减轻皮质神经元的损伤,对皮质神经元具有一定的保护作用,这与Cash等[24]的研究结果一致。本研究结果显示,在2、6、12 h氧-糖剥夺组皮质神经元Caspase-3表达水平均较正常对照组升高,氨基胍干预后,各时间点皮质神经元Caspase-3表达水平较氧-糖剥夺组均降低。提示,缺氧、缺糖引起了神经元的凋亡,经氨基胍干预后,Caspase-3表达水平在各时间点均明显降低,说明皮质神经元的凋亡有所减轻。本研究证实,氨基胍可抑制凋亡相关因子Caspase-3 的表达水平,从而抑制缺氧、缺糖后皮质神经元的凋亡,对皮质神经元具有一定的保护作用,与Sun等[25]研究结果一致。其机制可能是:皮质神经元缺氧、缺糖损伤后,iNOS被激活,产生了大量的NO,激活了Caspase家族级联反应凋亡途径,致Caspase-3表达水平升高,进而导致皮质神经元发生凋亡。给予氨基胍干预后,氨基胍能选择性抑制iNOS的活性,从而减少NO过度表达,降低了NO对皮质神经元的毒性损伤作用,从而抑制了凋亡因子Caspase-3表达,进而减少了细胞凋亡,起到了保护皮质神经元的作用。
综上所述,氨基胍可抑制氧-糖剥夺大鼠皮质神经元NO及凋亡相关基因Caspase-3的表达,从而抑制皮质神经元的凋亡,对皮质神经元具有保护作用。氨基胍可减轻氧-糖剥夺引起的皮质神经元凋亡,其机制可能是氨基胍通过选择性抑制iNOS活性的表达,减少NO过度表达,从而抑制了凋亡相关基因Caspase-3的表达。本实验仍处于基础研究阶段,仍需在今后对氨基胍最佳药物浓度、潜在的药物不良反应、其他药物干预及其抑制细胞凋亡的具体机制等问题进行深入研究。
作者贡献:唐仕军进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;赵冬、朱立仓、李晓天、朱文学、杨鹏进行实验实施、评估、资料收集;王业忠进行质量控制及审校。
本文无利益冲突。
参考文献
[1]王陇德.中国脑卒中防治报告(2015)[M].北京:中国协和医科大学出版社,2015:5-15.
[2] Ayer RE,Zhang JH.Oxidative stress in subarachnoid haemorrhage:significance in acute brain injury and vasospasm[J].Acta Neurochir Suppl,2008,104:33-41.
[3] Wang XR,Yang CH,Zhao D,et al,Changes of NO and Caspase-3 in oxygen-glucose deprived cortical neurons[J].Acta Medicinae Universitatis Scientiae et Technologiae Huazhong,2014,43(5):550-553.(in Chinese)
王西冉,杨传豪,赵冬,等.氧-糖剥夺致皮层神经元一氧化氮的变化及对Caspase-3的影响[J].华中科技大学学报:医学版,2014,43(5):550-553.
[4]Yang CH,Zhao D,Liu Q,et al.Establishing a serum-free primary culture method for cortical neurons of new-born rats[J].Chongqing Medicine,2014,43(29):3901-3903,3906.(in Chinese)
杨传豪,赵冬,刘琪,等.新生大鼠皮层神经元体外无血清原代培养[J].重庆医学,2014,43(29):3901-3903,3906.
[5]Wang CP,Li GC,Shi YW,et al.Neuroprotective effect of schizandrin A on oxygen and glucose deprivation/reperfusion-induced cell injury in primary culture of rat cortical neurons[J].J Physiol Biochem,2014,70(3):735-747.
[6]Zhu QL,Li YX,Zhou R,et al.Neuroprotective effects of oxysophocarpine on neonatal rat primary cultured hippocampal neurons injured by oxygen-glucose deprivation and reperfusion[J].Pharm Biol,2014,52(8):1052-1059.
[7] Garry PS,Ezra M,Rowland MJ,et al.The role of the nitric oxide pathway in brain injury and its treatment-From bench to bedside[J].Exp Neurol,2015(263):235-243.
[8] Tian HL,Zhou LF,Cui YH,et al.NO upgrades expression of VEGF protein and mRNA in local ischemic brain tissues of rabbits [J].Journal of Apoplexy and Nervous Diseases,2006,23(5):588-590.(in Chinese)
田恒力,周良辅,崔宇辉,等.NO增加兔局灶脑缺血后缺血脑组织VEGF表达[J].中风与神经疾病杂志,2006,23(5):588-590.
[9]Hoffman A,Goldstein S,Samuni A,et al.Effect of nitric oxide and nitric oxide SOD-mimic on the recovery of isolated rat heart following ischemia and reperfusion [J].Biochem Pharmacol,2003,66(7):1279-1286.
[10]ArunaDevi R,Ramteke VD,Kumar S,et al.Neuroprotective effect of s-methylisothiourea in transient focal cerebral ischemia in rat [J].Nitric Oxide,2010,22(1):1-10.
[11]Park CO,Yi HG.Apoptotic change and NOS activity in the experimental animal diffuse axonal injury model[J].Yonsei Med J,2001,42(5):518-526.
[12] Jiang EP,Yu CR,Li H,et al.Protective effects of Schisandra Chinensis lignans on oxidative stress injury of PC12 cells and its mechanism of inhibition on NF-kB/iNOS/NO signaling pathway[J].Journal of Jilin University(Medicine Edition),2015,41(3):532-536.(in Chinese)
姜恩平,于春荣,李贺,等.北五味子总木脂素对PC12细胞氧化应激损伤的保护作用及其抑制NF-kB/ions/NO信号通路的机制[J].吉林大学学报:医学版,2015,41(3):532-536.
[13]Ishikawa K,Calzavacca P,Bellomo R,et al.Effect of selective inhibition of ranal inducible nitric oxide synthase on renal blood flow and function in experimental hyperdynamic sepsis[J].Crit Care Med,2012,40(8):2368-2375.
[14]Pestana CR,Phelippin DP,Polizello AC,et al.Effects on mitochondria of mitochondria-induced nitric oxide release from a ruthenium nitrosyl complex[J].Nitric Oxide,2009,20(1):24-30.
[15]王亚芳,宋春雨.脑缺血再灌注损伤对神经元线粒体DNA影响的研究进展[J].疑难病杂志,2014,13(2):212-214.
[16] Ghavami S,Shojaei S,Yeganeh B,et al.Autophagy and apoptosis dysfunction in neurodegenerative disorders [J].Prog Neurobiol,2014,112(1):24-29.
[17]Kooijman E,Nijboer CH,van Velthoven CT,et al.The rodent endovascular puncture model of subarachnoid hemorrhage:mechanisms of brain damage and therapeutic strategies[J].J Neuroinflammation,2014,11(1):2.
[18]Zhang F,Tadecola C.Temporal characteristics of the protective effect of aminoguanidine on cerebral ischemic damage[J].Brain Res,1998,802(1/2):104-110.
[19]Tilton RG,Chang K,Hasan KS,et al.Prevention of diabetic vascular dysfunction by guanidines.Inhibition of nitric oxide synthase versus advanced glycation end product formation [J].Diabetes,1993,42(2):221-232.
[20]ArunaDevi R,Ramteke VD,Kumar S,et al.Neuroprotective effect of s-methylisothiourea in transient focalcerebral ischemia in rat[J].Nitric Oxide,2010,22(1):1-10.
[21]Li W,Hu Q,Ren X,et al.Aminoguanidine suppresses methylglyoxal-mediated oxygen-glucose deprivation injury in human brain microvascular endothelial cells [J].Zhejiang Da Xue Xue Bao Yi Xue Ban,2013,42(3):261-266.
[22] Luo DW,Zou HD,Liu K,et al.Treat of aminoguanidine in retina of diabetic of rats with selective inhibits induced nitric oxide synthase[J].Chongqing Medicine,2014,43(19):2440-2442.(in Chinese)
罗大卫,邹海东,刘堃,等.氨基胍高选择性抑制iNOS在糖尿病大鼠视网膜中的研究[J].重庆医学,2014,43(19):2440-2442.
[23]Bryk R,Wolff DJ.Mechanism of inducible nitric oxide synthase inactiration by aminoguanidine and L-N6-(l-iminoethyl) lysine [J].Biochemistry,1998,37(14):4844-4852.
[24]Cash D,Beech JS,Rayne RC,et al.Neuroprotective effect of aminoguanidine on transient focal ischaemia in the rat brain [J].Brain Res,2001,905(1/2):91-103.
[25]Sun M,Zhao Y,Gu Y,et al.Neuroprotective actions of aminoguanidine involve reduced the activation of calpain and caspase-3 in a rat model of stroke[J].Neurochem Int,2010,56(4):634-641.
(本文编辑:陈素芳)
Effect of Aminoguanidine on the Expression of NO and Caspase-3 in Rat Cortical Neurons After Oygen Glucose Deprivation
TANGShi-jun,ZHAODong,ZHULi-cang,etal.DepartmentofNeurosurgery,theFirstAffiliatedHospitalofShiheziUniversity,Shihezi832000,China
【Abstract】ObjectiveTo investigate the effect of aminoguanidine on the expression of nitric oxide (NO) and Caspase-3 in rat cortical neurons after oxygen and glucose deprivation.MethodsFrom December 2014 to July 2015,12 SD rats born within 24 hours were selected.The cortical neurons of the rats were separated and cultured,and cortical neurons of primary culture for 8 days were obtained and were divided into three groups:normal control group,oxygen-glucose deprivation group and aminoguanidine group.The cortical neurons of normal control group were cultured by Neurobasal+2%B27 nutrient solution;the cortical neurons of oxygen-glucose deprivation group received 45 min management for hypoxia and lack of sugar,and converted to be cultured by Neurobasal+2%B27 nutrient solution;the cortical neurons of aminoguanidine group received 45 min management for hypoxia and lack of sugar,and converted to be cultured by Neurobasal+2%B27 nutrient solution plus 10 mmol/L aminoguanidine solution.After culture for 2,6 and 12 h,the NO expression in cell supernatant was detected using nitric oxide assay kit,and Caspase-3 expression was detected using Western blotting method.ResultsThe three groups were significantly different in the expression levels of NO in cell supernatant and Caspase-3 at 2,6 and 12 h(P<0.05).Oxygen-glucose deprivation group and aminoguanidine group were higher than normal control group in the expression levels of NO in cell supernatant and Caspase-3 at different time points(P<0.05).Aminoguanidine group was lower than oxygen-glucose deprivation group in the expression levels of NO in cell supernatant and Caspase-3 at different time points(P<0.05).ConclusionAminoguanidine can inhibit the expression of NO and apoptosis related gene Caspase-3 in the rat cortical neurons after oxygen and glucose deprivation,which inhibits the apoptosis of cortical neurons and has a protective effect on the neurons.
【Key words】Neurons;Nitric oxide;Caspase-3;Aminoguanidine
(收稿日期:2015-08-26;修回日期:2016-02-22)
【中图分类号】R 743.33
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.12.015
通信作者:王业忠,832000 新疆石河子市,石河子大学医学院第一附属医院神经外科;E-mail:wangyz2008@126.com
基金项目:国家自然科学资金资助项目(81360185);新疆生产建设兵团博士基金资助项目(2011BB016)

