脂联素对胰岛素抵抗及心室重构的影响研究
张 青,刘雅娟,徐 璐,张 娜,任永康,秦 毅,杨锐英,武海亮
750004 宁夏银川市,宁夏医科大学(张青,徐璐,张娜,任永康,秦毅);宁夏医科大学总医院心脏中心干部病房(刘雅娟,杨锐英,武海亮)
·论著·
脂联素对胰岛素抵抗及心室重构的影响研究
张 青,刘雅娟,徐 璐,张 娜,任永康,秦 毅,杨锐英,武海亮
750004 宁夏银川市,宁夏医科大学(张青,徐璐,张娜,任永康,秦毅);宁夏医科大学总医院心脏中心干部病房(刘雅娟,杨锐英,武海亮)
【摘要】目的探讨脂联素对脂联素基因敲除(APN(-/-) )小鼠胰岛素抵抗所致心室重构的影响。方法2014年10月—2015年1月选择6~8周龄SPF级雄性野生型C57BL小鼠16只和同一品系的雄性APN(-/-) 小鼠16只,采用随机数字表法将16只野生型C57BL小鼠分为:对照组和胰岛素抵抗组(IR组),16只APN(-/-) 小鼠分为:APN(-/-)+胰岛素抵抗组(KIR组)和APN(-/-)+胰岛素抵抗+脂联素干预组(APN组),每组8只。对照组小鼠给予普通饲料,IR组、KIR组、APN组小鼠给予高脂饲料诱导胰岛素抵抗模型,APN组小鼠给予重组脂联素腹腔注射,喂养并干预12周。采用血糖仪快速检测小鼠空腹血糖(FPG)水平;采用酶联免疫吸附试验(ELISA)法检测血清空腹胰岛素(FINS)及脂联素水平,计算胰岛素抵抗指数(HOMA-IR);留取小鼠左心室并称其重量,计算心脏重量指数(HWI)和左心室重量指数(LVWI);苏木素-伊红(HE)染色光镜下观察心肌组织;采用免疫组织化学法及Western blotting法测定心肌脂联素受体1表达水平。结果第6周、第10周、第11周、第12周KIR组小鼠体质量较对照组升高(P<0.05)。IR组小鼠血清FPG水平、IR组和KIR组小鼠血清FINS水平、HOMA-IR、HWI、LVWI较对照组升高(P<0.05);IR组、KIR组、APN组小鼠血清脂联素水平较对照组降低(P<0.05);KIR组小鼠血清FPG、脂联素水平较IR组降低,FINS水平、HWI、LVWI较IR组升高(P<0.05);APN组小鼠血清FPG水平、HOMA-IR、脂联素水平、HWI、LVWI较IR组降低(P<0.05);APN组小鼠血清FINS水平、HOMA-IR、HWI、LVWI较KIR组降低,脂联素水平较KIR组升高(P<0.05)。HE染色显示,对照组心肌细胞排列整齐,细胞核大小均一,细胞质染色均匀;IR组和KIR组均见心肌细胞排列紊乱,细胞核大小不规则;KIR组可见心肌细胞肌纤维断裂、排列非常紊乱;APN组心肌细胞排列较整齐,紊乱改善。免疫组织化学法结果显示,IR组及KIR组小鼠心肌脂联素受体1表达水平较对照组和APN组降低(P<0.05);KIR组小鼠心肌脂联素受体1表达水平较IR组降低(P<0.05)。Western blotting法结果显示,IR组、KIR组、APN组小鼠心肌脂联素受体1表达水平较对照组降低(P<0.05);KIR组小鼠心肌脂联素受体1表达水平较IR组、APN组降低(P<0.05)。LVWI与HOMA-IR呈正相关(r=0.643,P<0.001),LVWI与血清脂联素水平及心肌脂联素受体1表达水平呈负相关(r=-0.570,P=0.002;r=-0.520,P=0.008)。结论胰岛素抵抗导致的心室重构可能与血清脂联素水平及心肌脂联素受体1表达水平下降有关,外源脂联素干预可以改善胰岛素抵抗导致的心室重构。
【关键词】脂联素;胰岛素抵抗;心室重构
张青,刘雅娟,徐璐,等.脂联素对胰岛素抵抗及心室重构的影响研究[J].中国全科医学,2016,19(12):1401-1407.[www.chinagp.net]
Zhang Q,Liu YJ,Xu L,et al.Influence of adiponectin on insulin resistance and ventricular remodeling [J].Chinese General Practice,2016,19(12):1401-1407.
脂联素是脂肪细胞分泌的一种细胞因子,与脂联素受体结合发挥作用,具有调节糖、脂代谢,增加脂肪酸氧化,提高葡萄糖摄取,改善胰岛素敏感性等作用[1]。心室重构是导致心力衰竭的重要原因之一,胰岛素抵抗与心室重构密切相关,但脂联素及脂联素受体1与心室重构的关系尚未明确。本研究以野生型C57BL小鼠和脂联素基因敲除(APN-/-)小鼠为研究对象,建立胰岛素抵抗模型,并采用外源脂联素进行干预,检测小鼠血清脂联素水平、心脏重量指数(HWI)和左心室重量指数(LVWI)、心肌脂联素受体1表达水平,探讨脂联素对胰岛素抵抗及心室重构的影响,为脂联素改善胰岛素抵抗所致的心室重构提供理论依据。
1材料与方法
1.1材料
1.1.1实验动物2014年10月—2015年1月选择6~8周龄SPF级雄性野生型C57BL小鼠16只和同一品系的雄性APN-/-小鼠16只,体质量(20±2)g,健康状况良好,由上海南方模式生物研究中心提供,合格证号:SCXK(沪)2009-0023。在宁夏医科大学实验动物中心SPF级动物房饲养,4只/笼,温度20~25 ℃,12 h/12 h昼夜规律。采用随机数字表法将16只野生型
本研究背景和创新点:
脂联素是一种高表达的脂肪因子,通过与脂联素受体结合发挥增加胰岛素敏感性的作用,在产生肥胖相关的胰岛素抵抗时,脂联素及脂联素受体表达均降低,从而激活糖、脂代谢调控途径。近年来对脂联素的关注逐渐增加,心肌主要表达脂联素受体1。心室重构是引起心力衰竭的主要原因之一,已有研究表明,胰岛素抵抗可以加重心室重构,但尚未明确脂联素是否能够通过改善胰岛素抵抗途径改善心室重构,故本研究选用脂联素基因敲除(APN-/-)小鼠作为研究对象,同时选用野生型C57BL小鼠作为对照,选择高脂饲料诱导胰岛素抵抗,同时予以外源脂联素干预,均喂养并干预12周后,观察胰岛素抵抗相关指标、心室重构相关指标及血清脂联素水平、心肌脂联素受体1表达水平等变化,并作相关分析探讨脂联素是否通过改善胰岛素抵抗来改善心室重构。
C57BL小鼠分为:对照组和胰岛素抵抗组(IR组),16只APN-/-小鼠分为:APN-/-+胰岛素抵抗组(KIR组)和APN-/-+胰岛素抵抗+脂联素干预组(APN组),每组8只。
1.1.2主要试剂血糖仪及血糖试纸条购自美国强生公司,小鼠血清脂联素和胰岛素酶联免疫吸附试验(ELISA)检测试剂盒购自美国R&D公司,全蛋白提取试剂盒、5X蛋白上样缓冲液、二氨基联苯胺(DAB)显色试剂盒以及BCA蛋白含量检测试剂盒均购自南京凯基生物科技发展有限公司,免疫组织化学法检测试剂盒及辣根过氧化物酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司,普通饲料由宁夏医科大学实验动物中心提供,高脂饲料(D12492)购自美国Research Diet公司,脂联素受体1一抗(ab12611)购自美国abcam公司,ECL发光液购自美国Thermo公司。
1.2方法
1.2.1胰岛素抵抗模型的建立小鼠均适应性喂养1周后进入实验。对照组小鼠给予普通饲料,IR组、KIR组、APN组小鼠给予高脂饲料诱导胰岛素抵抗模型;APN组小鼠同时给予10 μg·kg-1·d-1重组脂联素腹腔注射。所有小鼠每周称体质量,喂养并干预12周。
1.2.2标本采集及实验室指标检测干预12周后,所有小鼠禁食12 h,断尾取血采用血糖仪快速检测小鼠空腹血糖(FPG)水平。然后采用摘除眼球法取小鼠血液1~2 ml,静置2 h,以3 000 r/min离心10 min(离心半径13.5 cm),分离出血清,-80 ℃保存留用,采用ELISA法检测血清空腹胰岛素(FINS)及脂联素水平。采用公式计算胰岛素抵抗指数(HOMA-IR),HOMA-IR =(FPG×FINS)/22.5。
1.2.3心室重构指标测定及形态学观察小鼠取血后迅速开胸,剪断大血管取出心脏,去除心脏周围结缔组织,用4 ℃ 0.9%氯化钠溶液洗净,称小鼠全心重量,沿房室交界去除心房及右心室游离壁,保留小鼠左心室并称其重量。计算小鼠HWI和LVWI,HWI=心脏重量/体质量,LVWI=左心室重量/体质量。取心尖部左心室置于多聚甲醛溶液固定,石蜡包埋、切片,常规苏木素-伊红(HE)染色,镜下观察心肌纤维排列及细胞核情况。
1.2.4免疫组织化学法检测心肌脂联素受体1表达水平将左心室组织石蜡切片在二甲苯及降序梯度乙醇溶液中常规脱蜡,过氧化氢(H2O2)灭活内源性过氧化物酶,然后用胎牛血清封闭液封闭,加脂联素受体1一抗4 ℃过夜孵育,次日滴加生物素二抗,用DAB显色剂显色。在10×40倍光镜下观察拍片,选取同一个放大倍数下3个不同视野的图像测定光密度。
1.2.5Western blotting法检测心肌脂联素受体1表达水平采用蛋白提取试剂盒提取心肌组织中的蛋白,蛋白检测试剂盒检测提取的蛋白浓度,每组蛋白定量后,取50 μg蛋白进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),转到聚偏二氟乙烯(PVDF)膜上,用含5%脱脂牛奶的TBST封闭后,加入脂联素受体1一抗4 ℃过夜孵育,次日用山羊抗兔二抗孵育1 h,滴加ECL发光液后在暗室中压X胶片。用扫描仪扫描出胶片图像,采用灰度分析法计算吸光度(OD值),以样本组OD值/内参OD值作为统计分析数据。

2结果
2.14组小鼠不同时间体质量比较干预前及干预第1周、第2周、第3周、第4周、第5周、第7周、第8周、第9周4组小鼠体质量比较,差异无统计学意义(P>0.05);干预第6周、第10周、第11周、第12周4组小鼠体质量比较,差异有统计学意义(P<0.05);其中KIR组小鼠体质量较对照组升高,差异有统计学意义(P<0.05,见表1)。
2.24组小鼠实验室指标及心室重构指标比较4组小鼠血清FPG、FINS水平、HOMA-IR、脂联素水平、HWI、LVWI比较,差异有统计学意义(P<0.05);IR组小鼠血清FPG水平、IR组和KIR组小鼠血清FINS水平、HOMA-IR、HWI、LVWI较对照组升高,差异有统计学意义(P<0.05);IR组、KIR组、APN组小鼠血清脂联素水平较对照组降低,差异有统计学意义(P<0.05);KIR组小鼠血清FPG、脂联素水平较IR组降低,FINS水平、HWI、LVWI较IR组升高,差异有统计学意义(P<0.05);APN组小鼠血清FPG水平、HOMA-IR、脂联素水平、HWI、LVWI较IR组降低,差异有统计学意义(P<0.05);APN组小鼠血清FINS水平、HOMA-IR、HWI、LVWI较KIR组降低,脂联素水平较KIR组升高,差异有统计学意义(P<0.05,见表2)。
2.3HE染色结果HE染色显示,对照组心肌细胞排列整齐,细胞核大小均一,细胞质染色均匀;IR组和KIR组均见心肌细胞排列紊乱,细胞核大小不规则;KIR组可见心肌细胞肌纤维断裂、排列非常紊乱;APN组心肌细胞排列较整齐,紊乱改善(见图1,本文图1~2彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.4免疫组织化学法检测结果心肌脂联素受体1阳性染色主要位于细胞质,为棕黄色云雾状或粗细不一的颗粒,以出现棕黄色物质为阳性表现(见图2)。4组小鼠心肌脂联素受体1表达水平比较,差异有统计学意义(P<0.05);其中IR组及KIR组小鼠心肌脂联素受体1表达水平较对照组和APN组降低,差异有统计学意义(P<0.05);KIR组小鼠心肌脂联素受体1表达水平较IR组降低,差异有统计学意义(P<0.05,见表3)。
2.5Westernblotting法结果4组小鼠心肌脂联素受体1表达水平比较,差异有统计学意义(P<0.05);其中IR组、KIR组、APN组小鼠心肌脂联素受体1表达水平较对照组降低,差异有统计学意义(P<0.05);KIR组小鼠心肌脂联素受体1表达水平较IR组、APN组降低,差异有统计学意义(P<0.05,见表4)。
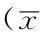
表1 4组小鼠不同时间体质量比较±s,g)
注:IR组为胰岛素抵抗组,KIR组为脂联素基因敲除(APN-/-)+胰岛素抵抗组,APN组为APN-/-+胰岛素抵抗+脂联素干预组;与对照组比较,aP<0.05
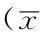
表2 4组小鼠实验室指标及心室重构指标比较±s)
注:FPG=空腹血糖,FINS=空腹胰岛素,HOMA-IR=胰岛素抵抗指数,HWI=心脏重量指数,LVWI=左心室重量指数;与对照组比较,aP<0.05;与IR组比较,bP<0.05;与KIR组比较,cP<0.05

注:IR组为胰岛素抵抗组,KIR组为脂联素基因敲除(APN-/-)+胰岛素抵抗组,APN组为APN-/-+胰岛素抵抗+脂联素干预组
图14组小鼠心肌细胞HE染色结果(×400)
Figure 1HE staining results of myocardial cells of the four groups
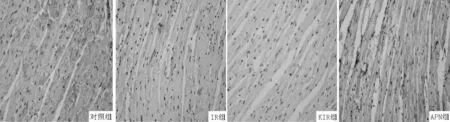
图2 免疫组织化学法检测小鼠心肌脂联素受体1表达(×400)
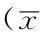
Table 3Comparison of myocardial adiponectin receptor 1 expression with immunohistochemical method among the four groups
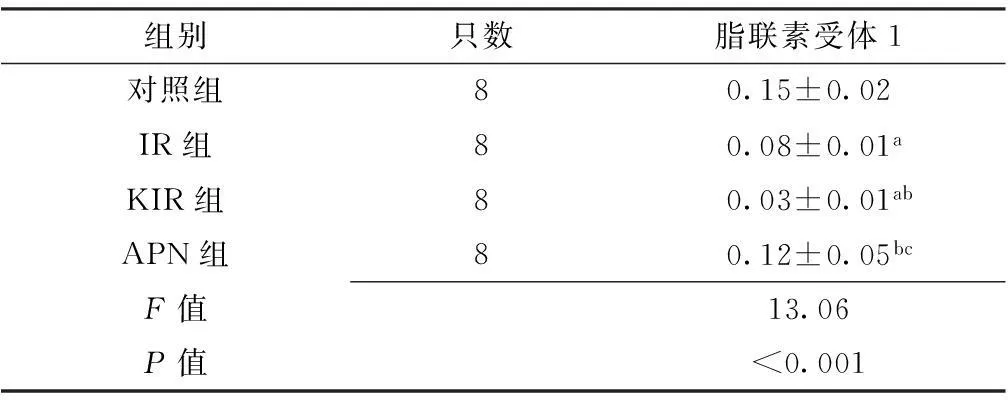
组别只数脂联素受体1对照组80.15±0.02IR组80.08±0.01aKIR组80.03±0.01abAPN组80.12±0.05bcF值13.06P值<0.001
注:与对照组比较,aP<0.05;与IR 组比较,bP<0.05;与KIR组比较,cP<0.05

Table 4Comparison of myocardial adiponectin receptor 1 expression with Western blotting method among the four groups

组别只数脂联素受体1对照组81.41±0.29IR组81.03±0.08aKIR组80.43±0.20abAPN组80.66±0.15acF值30.18P值<0.001
注:与对照组比较,aP<0.05;与IR 组比较,bP<0.05;与KIR组比较,cP<0.05
2.6Pearson直线相关分析LVWI与HOMA-IR呈正相关(r=0.643,P<0.001),LVWI与血清脂联素水平及心肌脂联素受体1表达水平呈负相关(r=-0.570,P=0.002;r=-0.520,P=0.008)。
3讨论
3.1胰岛素抵抗小鼠模型的建立本研究结果显示,KIR组小鼠体质量、IR组小鼠血清FPG水平、IR组及KIR组小鼠血清FINS水平及HOME-IR均较对照组明显升高,提示胰岛素抵抗小鼠模型造模成功。高脂饮食是导致肥胖、胰岛素抵抗及2型糖尿病的重要危险因素,因此模拟人类胰岛素抵抗的高脂饲料诱导动物胰岛素抵抗模型成为研究胰岛素抵抗的常用模型[2]。已有实验证明,雄性野生型C57BL小鼠喂养高脂饲料1月余即可出现胰岛素耐量明显异常[3]。本研究中KIR组小鼠血清FINS水平较IR组进一步升高,提示APN-/-后小鼠胰岛素抵抗程度进一步加重。APN-/-小鼠几乎不表达脂联素基因,有研究发现,心肌脂联素受体1表达水平与血清脂联素水平呈正相关[4],故APN-/-小鼠脂联素受体1表达水平也明显降低,在高脂饲料喂养时,失去脂联素与受体结合发挥对糖、脂代谢通路调节的激活作用,进而使糖、脂代谢紊乱加重,胰岛素抵抗进一步加重。Kubota等[5]实验表明,APN-/-小鼠显示出严重的胰岛素抵抗,证实了脂联素对于维持胰岛素敏感性是必需的,本研究结果与以上研究结果基本一致。
3.2脂联素及脂联素受体1与胰岛素抵抗的关系本研究结果显示,IR组及KIR组小鼠血清脂联素水平及心肌脂联素受体1表达水平均较对照组降低;KIR组小鼠血清脂联素水平及心肌脂联素受体1表达水平均较IR组进一步降低,提示脂联素及脂联素受体1与胰岛素抵抗密切相关。APN-/-小鼠失去了脂联素提高胰岛素敏感性的作用,表现为更严重的胰岛素抵抗。近几年脂联素因具有改善胰岛素抵抗、抗动脉粥样硬化等作用而受到关注,临床研究发现,血清脂联素水平在肥胖、胰岛素抵抗、胰岛素抵抗伴肥胖患者中逐渐降低,提示脂联素是联系肥胖和胰岛素抵抗的纽带[6]。脂联素受体有3种,分别为脂联素受体1、脂联素受体2和钙黏蛋白[7],心肌细胞主要表达脂联素受体1,脂联素与脂联素受体1结合发挥改善胰岛素抵抗的作用机制可能为:脂联素受体1通过增强脂联素对腺苷酸活化蛋白激酶(AMPK)[8]、p38 丝裂原活化蛋白激酶和过氧化物酶体增殖物激活受体α的调节,以促进脂肪酸的β氧化、增加葡萄糖的摄取并抑制糖原的合成,使细胞内的脂质含量降低,进而提高对胰岛素的敏感性,降低胰岛素抵抗水平[9]。也有学者认为,脂联素与脂联素受体1结合后可以通过激活核因子(NF)-кB诱导巨噬细胞产生白介素6(IL-6),IL-6可通过激活因子通路来提高胰岛素的敏感性[10]。而胰岛素与脂联素受体1相互作用的机制十分复杂,可能还存在其他信号转导途径来相互影响。
3.3胰岛素抵抗与心室重构的关系本研究结果显示,IR组小鼠HWI及LVWI较对照组升高,形态学见心肌细胞排列紊乱、细胞核大小不规则等,提示胰岛素抵抗小鼠发生了心室重构,Pearson直线相关分析显示,LVWI与HOMA-IR呈正相关。胰岛素抵抗与心室重构关系密切,胰岛素抵抗导致心室重构主要与胰岛素抵抗时心肌能量代谢改变有关,过氧化物酶体增生物激活受体被激活,使游离脂肪酸增加,心肌细胞对葡萄糖的利用减少,过度依赖脂肪酸氧化供能,长链脂酰辅酶A增多,可引起心肌细胞内神经酰胺水平升高,神经酰胺能促使心肌细胞凋亡[11],进而引起心室重构;另一方面,心肌细胞内沉积的中性脂蛋白和脂肪酸可以直接损伤心肌细胞肌原纤维的功能,使心肌细胞发生纤维化,促使心室发生重构。本研究中,KIR组小鼠胰岛素抵抗及心室重构均进一步加重。上文论述小鼠血清脂联素水平及心肌脂联素受体1表达水平降低可以加重胰岛素抵抗,而胰岛素抵抗可引起心室重构,故推测APN-/-后失去了脂联素与脂联素受体1结合激活糖、脂代谢通路的作用,进而加重了胰岛素抵抗,引起更严重的心室重构。最新研究也发现,脂联素受体1表达水平与HOMA-IR呈负相关[4],本研究结果与之一致。
3.4脂联素及脂联素受体1与心室重构的关系本研究结果显示,IR组小鼠血清脂联素水平及心肌脂联素受体1表达水平较对照组降低,出现心室重构;KIR组小鼠血清脂联素水平及心肌脂联素受体1表达水平较IR组进一步降低,心室重构程度加重,提示血清脂联素水平及心肌脂联素受体1表达水平与心室重构密切相关,Pearson直线相关分析示LVWI与血清脂联素水平及心肌脂联素受体1表达水平呈负相关。动物实验发现,大鼠血清脂联素水平和心肌脂联素受体1表达水平在心室重构的形成过程中起着至关重要的作用[12]。脂联素可以通过抑制内皮细胞增殖,增加一氧化氮(NO)合成,改善内皮功能[13],从而对血管重构产生重要作用;此外,脂联素还可抑制肿瘤坏死因子α(TNF-α)促脂解,减少循环中游离脂肪酸水平,减少对心肌的损害,改善心室重构。结合以上论述,笔者推测脂联素可通过多种途径改善心室重构,胰岛素抵抗是导致心室重构的重要原因之一,推测脂联素通过减轻胰岛素抵抗可以改善心室重构。Sun等[14]在APN-/-小鼠研究中发现,脂联素可以通过激活依赖AMPK的过氧化物酶体增殖物激活受体α(PPAR-α)而起到抑制心肌纤维化及抑制心室重构的作用。
3.5外源脂联素对胰岛素抵抗及心室重构的影响本研究结果显示,APN组小鼠血清FINS水平、HOME-IR、HWI、LVWI均较KIR组降低,APN组小鼠血清脂联素水平及心肌脂联素受体1表达水平较KIR组升高,提示给予外源脂联素干预胰岛素抵抗APN-/-小鼠可以减轻胰岛素抵抗,改善心室重构,增加血清脂联素水平及心肌脂联素受体1表达水平,也进一步证明脂联素及脂联素受体1与胰岛素抵抗所致的心室重构密切相关。有研究证明,一次性注射10~30 μg/kg外源脂联素可降低糖尿病小鼠血糖水平[15]。本实验连续使用较低剂量重组脂联素,使APN-/-小鼠脂联素接近生理分泌剂量,并作用于整个病程,可以增加APN-/-小鼠血清脂联素水平,进而促进脂联素受体1的表达,增加脂联素对糖、脂代谢通路的调节作用,减轻胰岛素抵抗,并进一步改善心室重构。Ding等[1]研究证实,外源脂联素干预可以改善慢性间歇性缺氧引起的大鼠左心室重构。因此,推测外源脂联素干预可以影响脂联素及脂联素受体1的表达,进而改善胰岛素抵抗所致的心室重构,再次证明脂联素及脂联素受体1在胰岛素抵抗所致心室重构的形成过程中起着至关重要的作用。
综上所述,本研究认为胰岛素抵抗可以导致心室重构,脂联素及脂联素受体1与胰岛素抵抗所致的心室重构密切相关,给予外源脂联素可以减轻岛素抵抗,进而改善心室重构程度。为脂联素改善心室重构提供了理论依据,但由于心室重构的过程比较复杂,具体机制有待进一步研究证实。
作者贡献:张青进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;刘雅娟、徐璐、张娜、任永康、武海亮进行实验实施、评估、资料收集;秦毅、杨锐英进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Ding WX,Dong YB,Ding N,et al.Adiponectin protects rat heart from left ventricular remodeling induced by chronic intermittent hypoxia via inhibition of TGF-β/smad2/3 pathway[J].J Thorac Dis,2014,6(9):1278-1284.
[2]Meng W.The mechanism of chlorogenic acid inhibits insulin resistance in mice[D].Changsha:Hunan Agricultural University,2011.(in Chinese)
孟文.绿原酸抑制小鼠胰岛素抵抗发生的作用机制[D].长沙:湖南农业大学,2011.
[3]Tian AP,Guo SS,Shen ZF,et al.Insulin resistant animal model established by high fat diet[J].Chinese Pharmacological Bulletin,2006,22(3):267-269.(in Chinese)
田爱平,郭赛珊,申竹芳,等.高脂饲料与胰岛素抵抗动物模型[J].中国药理学通报,2006,22(3):267-269.
[4]Li J,Su S,Zong X.Analysis of the association between adiponectin,adiponectin receptor 1 and diabetic cardiomyopathy[J].Exp Ther Med,2014,7(4):1023-1027.
[5]Kubota N,Terauchi Y,Yamauchi T,et al.Disruption of adiponectin causes insulin resistance and neointimal formation[J].J Biol Chem,2002,227(29):25863-25866.
[6]Zhang Y,Li YM,Feng YQ,et al.Relationship among serum adiponectin level,obesity and insulin resistance[J].Journal of Shandong University(Health Sciences),2009,47(6):126-129.(in Chinese)
张媛,李英敏,冯月秋,等.血清脂联素水平与肥胖、胰岛素抵抗的关系探讨[J].山东大学学报:医学版,2009,47(6):126-129.
[7]Kharroubi I,Rasschaert J,Eizirik DL,et al.Expression of adiponectin receptors in pancreatic beta cells[J].Biochem Biophys Res Commun,2003,312(4):1118-1122.
[8]Yamauchi T,Kamon J,Waki H,et al.The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity[J].Nat Med,2001,7(8):941-946.
[9]Finck BN.The role of the peroxisome proliferator-activated receptor alpha pathway in pathological remodeling of the diabetic heart[J].Curr Opin Clin Nutr Metab Care,2004,7(4):391-396.
[10]Awazawa M,Ueki K,Inabe K,et al.Adiponectin enhances insulin sensitivity by increasing hepatic IRS-2 expression via a macrophage-derived IL-6-dependent pathway[J].Cell Metabolism,2011,13(4):401-412.
[11]Unger RH,Orci L.Diseases of liporegulation:new perspective on obesity and related disorders[J].FASEB J,2001,15(2):312-321.
[12]Sun R,Liu YJ,Sun HQ,et al.Relationship of expressions of adiponenctin,adiponectin receptors 1 and the degree of insulin resistance to ventricular remodeling in spontaneously hypertensive rats[J].Chinese General Practice,2013,16(4):1356-1359,1365.(in Chinese)
孙蕊,刘雅娟,孙红茜,等.自发性高血压大鼠血清脂联素和心肌脂联素受体1 的表达及胰岛素抵抗程度与心室重构的关系研究[J].中国全科医学,2013,16(4):1356-1359,1365.
[13]Yadav A,Kataria MA,Saini V,et al.Role of leptin and adiponectin in insulin resistance[J].Clin Chim Acta,2013,417(10):80-84.
[14]Sun L,Ye HY,Zhang YH,et al.Epidermal growth factor receptor antibody plus recombinant human endostatin in treatment of hepatic metastases after remnant gastric cancer resection[J].World J Gastroenterol,2007,13(45):6115-6118.
[15]Yu YW,Xi NN,Liu LZ,et al.Effect of recombinant mouse adiponectin on ob/ob mice with diabetic cardiomyopathy cells[J].Journal of Harbin Medical University,2010,44(2):117-120.(in Chinese)
于彦伟,奚宁宁,刘丽珠,等.重组脂联素对ob/ob小鼠糖尿病心肌微血管病变的影响[J].哈尔滨医科大学学报,2010,44(2):117-120.
(本文编辑:陈素芳)
Influence of Adiponectin on Insulin Resistance and Ventricular Remodeling
ZHANGQing,LIUYa-juan,XULu,etal.NingxiaMedicalUniversity,Yinchuan750004,China
【Abstract】ObjectiveTo investigate the influence of adiponectin on ventricular remodeling induced by insulin resistance in adiponectin gene knockout (APN(-/-)) mice.MethodsFrom October 2014 to January 2015,we selected 16 SPF male wild type C57BL mice aged 6 to 8 weeks and 16 male APN(-/-) mice of the same species.Using random number table method,we divided the 16 wild type C57BL mice into control group and insulin resistance group (IR group) and divided 16 APN(-/-) mice into APN(-/-) + insulin resistance group (KIR group) and APN(-/-)+insulin resistance+adiponectin intervention group (APN group),with 8 mice in each group.Control group was given common feed;IR group,KIR group and APN group were given high-fat feed to induce insulin resistance model;APN group was given intraperitoneal injection of recombinant adiponectin;the feed and intervention lasted for 12 weeks.Glucometer was used to detect FPG level;ELISA was used to detect FINS level and adiponectin level,and HOMA-IR was calculated.The ventriculus sinister of mice was taken to calculate HWI and LVWI,and cardiac muscle tissue was observed by HE staining and microscopy;immunohistochemical method and Western blotting method were employed to determine the expression level of myocardial adiponectin receptor 1.ResultsKIR group was higher than control group in body weight in week 6,week 10,week 11 and week 12 (P<0.05).Compared with control group,IR group was higher in the serum level of FPG,and IR group and KIR group were higher in the levels of FINS and HOMA-IR,HWI and LVWI (P<0.05);IR group,KIR group and APN group were lower than control group in the serum level of adiponectin (P<0.05);KIR group was lower in the serum levels of FPG and adiponectin and was higher in level of FINS,HWI and LVWI than IR group (P<0.05);APN group was lower than IR group in the serum levels of FPG,HOMA-IR,adiponectin,HWI and LVWI (P<0.05);APN group was lower in the levels of FINS and HOMA-IR,HWI and LVWI and was higher in the level of adiponectin than KIR group (P<0.05).HE staining showed the following results:in control group,myocardial cells were in order,and the size of cell nucleus and cytoplasmic staining were homogeneous;in IR group and KIR group,myocardial cells were in order,and the size of cell nucleus was irregular;in KIR group,the fracture of muscle fiber of myocardial cells was observed,and myocardial cells were in disorder;in APN group,myocardial cells were improved to be less disordered.The results of immunohistochemical method showed that IR group and KIR group were lower than control group and APN group in the expression level of myocardial adiponectin receptor 1(P<0.05);KIR group was lower than IR group in the expression level of myocardial adiponectin receptor 1(P<0.05).The results of Western blotting method showed that IR group,KIR group and APN group were lower than control group in the expression level of myocardial adiponectin receptor 1(P<0.05);KIR group was lower than IR group and APN group in the expression level of myocardial adiponectin receptor 1 (P<0.05).LVWI was positively correlated with HOMA-IR (r=0.643,P<0.001),and LVWI was negatively correlated with the serum level of adiponectin and myocardial adiponectin receptor 1 expression (r=-0.570,P=0.002;r=-0.520,P=0.008).ConclusionVentricular remodeling caused by insulin resistance may be correlated with the reduction of serum adiponectin level and myocardial adiponectin receptor 1 expression,and exogenous adiponectin intervention can improve ventricular remodeling caused by insulin resistance.
【Key words】Adiponectin;Insulin resistance;Ventricular remodeling
(收稿日期:2015-10-13;修回日期:2016-02-25)
【中图分类号】R 587.1
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.12.010
通信作者:杨锐英,750004宁夏银川市,宁夏医科大学总医院心脏中心干部病房;E-mail:18395298078@163.com
基金项目:国家自然科学基金资助项目(81360026)

