化学实验常考题型分析
化学实验常考题型分析
◇山东张春梅
化学实验的考查由以前的知识型向实践和操作型转化,不仅考查考生们掌握基础知识的基本能力,更重要的是运用基础知识去解决现实生中的一些问题,现将化学实验常考题型及解题策略总结如下.
1实验准备及操作问题

A用玻璃棒蘸取CH3COOH溶液滴在用水湿润的pH试纸上,测定该溶液的pH;
B中和滴定时,滴定管用所盛装的反应液润洗2或3次;
C用图1装置分液,放出水相后再从分液漏斗下口放出有机相;
D用图2装置加热分解NaHCO3固体

图1 图2


2实验现象及结论判断问题

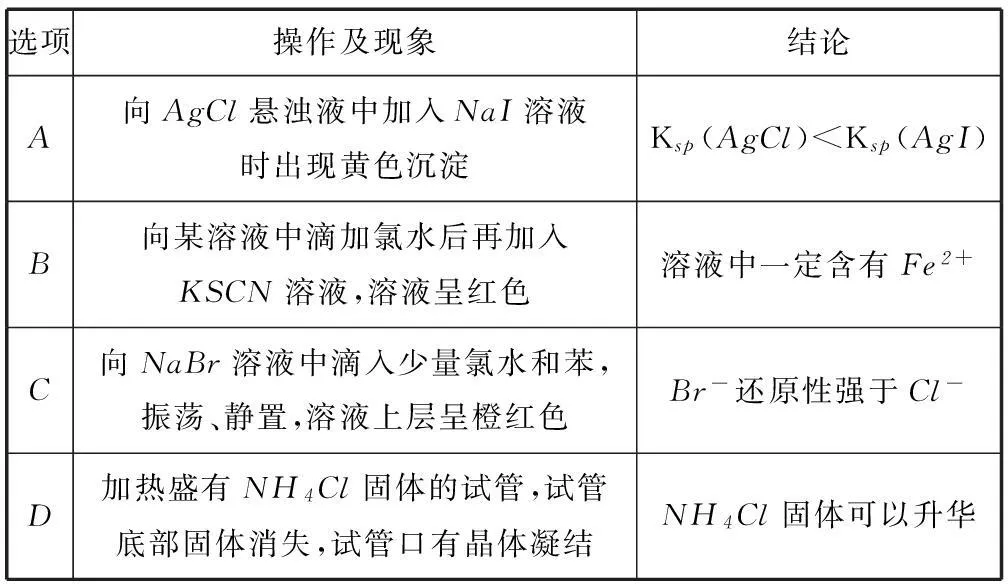
选项操作及现象结论A向AgCl悬浊液中加入NaI溶液时出现黄色沉淀Ksp(AgCl) 为决策专家et给出的所采用的应急方案在指标cn下的最低要求,可作为初期筛选应急方案的参考值,也可作为判定最佳应急方案的参考值,也是1个CFGJ,可将其转换为PD-HFLTS,t=1,2,,T,n=1,2,,N。 3化合物制取有关的实验问题 实验1:制取氯酸钾和氯水,利用图3所示的实验装置进行实验. 图3 图4 (1) 制取实验结束后,取出B中试管冷却结晶、过滤、洗涤.该实验操作过程需要的玻璃仪器有________. (2) 若对调B和C装置的位置______(填“能”“不能”)提高B中氯酸钾的产率. 实验2:氯酸钾与碘化钾反应的探究. (3) 在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列实验的记录如表1(实验在室温下进行). 表1 ① 系列实验的实验目的是________. ③ 若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为________. 实验3: 测定饱和氯水中氯元素的总量. (4) 该小组设计的实验方案为:使用图4装置,加热15.0mL饱和氯水试样,测定产生气体的体积.此方案不可行的主要原因是________.(不考虑实验装置及操作失误导致不可行的原因) (5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):________. 资料: Ⅰ. 次氯酸会破坏酸碱指示剂; Ⅱ. 次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-. (2) 实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有HCl,HCl极易溶于水,能和KOH反应生成KCl杂质,若对调B和C装置,可以除去HCl杂质,能提高B中氯酸钾的产率. (3) ① 根据表格数据分析:对照试管1、2、3、4中数据发现改变的只有硫酸的体积和水的量,所以主要是研究反应体系中硫酸浓度对反应产物的影响; ② 1号试管硫酸浓度为0,设计1号试管实验的作用是做对照实验,比较硫酸浓度影响反应产物; ③ 若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色说明有碘单质生成,假设氧化产物唯一,还原产物为氯化钾,根据氧化还原反应中电子守恒和原子守恒,该反应的离子方程式为 (5) 根据题干信息次氯酸会破坏酸碱指示剂,因此实验设计时不用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的H2O2溶液,发生氧化还原反应,然后加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,产生沉淀,称量沉淀质量,根据氯元素守恒确定氯元素的质量. (作者单位:山东省平度市山东省华侨中学)









