利巴韦林对小鼠生长发育和小肠组织形态结构的影响
范荣莉,蒋 涛,艾 凤,方 旭,王俊程,龚正清,车传燕
(安徽科技学院 动物科学学院,安徽 凤阳 233100)
利巴韦林对小鼠生长发育和小肠组织形态结构的影响
范荣莉,蒋涛,艾凤,方旭,王俊程,龚正清,车传燕*
(安徽科技学院动物科学学院,安徽凤阳233100)
摘要:目的:研究不同剂量的利巴韦林对小鼠生长发育和小肠组织形态结构的影响。方法:30只1月龄小鼠随机分为3组,对照组灌胃生理盐水,低、高剂量利巴韦林组分别按照5mg/kg、10mg/kg体重灌胃药物,连续用药14d,每周清晨称重,采集血液和组织样品。结果:利巴韦林能够提高小鼠日增重,且低剂量用药7d的促生长效果明显(P<0.05)。给药14d后,低剂量组脾脏指数比高剂量组显著增加 (P<0.05)。与对照组相比,高、低剂量利巴韦林组红细胞数下降,白细胞总数增加,中性粒细胞数量极显著降低(P<0.01),淋巴细胞数量极显著升高(P<0.01) ,低剂量组白细胞总数极显著增加(P<0.01)。高剂量利巴韦林破坏了小肠黏膜上皮形态结构,抑制了小肠绒毛发育;而低剂量利巴韦林能够提高小肠绒毛长度、隐窝深度、十二指肠绒毛长度和隐窝深度比值,增强小肠功能的发挥。结论:利巴韦林具有促进机体生长发育和调节免疫功能的作用,但随着添加剂量的增加,利巴韦林的促生长和免疫增强效果减弱。在临床应用上,应注意根据不同的个体来确定利巴韦林的适宜添加剂量和合理应用时间。
关键词:利巴韦林;生长发育;血液生理指标 ;组织形态
利巴韦林为鸟苷类化合物,对RNA病毒和DNA病毒具有广谱抗病毒活性,临床上常用于治疗甲乙型流感病毒、丙型肝炎、轮状病毒、乙脑病毒、疱疹病毒、流行性出血热等[1-3]。在畜禽生产中利巴韦林曾被用于治疗猪流行性感冒、猪传染性胃肠炎、鸡痘等病毒性传染病[4]。近年来,随着畜禽养殖规模扩大,多种因素造成的病毒性传染病发病率增加,致使利巴韦林、金刚烷胺等违禁的抗病毒药物在畜禽生产中仍有违规使用[5]。此外,调查显示利巴韦林在婴幼儿病毒性疾病的治疗中应用较多[6],但利巴韦林的不合理应用造成人类和畜禽中毒事件仍时有发生[7]。因此,利巴韦林的合理应用是有效发挥其抗病毒功效的重要前提。
大量研究表明利巴韦林长期或过量使用可引起血液中白细胞减少和贫血等不良反应[8],但利巴韦林对机体生长发育和小肠组织形态影响的报道较少。因此,本研究拟通过研究利巴韦林对小鼠日增重、器官指数、血液生理指标以及小肠组织形态结构的影响,系统地分析口服不同剂量的利巴韦林对机体健康状况的影响,为利巴韦林在临床上的合理应用提供科研理论依据。
1材料与方法
1.1试验材料
30只1月龄清洁级小鼠,购自南京市江宁区青龙山动物繁殖场,饲养于动物科学学院动物房;利巴韦林粉(购自济南新瑞宏经贸有限公司),瑞氏染色液(购自北京雷根生物技术有限公司),肝素钠、枸橼酸钠、甲基红、结晶紫、多聚甲醛等生化试剂(均购自安徽博美特生物科技有限公司);切片机(德国Leica RM2235),显微成像系统(OLYMPUS-CH30),电子天平(YP-600),电子分析天平(FA-1004N),恒温箱(GHP-9050),烘干箱(CX-GF-b),微量移液器(Eppendorf)等。
1.2试验设计
1.2.1动物饲养小鼠适应性饲养7d后,根据性别和体重随机分为三组,每组10只。空白对照组按照0.5mL/只灌服生理盐水,高剂量、低剂量利巴韦林组的用药剂量分别为5mg/kg、10mg/kg体重。连续灌胃14d,于用药后第7d、14d清晨进行空腹称重。
1.2.2样品的采集及处理小鼠称重后,用乙醚麻醉处死,采集血液样品,解剖分离组织器官并称重,取约1.5cm的十二指肠、空肠,快速放入4%多聚甲醛中,固定24h后修块,用于制作石蜡切片。
1.3测定项目及分析方法
1.3.1血液生理指标检测采用血细胞计数板法测定肝素钠抗凝的血液中红细胞总数和白细胞总数,白细胞分类计数参照已有文献进行[9]。每个样品制作5张血涂片,每张血涂片统计100个白细胞中各类白细胞的数量。
1.3.2苏木精-伊红(H.E)染色组织固定24h后,梯度酒精脱水,二甲苯透明,浸蜡,包埋,修块,制作厚度为6μm的石蜡组织切片;37℃烤片24h后,二甲苯脱蜡,梯度酒精脱二甲苯至水,经苏木精和伊红染色,梯度酒精脱水,二甲苯透明,封片。采用Olympus生物显微镜观察小肠组织形态结构并拍照,每个组织样品制作五张不连续切片,每张切片选取5个视野,每个视野选两根绒毛和隐窝进行测量。
1.3.3数据处理与分析数据均以平均数±SD表示,采用SPSS16.0软件进行组间差异显著性比较分析,P<0.01表示差异极显著,P<0.05表示差异显著。
2结果与分析
2.1利巴韦林对小鼠日增重的影响
给药7d后,与空白对照组相比,低剂量利巴韦林组小鼠的日增重极显著增加(P<0.01),而高剂量组小鼠日增重显著增加(P<0.05),两个用药组之间无明显差异;给药14d后,各组间差异不显著(表1)。

表1 小鼠的日增重变化 ±SD)
注:同列不同大、小写字母分别表示在0.01和0.05水平上差异显著,下同。
Note:The different capital and small letters in a column mean significant difference at levels of 0.01 and 0.05, respectively. The same as follow.
2.2利巴韦林对小鼠器官指数的影响
由表2可见,高剂量利巴韦林组小鼠脾脏、小肠和胸腺指数最低,且脾脏指数显著低于低剂量组(P<0.05)。肝脏、肾脏指数在各组间无明显差异。

表2 给药14d后小鼠的器官指数变化±SD)
2.3利巴韦林对血液生理指标的影响
与对照组相比,高、低剂量利巴韦林组红细胞总数降低,白细胞总数升高,其中低剂量组白细胞总数极显著增加(P<0.01),高、低剂量组嗜中性粒细胞数量极显著降低(P<0.01),淋巴细胞数量极显著升高(P<0.01)。嗜碱性粒细胞、嗜酸性粒细胞和单核细胞数量在各组间的比较差异均未达到统计学意义(见表3)。

表3 给药14d后小鼠血液部分生理指标的变化±SD)
注:同行不同大、小写字母分别表示在0.01和0.05水平上差异显著,下同。
Note:The different capital and small letters in a same line mean significant difference at levels of 0.01 and 0.05, respectively.
2.4利巴韦林对小肠组织形态结构的影响
H.E染色结果如图1所示,低剂量利巴韦林组小肠绒毛黏膜上皮组织形态正常,而高剂量组小肠绒毛顶部出现部分粘膜上皮脱落的现象(如图1 E 中箭头所示),且肠上皮细胞之间排列不紧密,造成小肠黏膜组织结构的不完整。
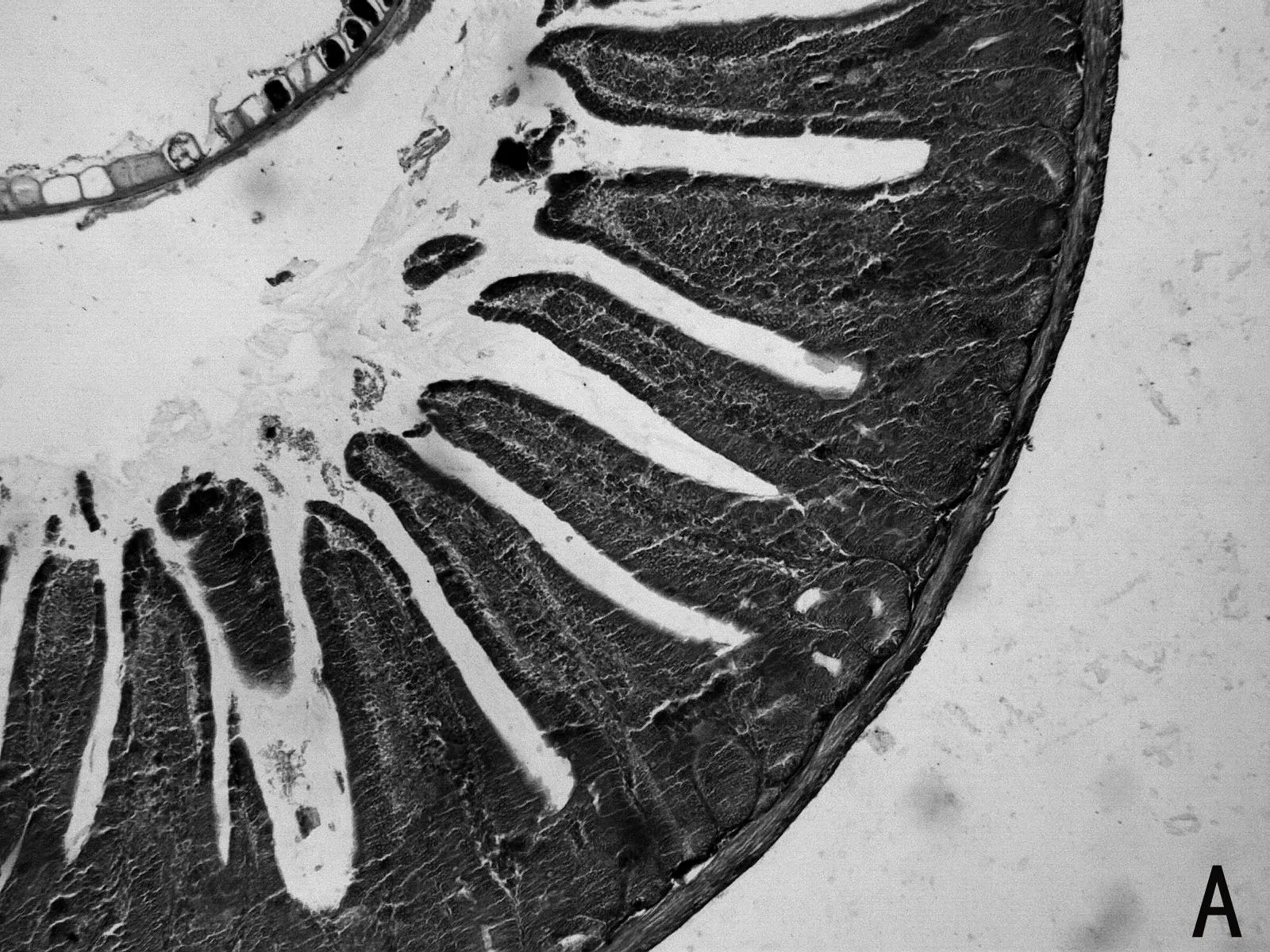
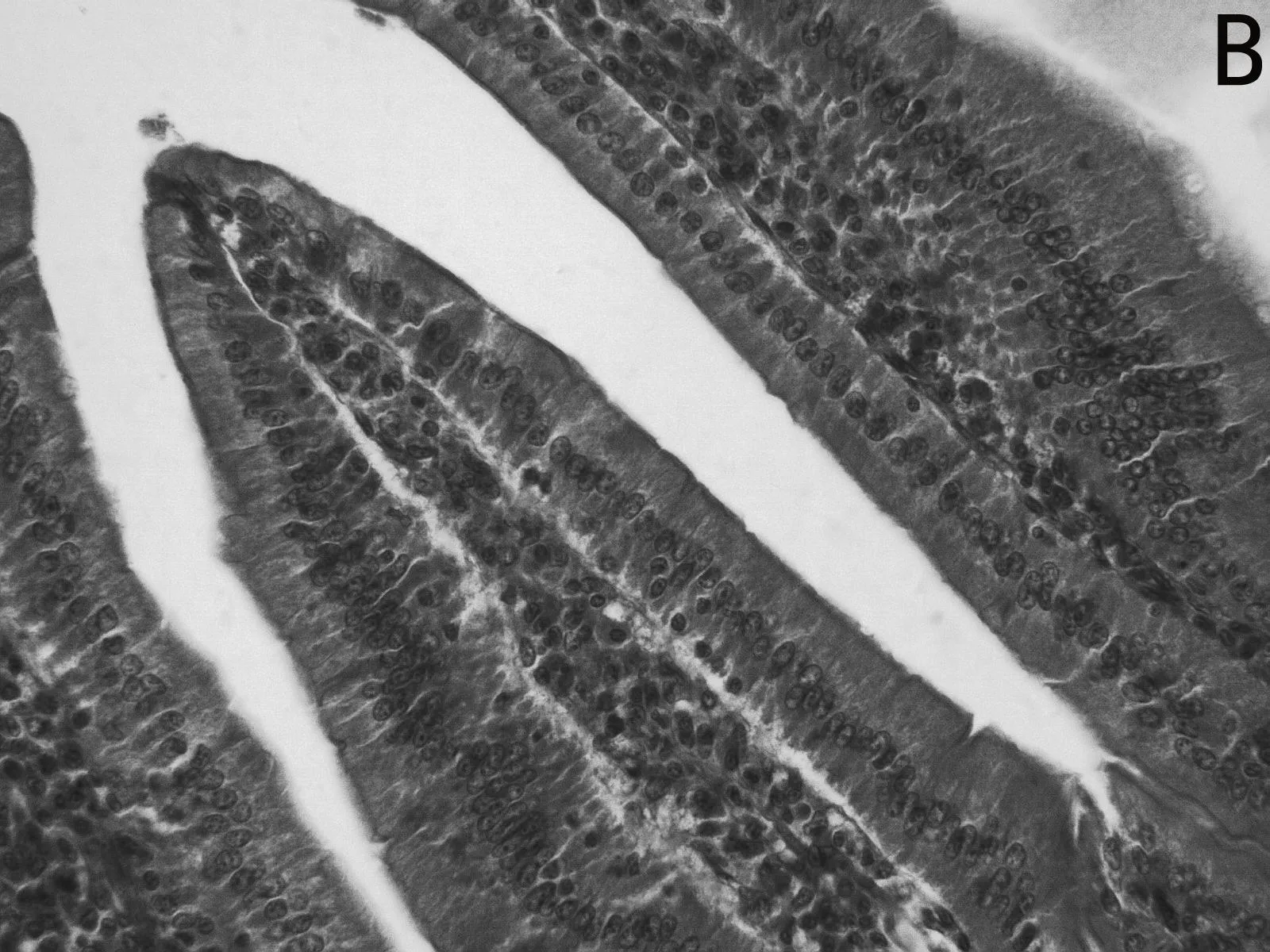

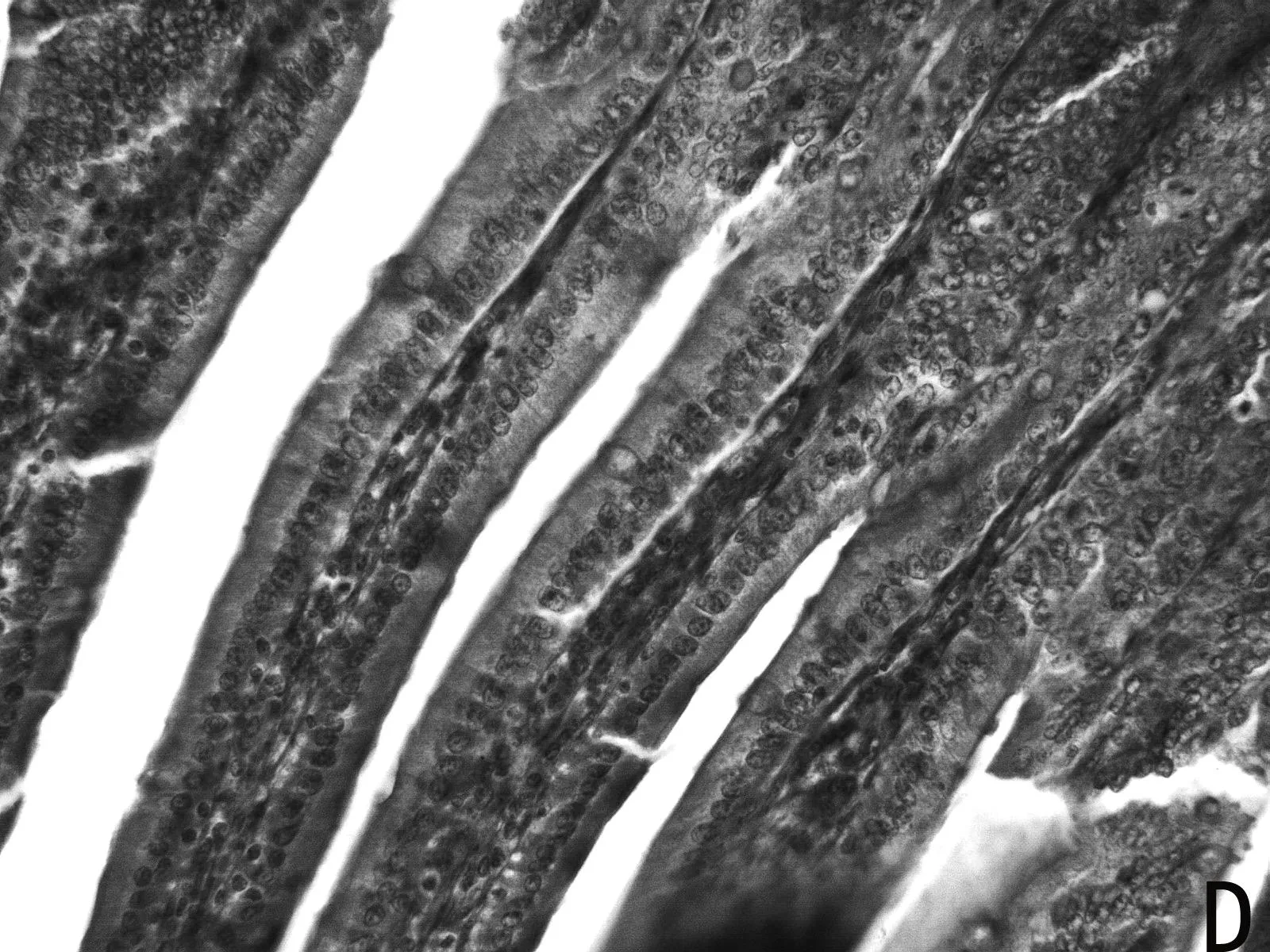
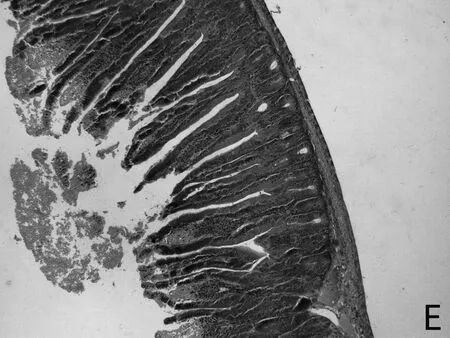
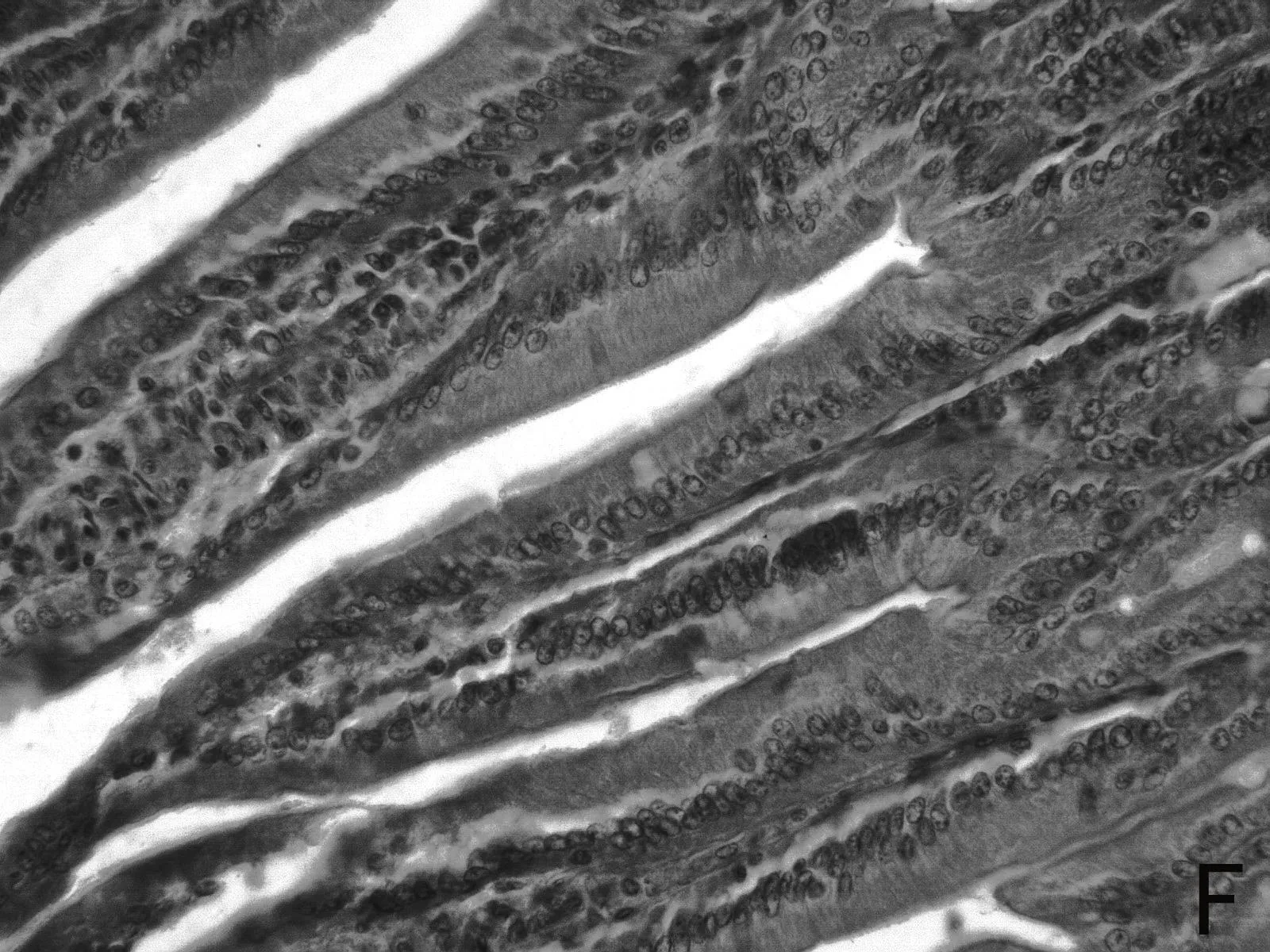
图1 小肠组织形态结构
由表4可见,低剂量组小肠绒毛长度、隐窝深度、以及十二指肠的绒毛长度和隐窝深度比值均高于其他两组。高剂量组小肠绒毛长度、绒毛长度与隐窝深度比值均最低。

表4 利巴韦林对小鼠小肠绒毛长度和隐窝深度的影响
3讨论
3.1利巴韦林对小鼠生长发育的影响
利巴韦林作为常用的抗病毒药物在临床上被广泛使用。本研究发现利巴韦林用药7d后能够显著促进小鼠生长发育,且低剂量的利巴韦林在用药一周内促生长效果最好。用药14d后,高、低两种剂量的利巴韦林的促生长效果不明显,这可能是由于长时间使用利巴韦林延迟了红细胞生长而导致贫血[10],因此临床上建议给予小剂量治疗,且用药时间为1周为宜。
3.2利巴韦林对小鼠免疫器官指数的影响
器官指数是衡量器官生物学功能的重要特征指标之一。总体来看,用药14d后,高剂量的利巴韦林对小鼠免疫器官和小肠器官指数的影响表现为降低作用,其中对脾脏的影响达到显著差异水平,这可能是由于利巴韦林用药剂量较高时会抑制机体免疫功能的正常发挥,且破坏小肠形态结构,这与以往报道的高浓度利巴韦林对淋巴细胞有抗增殖作用相一致[11]。低剂量利巴韦林能够显著提高脾脏指数,这表明低浓度的利巴韦林可能主要通过刺激脾脏淋巴细胞增殖来增强机体的抗病毒作用。
3.3利巴韦林对小鼠血液生理指标的影响
红细胞具有运输氧和二氧化碳,对酸、碱物质起到缓冲作用[12],调控体液免疫和细胞免疫功能[13]。研究发现红细胞数随着利巴韦林注射浓度增高而降低[14],这在本研究中也被证实,即利巴韦林组红细胞数量均有一定程度降低,其原因可能是由于利巴韦林过早清除红细胞膜蛋白,使红细胞膜对氧化作用的易感性增强有关[15-16],另一方面可能由于红细胞表面存在利巴韦林发挥抗病毒作用的核苷载体,造成利巴韦林在红细胞内蓄积,破坏红细胞[17]。
白细胞具有渗出、趋化和吞噬等特性,可保护机体不受外来微生物侵袭,其中淋巴细胞是机体免疫应答功能的重要细胞成分,中性粒细胞在血液的非特异性细胞免疫系统中发挥重要作用。本研究表明按照5mg/kg、10mg/kg体重给小鼠灌胃利巴韦林,均能够增加白细胞总数和淋巴细胞数量,降低嗜中性粒细胞数量,表明利巴韦林可能主要通过促进淋巴细胞增殖来调节机体的免疫功能,但抑制非特异性细胞免疫功能的发挥。大量研究证实利巴韦林长期或过量使用可引起白细胞减少和贫血等不良反应[8,14,18],这与本试验结果不完全一致,其原因可能是由于利巴韦林的用药剂量、用药途径以及受试动物所处的生理状态不同而引起。于宏等研究证实随着利巴韦林用药浓度的增加,白细胞总数和淋巴细胞数量逐渐下降[18],这与本试验结果相符,即添加低浓度的利巴韦林对免疫细胞的增强效果显著。
3.4利巴韦林对小鼠小肠组织形态的影响
小肠组织结构的完整性和功能的正常发挥对营养物质的消化、吸收起到重要作用。绒毛长度和黏膜厚度是小肠消化吸收功能的重要决定因子。本研究发现,低剂量(5mg/kg)利巴韦林对小肠上皮形态结构无明显损伤作用,而高剂量(10mg/kg)利巴韦林使小肠绒毛顶端上皮出现脱落,破坏了黏膜上皮形态结构的完整性,这一结果在不同剂量的利巴韦林对仔猪胃肠道形态结构影响的报道中也得到证实[18]。
隐窝深度能够反映小肠上皮细胞的生成率。绒毛长度和隐窝深度的比值是小肠功能状态的综合反映。低剂量利巴韦林能够提高小肠绒毛长度、隐窝深度,以及十二指肠绒毛长度和隐窝深度的比值,而高剂量利巴韦林则对小肠绒毛的发育起到一定抑制作用。低剂量利巴韦林可能通过促进小肠组织的生长发育,增强小肠对营养物质的消化吸收功能,进而促进机体的生长发育。
4结论
利巴韦林具有促进机体生长发育和调节免疫功能的作用,但其作用效果与添加剂量呈现一定的依赖关系。低浓度利巴韦林的促生长和免疫增强效果较好,对小肠组织形态没有破坏作用,而且能够增加小肠绒毛长度和隐窝深度比值,促进小肠对营养物质的消化吸收功能。在临床应用上,应注意根据不同的个体来确定利巴韦林的适宜添加剂量和合理应用时间。
参考文献:
[1]陈秀秀,周红霞,亓文宝,等.甘草酸联合利巴韦林体内抗甲型H1N1流感病毒作用[J].药学学报,2015,50(8):966-972.
[2]曾艳丽,何佳,宁会彬,等.白细胞介素-28B rs12978960多态性与1b 型慢性丙型肝炎复发者聚乙二醇干扰素联合利巴韦林再治疗疗效的相关性研究[J].中华传染病杂志,2015(7):415-419.
[3]牛辛元.利巴韦林治疗婴幼儿轮状病毒肠炎的疗效与安全性[J].中国医院用药评价与分析,2015(5):670-670, 671.
[4]杜志明,李志刚,吕洪,等.抗病毒药物在兽医临床上的应用[J].动物保健,2005(8):35-36.
[5]云环,崔凤云,严华,等.超高效液相色谱-串联质谱法测定鸡肉中的利巴韦林和金刚烷胺[J].色谱,2013,31(8):724-728.
[6]黄荆南.利巴韦林在儿童患者中的使用情况分析[J].河南医学研究,2015(9):78-79.
[7]田彩锁,孙倩,杨莲英,等.利巴韦林临床应用中的不良反应[J].中国综合临床,2002,18(6):487-488.
[8]ISHIHARA T, KANEKO K, ISHIHARA T, et al. Development of biodegradable nanoparticles for liver-specific ribavirin delivery[J]. Journal of Pharmaceutical Sciences, 2014, 103(12): 4005-4011.
[9]王趁芳,高志华,乔恩美,等.低聚壳聚糖对肉鸡血细胞的影响[J].安徽科技学院学报,2013,27(4):10-15.
[10]DALLA-COSTA L M, COELHO J M, SOUZA H A, et al. Outbreak of carbapenem-resistant Acinetobacter baumannii producing the OXA-23 enzyme in Curitiba, Brazil[J]. Journal of Clinical Microbiology, 2003, 41(7): 3403-3406.
[11]程勇前,赵平,王晓峰,等.利巴韦林抗HCV作用机制研究进展[J].国外医学:流行病学传染病学分册,2003,30(3):156-160.
[12]王俊东,刘宗平.兽医临床诊断学[M].北京:中国农业出版社,2004.
[13]余飞,袁聪俐,杨志彪,等.红细胞免疫研究进展[J].动物医学进展,2007,28(6):82-85.
[14]吴茅,王建富,周建飞,等.不同浓度利巴韦林对家兔外周血细胞的影响[J].浙江医学,2008,30(5):456-458, 462.
[15]DE FRANCESCHI L, FATTOVICH G, TURRINI F, et al. Hemolytic anemia induced by ribavirin therapy in patients with chronic hepatitis C virus infection: role of membrane oxidative damage[J]. Hepatology (Baltimore, Md.), 2000, 31(4): 997-1004.
[16]VAN VLIERBERGH H, DELANGHE J R, DE VOS M, et al. Factors influencing ribavirin-induced hemolysis[J]. Journal of Hepatology, 2001, 34(6): 911-916.
[17]KHAKOO S, GLUE P, GRELLIER L, et al. Ribavirin and interferon alfa-2b in chronic hepatitis C: assessment of possible pharmacokinetic and pharmacodynamic interactions[J]. British Journal of Clinical Pharmacology, 1998, 46(6): 563-570.
[18]于宏,孙洪磊,杨凤,等.仔猪口服利巴韦林毒性实验研究[J].中国农业科学,2010,43(13):2806-2812.
(责任编辑:马世堂)
Effects of Ribavirin on Growing Development and Small Intestine Morphology and Structure in Mice
FAN Rong-li, JIANG Tao, AI Feng, FANG Xu, WANG Jun-cheng, GONG Zheng-qing, CHE Chuan-yan*
(College of Animal Science,Anhui Science and Technology University,Fengyang 233100,China)
Abstract:Objective: To investigate the effect of different doses of ribavirin on growth and development and the small intestinal morphology in mice. Methods: Thirty mice at one month old were randomly divided into three groups, mice in control group were taken normal saline by intragastric administration, mice in low-dose and high-dose ribavirin group were either taken ribavirin according to 5mg/kg、10mg/kg body weight. Ribavirin was administered once daily for 14 consecutive days. We weighed mice every week morning, collected blood and tissue samples. Results: Ribavirin can improve the daily weight gain in mice, and low-dose ribavirin showed significant effect on growth at 7 old day (P<0.05). After having taken medicine for 14 days, spleen index in low -dose ribavirin group was significantly higher than that in high-dose group (P<0.05). In compared with control group, the total number of red blood cell was decreased, white blood cell number was increased, heterophil granulocyte number was reduced significantly (P<0.01), lymphocyte was highly significant increased (P<0.01) in high-dose and low-dose ribavirin group; the total number of white blood cell in low-dose group was very significantly increase(P<0.01). High-dose ribavirin damaged the integrity of morphology and structure in small intestinal mucosa epithelium, inhibited the development of small intestinal villi. Low-dose ribavirin could enhance the villus length, crypt depth, and villus length to crypt depth ratio, so that to deliver the function of small intestine. Conclusions: Ribavirin showed effects of improving growth and development, enhancing immune function. However, the effects of ribavirin on improving growth performance and immunoenhancement were attenuated along with dose increase. At clinical applications, we should take notice of confirming appropriate dosage and reasonable application time in the light of different individual.
Key words:Ribavirin; Growth and development; Blood physiological index; Histomorphology
中图分类号:S852.16
文献标识码:A
文章编号:1673-8772(2016)01-0019-06
作者简介:范荣莉(1992-),女,安徽省淮北市人,在读本科生,主要从事肠道微生态营养与黏膜免疫研究。*通讯作者:车传燕,讲师,E-mail:ccyan1980@163.com。
基金项目:安徽省级大学生创新创业训练计划项目(AH201410879031);国家级大学生创新创业训练计划项目(201310879011)。
收稿日期:2015-11-06

