B7-H1在卵巢癌组织中表达的临床意义
徐 梅 张 梦 刘 洋 张 蓓 尹凤玲 刘 霞 卓世超
221009 江苏省徐州市中心医院
B7-H1在卵巢癌组织中表达的临床意义
徐梅张梦刘洋张蓓尹凤玲刘霞卓世超
221009 江苏省徐州市中心医院
【摘要】目的探讨B7-H1在卵巢癌组织中表达的临床意义。方法将收治的112例上皮性卵巢癌及10例良性卵巢囊肿的组织蜡块制作成组织芯片,免疫组化检测芯片协同刺激分子B7-H1的表达情况,χ2检验B7-H1表达水平与患者临床病理参数的关系。生存分析采用Kaplan-Meier法和Log-rank检验及多因素 COX回归。结果B7-H1在良性卵巢囊肿中均为低表达,在卵巢癌组织中高表达率为55.4%(62/112);其表达水平与患者年龄、组织类型、细胞分化、肿瘤大小及是否合并CA125升高无关(P>0.05),而与患者FIGO分期及是否转移密切相关(P<0.05);B7-H1高表达组与低表达组患者无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)比较差异均有统计学意义(χ2值分别为24.9和17.51,P值均<0.001)。COX回归分析表明,B7-H1表达水平和FIGO分期是影响患者生存的独立预后因素。结论卵巢癌组织中B7-H1的表达水平与预后差和生存期短相关,可为卵巢癌的免疫靶向治疗提供思路。
【关键词】卵巢癌;协同刺激分子;B7-H1
(ThePracticalJournalofCancer,2016,31:380~383)
随着肿瘤免疫学及现代生物科技的发展,肿瘤免疫治疗已经取得突破性的进展。B7家族是T细胞活化的重要协同刺激分子,B7-H1也称PD-L1(programmed death-1-ligand 1),是该家族的第三个成员,该分子在诱导肿瘤特异性T细胞凋亡和肿瘤免疫逃逸过程中具有重要作用[1]。而B7-H1在卵巢癌中的作用目前研究尚少,值得探讨。我们收集与卵巢癌相关的临床资料,拟合多因素COX模型分析B7-H1分子表达对卵巢癌患者复发或死亡风险的影响,从而探讨B7-H1在卵巢癌组织中表达的临床意义,为卵巢癌的免疫靶向治疗提供思路。
1材料与方法
1.1试剂
B7-H1鼠抗人多抗克隆抗体,USCNLIFE,USA,鼠/兔通用型二抗,购自福州迈新生物技术有限公司。
1.2病例资料
112例石蜡包埋组织标本取自2005年2月至2009年12月间在我院住院手术治疗的卵巢癌患者。年龄21~78岁,平均(55.1±12.5)岁;其中浆液性囊腺癌93例、粘液性囊腺癌12例、子宫内膜样腺癌3例、透明细胞癌4例;肿瘤大小1~4 000 cm3,平均(171.9±423.2)cm3;FIGO分期Ⅰ期26例、Ⅱ期7例、Ⅲ期72例、Ⅳ期7例;细胞分化Ⅰ级9例、Ⅱ级20例、Ⅲ级78例、交界性肿瘤5例;肿瘤位于双侧者65例,右侧24例、左侧23例;82例患者血CA125水平升高;肿瘤转移85例。所有患者术前未接受化疗或放疗。手术标本取材时,癌组织均取自肿瘤原发灶。另取同期10例因良性卵巢囊肿手术切除的标本做正常对照。
所有患者均同时满足下列条件:术后生存期≥3个月,死亡原因是卵巢癌而非其他疾病。通过查阅住院病例、电话或登门随访等方式对所有患者追踪随访至2014年12月。
1.3免疫组织化学染色
由上海芯超公司将采集的所有蜡块制作成组织芯片,然后进行Elivision TM 免疫组织化学染色。石蜡切片经脱蜡和水化后,将切片浸在柠檬酸盐缓冲液中水浴加热至100 ℃,持续30 min,进行抗原修复。然后将切片冷却浸在3%H2O2中30 min。然后用PBS浸洗3次。再加一抗B7-H1鼠抗人多抗克隆抗体,1∶400稀释,4 ℃过夜,用PBS代替一抗作为阴性对照。将切片在PBS中浸洗3次,然后加二抗,室温放置30 min,用PBS洗去二抗,经DAB显色,苏木精复染,0.1%盐酸酒精分化。切片经梯度酒精脱水干燥后用中性树脂封片。
1.4免疫组化结果判读
应用Immunohistochemical Scores(IHS)法对免疫组织化学染色切片进行评估。在200倍高倍镜下,随机选择5个肿瘤区域,计数胞质/胞膜内有阳性染色的肿瘤细胞个数,根据其所占比例计分。无阳性细胞为0分,阳性细胞占1%~10%为1分,11%~50%为2分,51%~80%为分,81%~100%为4分;同时评估阳性细胞染色的强弱:阴性计0分,弱阳性计1分,中度阳性计2分,强阳性计3分。两项得分的乘积即为该例病变的免疫组化评分:0为-,1~4分为+,5~8分为++,9~12分为+++。评分<4分为低表达,≥4分为高表达。
1.5统计学方法
计量资料以均数±标准差表示,所有数据均应用SPSS 17.0统计软件包进行统计学处理,B7-H1高表达组及低表达组间比较采用χ2检验,生存分析采用Log-rank时序检验及Kaplan-Meier生存曲线法,对B7-H1表达、细胞分化程度、转移与否及FIGO分期及年龄多因素分析采用COX模型分析。
2结果
免疫组织化学染色结果:B7-H1分子在10例正常卵巢囊肿中均呈低表达,在112例卵巢癌组织中高表达率为55.4%(62/112)。 且表达于肿瘤细胞的胞膜和(或)细胞质中,呈棕黄色至棕褐色颗粒或团块。
B7-H1表达与患者年龄、组织学类型、组织分化程度、FIGO临床分期、肿瘤大小、CA125水平及转移与否的关系见表1。

表1 卵巢癌组织中B7-H1表达与其临床病理参数的关系/例
Kaplan-Meier 法检测B7-H1表达水平不同患者的PFS及OS曲线见图1和图2。患者PFS的计算起点为手术当日,终点为患者确诊为肿瘤复发或病情恶化时。OS的计算起点为手术当日,终点为患者死亡日期或截止日期。随访截止日期为2014年12月31日。112例卵巢癌患者随访5年中,B7-H1低表达者复发率为46.0%(23/50)、死亡率为34.0%(17/50);而高表达者复发率为82.3%(51/62)、死亡率为66.1%(41/62);B7-H1高表达组与低表达组患者PFS[(1059.1±151.8)天 vs(2358.8±180.2)天]和OS[(1675.8±169.2)天vs(2654.1±149.4)天]比较,差异均有统计学意义(χ2值分别为24.9和17.51,P值均<0.001)。
COX回归多因素分析结果: B7-H1表达情况(B=0.98,RR=2.66,P=0.002)和FIGO分期(B=0.78,RR=2.17,P=0.03)是影响患者生存的独立预后因素。
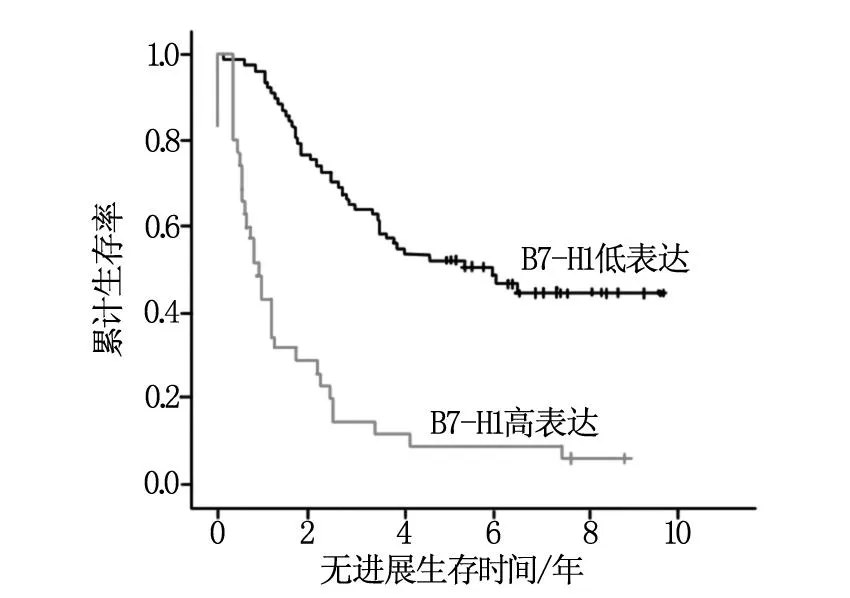
图1 B7-H1不同表达水平患者的PFS曲线图

图2 B7-H1不同表达水平患者的OS曲线图
3讨论
B7-H1也称pD-L1(programmed death ligand-1),是1999年发现的B7家族成员,B7-H1基因定位于人9p24.2[2],编码产物为一个含290个氨基酸的I型跨膜糖蛋白,B7-H1的受体为PD-1(CD279),PD-1最初是通过削减杂交技术,从小鼠凋亡期的杂交瘤及造血祖细胞系克隆得到的。由于其和细胞凋亡相关故被命名为程序性死亡-1(programmed death-1,PD-1)。人类PD-1基因编码含288个氨基酸的I型跨膜糖蛋白,其细胞外区为免疫球蛋白样IgV区,细胞质区含有2个酪氨酸基序,N端有1个免疫受体酪氨酸依赖抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM),C端有1个免疫受体酪氨酸转换基序(immunoreceptor tyrosine switch motif,ITSM),这两个酪氨酸残基磷酸化后可分别与酪氨酸磷酸酶 SHP-1 和 SHP-2结合,下调 TCR 和 BCR 下游激活信号的磷酸化,转导抑制性信号,发挥抑制免疫应答的作用[2-4]。这种表达特点可能与保护组织免受不必要的炎性反应或免疫反应有关。近些年的研究发现,在许多人类肿瘤组织(如胃癌[5-6]、食管癌[7]、胰腺癌[8]、肺癌[9]、卵巢癌[10]、膀胱癌[11]、肾细胞癌[12]、淋巴瘤[13]、乳腺癌[14]和白血病[15]等)中均可检测到 B7-H1 蛋白的异常表达。
B7-H1在肿瘤组织中的表达水平和患者的临床病理因素及预后存在显著相关性。Ohigashi等[7]对食管癌患者肿瘤细胞B7-H1的表达水平与愈后相关性进行了分析,发现术前癌细胞B7-H1阳性患者明显比B7-H1阴性患者愈后差,1年生存率明显降低,且癌细胞的复发转移发生率高。Wu等[5]对102例胃癌组织中B7-H1的表达情况和临床病理学及预后相关性分析发现,B7-H1在正常胃组织中没有表达,在胃腺瘤中微弱表达,但在42.2%胃癌组织中强表达。而且,其表达程度和肿瘤大小、浸润深度、淋巴结转移及患者的生存期相关。多因素分析显示,B7-H1表达情况是评价胃癌患者预后的独立因素。本研究检测B7-H1在112例卵巢癌组织中的表达情况,并对患者进行5到10年的随访,结果显示B7-H1阳性染色定位于肿瘤细胞的胞浆或(和)胞膜,在10例良性卵巢囊肿中B7-H1均为低表达,在卵巢癌中的B7-H1高表达率为55.4%,略高于于晓伟等[16]的研究结果。同时研究还发现,B7-H1的表达水平和细胞分化、肿瘤大小、是否合并CA125升高及患者年龄无明显相关性,而和患者FIGO分期及是否转移密切相关。患者临床分期越晚或是并发转移者,其B7-H1表达水平越高。这和Wang等[11]采用mate分析研究B7-H1在膀胱癌中表达水平得出的结论类似。Hamanishi等[10]发现在卵巢癌组织中B7-H1的表达水平和肿瘤组织中CD8+T的数量负相关,且多因素分析显示,它们是患者的独立预后因素。我们的研究显示,B7-H1低表达者比高表达者有更长的PFS和OS,高表达相对低表达有更高的复发率(82% vs 46%)和死亡率(66.1% vs 34%)。说明卵巢癌细胞表达B7-H1与预后差和生存短有关。而COX回归分析亦显示,B7-H1表达水平和FIGO分期是EOC患者的独立预后因素。
Sun等[6]成功构建两种鼠抗人PD-L1单克隆抗体10E10 和2H11,它们可以抑制肿瘤相关PD-L1诱导的T细胞凋亡,通过共刺激分子调控网络和免疫干预途径进行肿瘤免疫治疗具有重要价值。DC表达B7-H1本身即可限制DC处于未成熟状态,与肿瘤细胞免疫逃逸及肿瘤进展相关[9],通过沉默DC细胞B7-H1的表达,进而增强体内抗肿瘤免疫的实验研究也获得了肯定的结果[17],这充分说明B7-H1可作为激活机体抗肿瘤免疫治疗的很好靶点。目前,该疗法已被应用于非小细胞肺癌的临床试验治疗并取得一定的成效[18]。因此,通过分子生物学手段检测和控制卵巢癌细胞表面B7-H1分子的表达,对于卵巢癌的治疗和预防具有重要意义。
参考文献
[1]Topalian SL,Drake CG,Pardoll DM.Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity〔J〕.Curr Opin Immunol,2012,24(2):207-212.
[2]Dong H,Zhu G,Tamada K,et al.B7-H1,a third member of the B7 family,co-stimulates T-cell proliferation and interleukin-10 secretion〔J〕.Nat Med,1999,5(12):1365-1369.
[3]Okazaki T,Maeda A,Nishimura H,et al.PD-1 immunoreceptor inhibits B cell receptor-mediated signaling by recruiting src homology 2-domain-containing tyrosine phosphatase 2 to phosphotyrosine〔J〕.Proc Natl Acad Sci USA,2001,98(24):13866-13871.
[4]Dong H,Chen X.Immunoregulatory role of B7-H1 in chronicity of inflammatory responses〔J〕.Cell Mol Immunol,2006,3(3):179-187.
[5]Wu C,Zhu Y,Jiang J,et al.Immunohistochemical localization of programmed death-1 ligand-1(PD-L1) in gastric carcinoma and its clinical significance〔J〕.Acta Histochem,2006,108(1):19-24.
[6]Sun J,Xu K,Wu C,et al.PD-L1 expression analysis in gastric carcinoma tissue and blocking of tumor-associated PD-L1 signaling by two functional monoclonal antibodies〔J〕.Tissue Antigens,2007,69(1):19-27.
[7]Ohigashi Y,Sho M,Yamada Y,et al.Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer〔J〕.Clin Cancer Res,2005,11(8):2947-2953.
[8]Song X,Liu J,Lu Y,et al.Overexpression of B7-H1 correlates with malignant cell proliferation in pancreatic cancer〔J〕.Oncol Rep,2014,31(3):1191-1198.
[9]Mu CY,Huang JA,Chen Y,et al.High expression of PD-L1 in lung cancer may contribute to poor prognosis and tumor cells immune escape through suppressing tumor infiltrating dendritic cells maturation〔J〕.Med Oncol,2011,28(3):682-688.
[10]Hamanishi J,Mandai M,Iwasaki M,et al.Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer〔J〕.Proc Natl Acad Sci U S A,2007,104(9):3360-3365.
[11]Wang YU,Liu AN,Zhao SH.Association between B7-H1 expression and bladder cancer: a meta-analysis〔J〕.Genet Mol Res,2015,14(1):1277-1286.
[12]Thompson RH,Kuntz SM,Leibovich BC,et al.Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up〔J〕.Cancer Res,2006,66(7):3381-3385.
[13]Li Y,Wang J,Li C,et al.Contribution of PD-L1 to oncogenesis of lymphoma and its RNAi-based targeting therapy〔J〕.Leuk Lymphoma,2012,53(10):2015-2023.
[14]Ghebeh H,Mohammed S,Al-Omair A,et al.The B7-H1(P
D-L1) T lymphocyte-inhibitory molecule is expressed in breast cancer patients with infiltrating ductal carcinoma: correlation with important high-risk prognostic factors〔J〕.Neoplasia,2006,8(3):190-198.
[15]Li X,Sun WJ,Xu Y,et al.Expression of b7-h1 gene in leukemia cells and its clinical significance〔J〕.Zhongguo Shi Yan Xue Ye Xue Za Zhi,2012,20(3):541-544.
[16]于晓伟,李春红,张松灵.卵巢癌患者PD-L1的表达研究〔J〕.中国实验诊断学,2010,14(11):1854-1856.
[17]Wang S,Wang Y,Liu J,et al.Silencing B7-H1 enhances the anti-tumor effect of bladder cancer antigen-loaded dendritic cell vaccine in vitro〔J〕.Onco Targets Ther,2014,7:1389-1396.
[18]Gettinger S,Herbst RS.B7-H1/PD-1 blockade therapy in non-small cell lung cancer: current status and future direction〔J〕.Cancer J,2014,20(4):281-289.
(编辑:吴小红)
Expression and Clinical Significance of B7-H1 in Ovarian Cancer
XUMei,ZHANGMeng,LIUYang,etal.
CentralHospitalofXuzhou,Xuzhou,221009
【Abstract】ObjectiveTo investigate the expression and clinical significance of B7-H1 in ovarian cancer.Methods112 biopsies from patients with epithelial ovarian cancer(EOC) and 10 specimens from ovarian benign neoplasm were processed into tissue chips.The expression of B7-H1 were detected by immunohistochemical method and its relationship with patients' clinical parameter were tested by Pearson Chi-Square.Survival curves were constructed using the Kaplan-Meier method and the log-rank test.The independent prognostic factors were evaluated by using the Cox regression model.ResultsThe B7-H1 high expression rates were 0 in benign ovarian neoplasm tissues and 55.4%(62/112) in EOC tissues.The level of B7-H1 expression was positively correlated with clinical stage and distant metastases(P<0.05).No relationship was observed between the expression of B7-H1 and age,primary tumor size,primary tumor classification,histological grade and the level of blood CA125(P>0.05).The progression-free survival(PFS) and the overall survival(OS) were significantly lower in patients with B7-H1 high expression than in those with B7-H1 low expression.Multi-variable analysis revealed that the expression of B7-H1 and the clinical stage could be regarded as the independent factor in evaluating the prognosis of EOC patients.ConclusionThe level of B7-H1 expression in EOC tissues is significantly correlated with the poor prognosis and relapse rate.B7-H1 might be a beneficial target for immunotherapy in EOC patients.
【Key words】Ovarian neoplasrn;Co-stimulator;B7-H1
(收稿日期2015-04-30修回日期 2015-10-28)
中图分类号:R737.31
文献标识码:A
文章编号:1001-5930(2016)03-0380-04
DOI:10.3969/j.issn.1001-5930.2016.03.010
通讯作者:徐梅
基金项目:徐州市医学科研资助项目(编号:XWJ2011038),徐州市中心医院博士创新团队科研资助(编号:XZB201205)

