立体定向放疗治疗老年Ⅰ期肺癌的不良反应和疗效观察
施世明 何 健 黄 艳 胡 永 沈 亚 张建英 曾昭冲
(复旦大学附属中山医院放疗科 上海 200032)
立体定向放疗治疗老年Ⅰ期肺癌的不良反应和疗效观察
施世明何健△黄艳胡永沈亚张建英曾昭冲
(复旦大学附属中山医院放疗科上海200032)
【摘要】目的评估立体定向放射治疗技术 (stereotactic body radiotherapy,SBRT)治疗70岁及以上老年Ι期肺癌患者的不良反应和疗效。方法根据入选标准收集2011年6月至2013年6月期间的30例Ⅰ期肺癌老年患者,所有患者使用螺旋断层放疗系统 (tomotherapy system,TOMO)配合四维计算机断层扫描 (4-dimensional computed tomography,4D-CT)呼吸时相融合控制技术进行SBRT治疗。周围型病灶为50 Gy/5F,中央型病灶为60 Gy/10F。放疗结束后随访观察不良反应和疗效。结果中位随访时间为28.3个月。1年和2年局部控制率 (local control rate,LCR)均为77.9%,1年和2年无进展生存率 (progression-free survival,PFS)分别为66.7%和56.4%,1年和2年总生存率 (overall survival,OS)分别为96.7%和92.1%。2级和3级急性放射性肺炎的发生率分别为6.6%和3.3%。中央型与周围型病灶相比,治疗效果及不良反应差异无统计学意义。结论使用TOMO配合4D-CT呼吸时相融合控制技术对老年Ⅰ期肺癌患者进行SBRT治疗,患者耐受良好,对周围型和中央型肺癌均可取得较好的LCR和OS,是一种安全有效的治疗手段。
【关键词】立体定向放射治疗;肺癌;老年;疗效
*This work was supported by the Medical Guidance Program of the Science and Technology Commission of Shanghai Municipality,China (14411970100).
肺癌是全球最常见且死亡率最高的恶性肿瘤,随着人口老龄化,非小细胞肺癌 (non-small-cell lung cancer,NSCLC)的老年患者与日俱增,65岁以上患者占所有NSCLC患者的一半以上[1]。对于能够耐受手术的Ⅰ期NSCLC患者,肺叶切除是首选的治疗方法,但很多老年患者由于肺功能差、术中风险高和严重的并发症而无法耐受手术,或者不愿意接受手术。对于不能手术的Ⅰ期NSCLC患者,放射治疗是主要治疗手段。
立体定向放射治疗技术(stereotactic body radiotherapy,SBRT)作为一种新的肿瘤治疗技术,因其治疗时间短、疗效好、不良反应少等优点而逐渐被广泛应用于早期NSCLC的治疗,为早期NSCLC的治疗提供了新的选择。然而,国内关于SBRT治疗老年Ⅰ期肺癌的不良反应和疗效还鲜有报道。为进一步探讨SBRT对不能手术的老年Ⅰ期肺癌患者的不良反应和放疗效果,本研究收集并分析了2011年6月至2013年6月期间本科室收治的30例老年Ⅰ期肺癌患者资料,其中中央型19例,周围型11例,应用TOMO配合4D-CT呼吸时相融合控制技术进行SBRT治疗,放疗结束后随访观察不良反应,评估放疗疗效。
资 料 和 方 法
病例选择标准年龄≥70岁;Karnofsky评分≥60;治疗前血常规、生化及心电图均无异常,无放疗禁忌证;CT显示肿瘤直径≤5 cm,氟代脱氧葡萄糖-正电子断层成像 (FDG-PET)排除区域及远处转移,根据国际抗癌联盟 (Union for International Cancer Control,UICC)第7版肺癌TNM分期系统定义为Ⅰ期,即T1N0M0或者T2aN0M0;通过病理或临床诊断为肺癌,无病理患者经放疗科、放射诊断科、胸外科、肺科和病理科等多学科综合治疗协作组 (multidisciplinary team,MDT)会诊,临床诊断为Ⅰ期肺癌,须满足以下条件: (1)新出现或者增大明显的病灶,CT扫描结果符合恶性病灶的影像学特征; (2)FDG-PET扫描结果显示病灶标准摄取值 (standard uptake value ,SUV)增高。患者及家属同意治疗方案,所有患者签署医院伦理机构审查委员会的政策制定的知情同意书。
患者特征2011年6月至2013年6月期间,我科共收治拒绝手术或因基础疾病不能耐受手术的老年Ⅰ期肺癌患者30例,其中中央型19例,周围型11例;男性25例,女性5例;平均年龄76.9岁,中位年龄75.5岁 (70~87岁)。
治疗方法 患者进行体位固定。应用4D-CT呼吸时相融合控制技术进行模拟,扫描范围从下颌骨下缘至肋膈角以下5 cm,层厚为3 mm,扫描间距为3 mm。应用4D-CT追踪肿瘤及其他内脏器官在自由呼吸时的运动。增强CT或正电子发射计算机断层显像 (PET-CT)中的原发肿瘤病灶定义为大体肿瘤区 (gross tumor volume,GTV),临床靶区 (clinical target volume,CTV)等同于GTV,根据4D-CT的扫描结果所显示的GTV在呼吸周期中的运动范围和形变信息,创建内在靶体积 (internal target volume,ITV),ITV外放3 mm为计划靶体积 (planning target volume,PTV)。应用Pinnacle放疗计划系统进行靶区勾画,然后把每个患者的计划CT扫描和轮廓输入到TOMO,制定治疗计划。对于周围型肺癌,每周照射5次,每天1次,每次10 Gy,5次,总剂量50 Gy;对于中央型肺癌,每周照射5次,每天1次,每次6 Gy,10次,总剂量60 Gy。
通过治疗计划系统的剂量体积直方图和等剂量线图对所有计划进行全面评估。所有计划的优化指标如下: (1)危及器官 (organs at risk,OARs)的剂量不应超过正常组织的耐受量; (2)90%等剂量线覆盖PTV的100%; (3)至于目标剂量的不均匀性,处方剂量覆盖PTV的95%~100%; (4)PTV周围的危及器官接受的剂量不应超过其耐受量; (5)总剂量和对侧肺剂量应尽可能小。本研究遵循NCCN的NSCLC临床指南 (2015年)制定的OARs的最大剂量限制: (1)周围型肺癌SBRT治疗双肺平均照射剂量 (mean lung doses,MLD)<6 Gy,V5≤25%,V10≤15%,V20≤8%;食管≤32.5 Gy,平均剂量≤6 Gy;气管和支气管≤32.5 Gy;心脏≤35 Gy,V10≤10%;脊髓平均剂量≤6 Gy;臂丛≤30 Gy; (2)中央型肺癌SBRT治疗双肺MLD<12 Gy,V5≤30%,V10≤20%,V20≤10%;气管和支气管≤32.5 Gy;食管≤32.5 Gy,平均剂量≤9 Gy;心脏≤35 Gy,V30≤25%;脊髓≤13 Gy;臂丛≤30 Gy。
随访及疗效观察放疗期间,所有患者均每天监测急性治疗相关不良反应。放疗结束后的前两年,每3个月随访1次,以后每半年随访1次,随访终点为患者死亡。每次随访时针对不良反应进行临床检查,并进行胸部CT检查,怀疑肿瘤复发时进行PET-CT检查。
根据美国肿瘤放射治疗协作组织 (Radiation Therapy Oncology Group,RTOG) 的急性放射性损伤分级标准和晚期放射损伤分级标准来对放射治疗引起的不良反应进行评价或定级。急性反应的定义为从第1天治疗开始到第90天内出现的放射治疗反应。晚期放射反应指自放射治疗开始之日起3个月后发生的放射反应。
根据实体瘤的疗效评价标准 (response evaluation criteria in solid tumors,RECIST)来评价治疗效果,评价指标包括LCR、PFS和OS。
统计学方法应用SPSS 19.0进行检验。单因素分析中,连续性变量的数据采用独立样本t检验,临床指标采用χ2检验。随访时间为从治疗结束到最后随访时患者生存或死亡的时间,生存率和局部控制率(local control rate,LCR)从治疗开始日起计算。采用 Kaplan-Meirer法计算总体生存率(overall survival,OS)、无进展生存率(progression-free survival,PFS)和LCR。P<0.05为差异有统计学意义。
结果
临床特点30例患者全部完成治疗,中位随访时间为28.3个月。11例周围型和19例中央型Ⅰ期肺癌患者在年龄、性别、卡氏评分、病理类型、TNM分期、肺叶分布、肺疾病史等方面均无显著差异 (表1)。
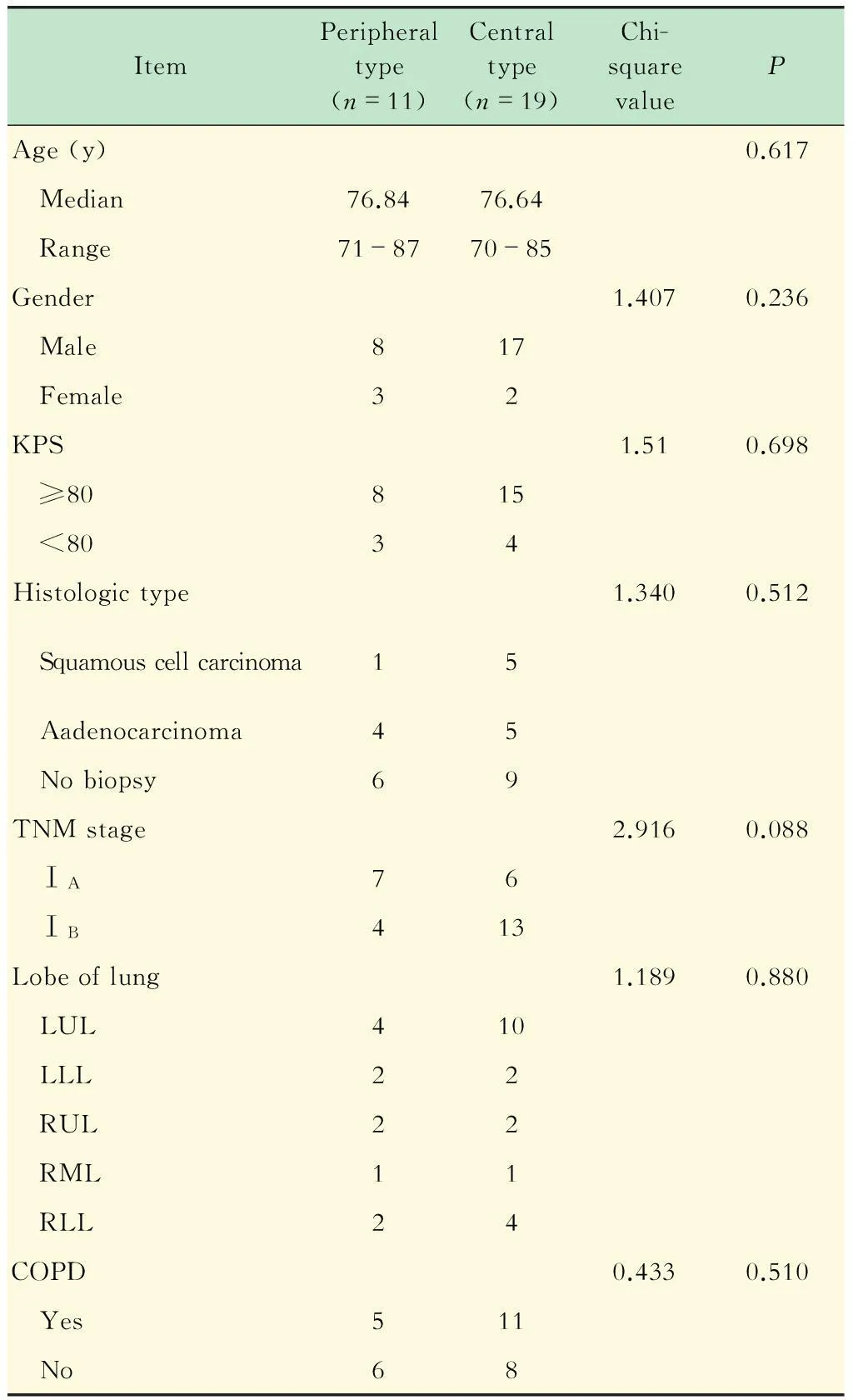
表1 Ⅰ期肺癌患者的病例特征
COPD:Chronic obstructive pulmonary disease; KPS:Karnofsky performance status; LLL:Left lower lobe; LUL:Left upper lobe; RLL:Right lower lobe; RML:Right middle lobe; RUL:Right upper lobe.
治疗效果全部患者的1年和2年OS分别为96.7%和92.1% (图1),2例死亡患者的死因均是肿瘤远处转移。全部患者的1年和2年PFS分别为70.0%和60.0% (图2)。全部患者的1年和2年LCR分别为90%和83.3% (图3)。其中15例有明确病理诊断的患者的1年和2年OS均为100%,1年和2年PFS分别为60.0%和51.4%,1年和2年LCR分别为73.3%和66.7%。
SBRT治疗Ⅰ期周围型和中央型肺癌的疗效比较结果列于表2。周围型和中央型两组的OS、PFS和LCR均无显著差异 (P值分别为0.599、0.870和0.758)。
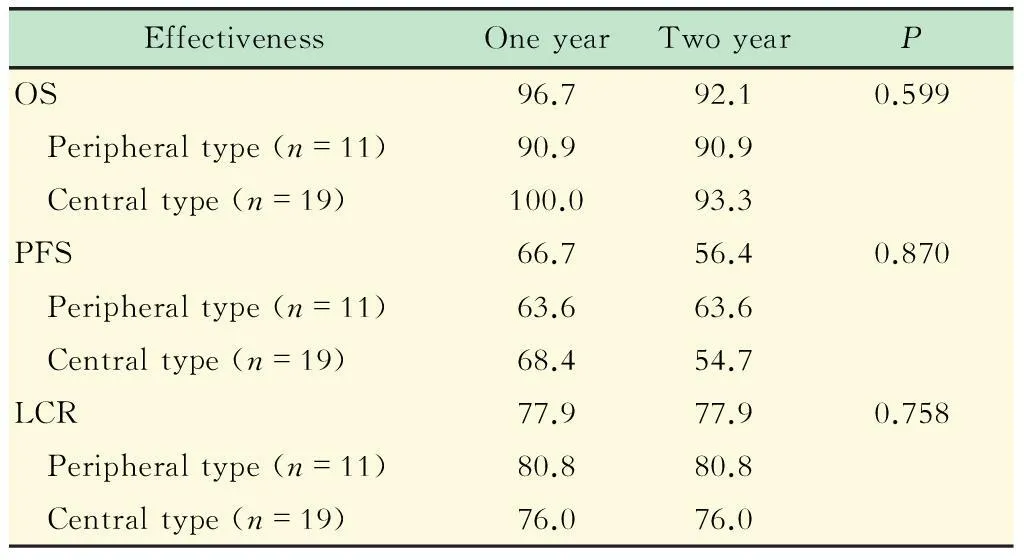
表2 SBRT治疗老年Ⅰ期肺癌患者的疗效
OS:Overall survival; PFS:Progression-free survival; LCR:Local control rate.
不良反应老年Ⅰ期肺癌患者对SBRT治疗耐受良好,在放疗过程中没有患者发生需要药物干预的不良反应。放疗过程中定期复查血常规,未见明显骨髓抑制或血液学不良反应。有1例发生1级急性放射性食管炎,未发现2级或2级以上急性放射性食管炎。3例患者在放疗过程中诉有轻度疲劳,所有患者无胸痛、咯血、肋骨骨折。
有2例发生2级急性放射性肺炎 (radiation pneumonitis,RP),1例发生3级急性RP,未发现3级以上急性RP,上述3例≥2级RP均是中央型肺癌。RP患者与无RP患者的剂量学参数的单因素分析结果提示PTV是发生≥2级RP的危险因素 (P=0.043)。

表3 ≥2级RP危险因素的单因素分析
PTV:Planning target volume; MLD:Mean lung doses; Vx:Volumes of normal lung tissue exposed to ≥xGy,x=5,10 and 20.
讨论
Ⅰ期肺癌是指T1N0M0或者T2aN0M0期的肺癌,若不作任何治疗,其预后很差,中位生存期仅为13个月[2]。手术切除是其首选的治疗方式,手术治疗的LCR大于90%[3],但很多老年患者由于肺功能差、术中风险高和严重的并发症而无法耐受手术,或者不愿意接受手术,放射治疗是他们的主要治疗手段。最近的几项研究表明,对于早期NSCLC,SBRT是一种有效的治疗手段,不良反应小,3年LCR可达82.3%~100%[4-6]。
SBRT利用立体定向装置、CT、核磁共振和X射线减影等先进影像设备及三维重建技术确定病变和邻近重要器官的准确位置和范围,利用三维治疗计划系统确定X (γ)射线的线束方向,精确地计算出靶区与邻近重要器官间的剂量分布计划,使射线对病变实施“手术”式照射。SBRT与常规的外照射相比具有靶区小、单次剂量高、靶区定位和治疗立体定向参数要求精确,靶区与周边正常组织之间剂量变化梯度大,射线从三维空间分布汇聚于靶区等特点。美国MD Andeson医院的Chang等[3]对于早期可以手术的NSCLC进行SBRT与手术切除疗效的比较,初步结果显示,对于可手术的I期NSCLC,SBRT疗效优于手术,毒性作用和不良反应低于手术,SBRT可能是手术外的另一治疗选择,该研究中SBRT组的1、3年生存率分别为100%和95%。Hayashi[5]等在2014年报道了采用SBRT治疗Ⅰ期NSCLC患者81例的临床结果,1、2、3年LCR和OS分别为97.4%、95.9%、91.8%和95.1%、82.9%、69.4%。本研究30例患者1、2年LCR均为77.9%,1和2年OS分别为96.7%和92.1%,2年内的疗效与之前的研究结果类似,2年以上的疗效仍有待进一步的随访及研究。
RP是肺癌放疗最常见的并发症,严重者可直接导致患者死亡。以往报道接受SBRT治疗后,≥2级RP的发生率为9%~28%[7-12]。本研究中,1例患者发生3级RP,住院后给予吸氧及对症治疗后痊愈;2例患者发生2级RP,给予止咳药治疗后痊愈。2级和3级急性RP的发生率分别为6.6%和3.3%,未发现3级以上急性RP。本研究中,单因素分析结果显示PTV是≥2级RP的危险因素,而以往文献报道的RP的危险因素,如V20[13-14]和MLD[8,13-16],在本研究中的RP患者和无RP患者之间差异无统计学意义,其原因可能是病例数不够。
本研究中RP发生率较低,可能得益于在治疗过程中使用了4D-CT。肺癌患者肺内的肿瘤在呼吸过程中有非常明显的位置移动,传统3D的靶区设计因须考虑吸气和呼气末相的肿瘤位置而使GTV要大得多,这会导致更多的肺组织受到不必要的照射,引起更严重的RP。随着4D-CT图像技术引入肺癌放疗中,在呼吸周期追踪肺内肿瘤运动,在内靶区ITV的勾画时准确地补偿呼吸运动的影响,从而大幅缩小了肿瘤靶区体积,降低了正常组织的受照剂量,减少中远期放疗并发症,提高放疗后生存质量[17]。Hayashi等[5]研究发现≥85岁的高龄患者接受SBRT后RP的发生率及严重程度均较高,因此,在对Ⅰ期NSCLC老年患者进行SBRT治疗时,应使用4D-CT、实时肿瘤追踪放疗系统等技术可降低RP的发生率。
值得注意的是,在本研究中,中央型和周围型Ⅰ期肺癌的老年患者SBRT后的LCR、PFS和OS无显著差异。对于中央型肺癌,由于肿瘤侵犯到大的气管或动脉,手术治疗时切除范围更广,死亡率更高[18-19],因此,手术切除对于中央型肺癌是一种高风险的治疗方式。2014年肺癌NCCN指南已经把SBRT作为不能手术的周围型ⅠA期NSCLC的首选治疗,但对于中央型的Ⅰ期NSCLC,SBRT治疗由于它的风险而存在争议[20]。VU大学医学中心公布的一项研究结果表明SBRT对于不适合手术的中央型肿瘤患者是一种安全有效的治疗方法[21]。与上述研究结果类似,本研究中给予中央型肺癌患者60 Gy/10Fx,其生物有效剂量 (biological effective dose,BED)为96 Gy,肺的平均V20为7.7% (范围1%~18%),可以对肺起到保护作用。在本研究中,≥2级RP在中央型肺癌患者的发生率略高于周围型肺癌患者,但差异无统计学意义(P=0.165)。因此,本研究结果表明,只要采用合适的分割剂量,应用TOMO对早期中央型病灶进行SBRT治疗是安全有效的。
Chi等[22]对2002年至2009年间的35项SBRT治疗早期NSCLC的临床结果进行了分析,结果表明远处转移是SBRT治疗后的主要失效模式。本研究的结果与该研究结果类似,远处转移的发生率为16.7% (5/30),1例同侧其他肺叶转移,2例对侧肺转移,1例直肠转移,1例双肾上腺转移。远处转移对患者预后影响很大,本研究中的2例死亡病例的死因均为远处转移。
本研究存在几个争议问题。首先,本研究中有一半肺癌患者为临床诊断,我们主张有条件的肺癌患者在放疗前均应考虑穿刺活检,但在本研究中,一部分患者由于肺部病灶位置、大小等因素无法穿刺成功,以及老年患者多合并有严重肺功能障碍或者出血性疾病等基础疾病而不适宜或者拒绝进行穿刺活检,对于这部分无病理患者,必须经放疗科、放射诊断科、病理科、胸外科和肺科等MDT会诊,临床诊断为Ⅰ期肺癌才能给予SBRT治疗。临床诊断需综合考虑患者的CT随访结果 (有明显增大的证据)、FDG-PET扫描结果 (SUV值增高)和临床特征,以及排除性的鉴别诊断。荷兰的研究结果表明,根据CT和FDG-PET扫描结果临床诊断为肺癌的接受手术的患者中,只有1%~4.3%为良性病灶[23-25]。
另外,现在大多数学者SBRT的推荐剂量为BED≥100 Gy。但本研究入组患者为基础疾病不能耐受手术或拒绝手术的老年Ⅰ期肺癌患者,心肺功能差,基础疾病多,体质相对虚弱。而且已有研究表明,在治疗中央型肺癌 (紧靠气管、支气管和大血管)时可引起致命的不良反应[26]。因此,本研究中对中央型肺癌患者采用较为安全的60 Gy/10F的放疗方案,BED为96 Gy,略低于推荐剂量。
本研究由于样本量有限,随访时间尚短,疗效及晚期放射反应损伤评估有待进一步观察、随访及研究。本研究结果提示:使用TOMO配合4D-CT呼吸时相融合控制技术对老年Ⅰ期肺癌患者进行SBRT治疗,患者耐受良好,对周围型和中央型肺癌均可取得较好的LCR和OS,是一种安全有效的治疗手段。
参考文献
[1]MAKRANTONAKIS PD,GALANI E,HARPER PG.Non-small cell lung cancer in the elderly[J].Oncologist,2004,9(5):556-560.
[2]RAZ DJ,ZELL JA,OU SH,etal.Natural history of stage I non-small cell lung cancer:implications for early detection[J].Chest,2007,132 (1):193-199.
[3]CHANG JY,SENAN S,PAUL MA,etal.Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer:a pooled analysis of two randomised trials[J].LancetOncol,2015,16 (6):630-637.
[4]LONARDI F,COELI M,PAVANATO G,etal.Radiotherapy for non-small cell lung cancer in patients aged 75 and over:safety,effectiveness and possible impact on survival[J].LungCancer,2000,28 (1):43-50.
[5]HAYASHI S,TANAKA H,KAJIURA Y,etal.Stereotactic body radiotherapy for very elderly patients (age,greater than or equal to 85 years) with stage I non-small cell lung cancer[J].RadiatOncol,2014,16 (9):138.
[6]TAKEDA A,SANUKI N,ERIGUCHI T,etal.Stereotactic ablative body radiation therapy for octogenarians with non-small cell lung cancer[J].IntJRadiatOncolBiolPhys,2013,86 (2):257-263.
[7]YAMASHITA H,NAKAGAWA K,NAKAMURA N,etal.Exceptionally high incidence of symptomatic grade 2-5 radiation pneumonitis after stereotactic radiation therapy for lung tumors[J].RadiatOncol,2007(2):21.
[8]GUCKENBERGER M,BAIER K,RICHTER A,etal.Dose-response relationship for radiation-induced pneumonitis after pulmonary stereotactic body radiotherapy[J].RadiotherOncol,2010,97 (1):65-70.
[9]ONG CL,PALMA D,VERBAKEL WF,etal.Treatment of large stage I-Ⅱ lung tumors using stereotactic body radiotherapy (SBRT):planning considerations and early toxicity[J].RadiotherOncol,2010,97 (3):431-436.
[10]BARRIGER RB,FORQUER JA,BRABHAM JG,etal.A dose-volume analysis of radiation pneumonitis in non-small cell lung cancer patients treated with stereotactic body radiation therapy[J].IntJRadiatOncolBiolPhys,2012,82 (1):457-462.
[11]STAUDER MC,MACDONALD OK,OLIVIER KR,etal.Early pulmonary toxicity following lung stereotactic body radiation therapy delivered in consecutive daily fractions[J].RadiotherOncol,2011,99 (2):166-171.
[12]RICARDI U,FILIPPI AR,GUARNERI A,etal.Stereotactic body radiation therapy for early stage non-small cell lung cancer:results of a prospective trial[J].LungCancer,2010,68 (1):72-77.
[13]BARRIGER RB,FORQUER JA,BRABHAM JG,etal.A dosevolume analysis of radiation pneumonitis in non-small cell lung cancer patients treated with stereotactic body radiation therapy[J].IntJRadiatOncolBiolPhys,2012,82(1):457-462.
[14]BAKER R,AN G,SARANGKASIRI S,etal.Clinical and dosimetric predictors of radiation pneumonitis in a large series of patients treated with stereotactic body radiation therapy to the lung[J].IntJRadiatOncolBiolPhys,2013,85(1):190-195.
[15]HUANG K,DAHELE M,SENAN S,etal.Radiographic changes after lung stereotactic ablative radiotherapy (SABR) can we distinguish recurrence from fibrosis? A systematic review of the literature[J].RadiotherOncol,2012,102(3):335-342.
[16]RICARDI U,FILIPPI AR,GUARNERI A,etal.Dosimetric predictors of radiation-induced lung injury in stereotactic body radiation therapy[J].ActaOncol,2009,48(4):571-577.
[17]张海南,汤日杰,张书旭,等.基于4D-CT图像在肺癌放疗靶区勾画设计中的应用[J].中国医学工程,2011,19(5):4-6.
[18]LAUSBERG HF,GRAETER TP,TSCHOLL D,etal.Bronchovascular versus bronchial sleeve resection for central lung tumors[J].AnnThoracSurg,2005,79 (4):1147-1152.
[19]CHEN C,BAO F,ZHENG H,etal.Local extension at the hilum region is associated with worse long-term survival in stage I non-small cell lung cancers[J].AnnThoracSurg,2012,93 (2):389-396.
[20]VAN BAARDWIJK A,TOMÉ WA,VAN ELMPT W,etal.Is high-dose stereotactic body radiotherapy (SBRT) for stage I non-small cell lung cancer (NSCLC) overkill? A systematic review[J].RadiotherOncol,2012,105 (2):145-149.
[21]SENTHI S,HAASBEEK CJ,SLOTMAN BJ,etal.Outcomes of stereotactic ablative radiotherapy for central lung tumours:a systematic review[J].RadiotherOncol,2013,106 (3):276-282.
[22]CHI A,LIAO Z,NGUYEN NP,etal.Systemic review of the patterns of failure following stereotactic body radiation therapy in early-stage non-small-cell lung cancer:clinical implications[J].RadiotherOncol,2010,94 (1):1-11.
[23]VAN TINTEREN H,HOEKSTRA OS,SMIT EF,etal.Effectiveness of positron emission tomography in the preoperative assessment of patients with suspected non-small-cell lung cancer:The PLUS multicentre randomised trial[J].Lancet,2002,359(9315):1388e-1393e.
[24]HERDER GJ,VAN TINTEREN H,GOLDING RP,etal.Clinical prediction model to characterize pulmonary nodules:Validation and added value of 18F-fluorodeoxyglucose positron emission tomography[J].Chest,2005,128(4):2490e-2496e.
[25]BELGERS EH,SIEBENGA J,BOSCH AM,etal.Complete video-assisted thoracoscopic surgery lobectomy and its learning curve.A single center study introducing the technique in The Netherlands[J].InteractCardiovascThoracSurg,2010,10(2):176e-180e.
[26]TIMMERMAN R,MCGARRY R,YIANNOUTSOS C,etal.Excessive toxicity when treating central tumors in a phase Ⅱ study of stereotactic body radiation therapy for medically inoperable early-stage lung cancer[J].JClinOncol,2006,24(30):4833-4839.
Stereotactic body radiotherapy for elderly patients with stage I lung cancer:toxicity and effectiveness
SHI Shi-ming,HE Jian△,HUANG Yan,HU Yong,SHEN Ya,ZHANG Jian-ying,ZENG Zhao-chong
(DepartmentofRadiationOncology,ZhongshanHospital,FudanUniversity,Shanghai200032,China)
【Abstract】ObjectiveTo evaluate the toxicity and effectiveness after stereotactic body radiotherapy (SBRT) for elderly patients (age≥70 years)with stage Ⅰ lung cancer.MethodsThirty eldly patients with stage I lung cancer were recruited between June 2011 and June 2013 with strict inclusion criteria.All patients were treated with SBRT via helical tomotherapy combined with 4D-CT respiratory gating system.A total of 60 Gy in 10 fractions was delivered in the central tumors,while 50 Gy in 5 fractions in the peripheral tumors.The clinical follow-up was performed regarding to toxicity and effectiveness after treatment.ResultsThe median follow-up period was 28.3 months.One-and two-year local control rates (LCR) were all 77.9%.One- and two-year progression-free survival (PFS) rates were 66.7% and 56.4%,respectively.One- and two-year overall survival (OS) rates were 96.7% and 92.1%,respectively.The incidence of grade 2 and grade 3 radiation pneumonitis were 6.6% and 3.3%.No significant difference was found in the toxicity and effectiveness between the central and the peripheral tumors.ConclusionsTreatment of SBRT via helical tomotherapy combined with 4D-CT respiratory gating system was feasible and well tolerated for elderly patients with stage I lung cancer,and resulted in excellent LCR and OS for both peripheral and central tumors.
【Key words】stereotactic radiation therapy;lung cancer;elderly;efficacy
(收稿日期:2015-06-30;编辑:张秀峰)
【中图分类号】R734.2
【文献标识码】B
doi:10.3969/j.issn.1672-8467.2016.02.011
上海市科学技术委员会医学引导类项目 (14411970100)
△Corresponding authorE-mail:hejian62@163.com

