新型苯并咪唑杂多酸盐离子液体的制备及其在催化合成己二酸中的应用
胡海燕, 郭宗阳, 刘文博, 张永红, 刘晨江
(新疆大学 石油化工天然气精细化工教育部&自治区重点实验室,新疆 乌鲁木齐 830046)
·快递论文·
新型苯并咪唑杂多酸盐离子液体的制备及其在催化合成己二酸中的应用
胡海燕, 郭宗阳, 刘文博, 张永红, 刘晨江*
(新疆大学 石油化工天然气精细化工教育部&自治区重点实验室,新疆 乌鲁木齐830046)
摘要:以1-丁基苯并咪唑为起始原料,合成了1-丁基-3-(4-磺酸基丁基)苯并咪唑內盐(1), 1-丁基-3-羧甲基苯并咪唑氯盐(2)和1,3-二丁基苯并咪唑溴盐(3); 1~3分别与硅钨酸、磷钨酸和磷钼酸在水或者乙醇中反应,合成了5种新型的杂多酸盐离子液体——1-丁基-3-(4-磺酸基丁基)苯并咪唑硅钨酸盐(4a), 1-丁基-3-(4-磺酸基丁基)苯并咪唑磷钨酸盐(4b), 1-丁基-3-(4-磺酸基丁基)苯并咪唑磷钼酸盐(4c), 1-丁基-3-羧甲基苯并咪唑硅钨酸盐(5)和1,3-二丁基苯并咪唑硅钨酸盐(6),其结构经1H NMR, (13)C NMR和IR表征。并考察了4~6在30%H2O2催化氧化环己烯制备己二酸反应中的催化效果。实验结果表明:4b的催化效果最好。在最佳反应条件[环己烯20 mmol, 4b 0.16 mmol, n(环己烯) ∶n(H2O2) ∶n(ILs)=1 ∶4.4 ∶0.008]下,己二酸产率71%。
关键词:苯并咪唑; 杂多酸离子液体; 环己烯; 制备; 催化氧化; 己二酸
离子液体是一种低温熔融盐,具有蒸汽压低、不易挥发、导电性强、热稳定性和化学稳定性好等独特的性质,广泛应用于有机合成、催化、萃取分离、电化学、纳米材料等化学领域[1-3]。离子液体的阴阳离子结构可调,可根据应用需求设计合成具有特定性质和功效的功能化离子液体。传统的离子液体阳离子主要有咪唑离子、吡啶离子、烷基季铵离子、烷基季鏻离子等;阴离子主要有卤离子、四氟硼酸根、六氟磷酸根、乙酸根等。随着离子液体的发展,具有杂多酸的酸性和较好的催化氧化性的杂多酸型功能化离子液体成功地应用于催化氧化反应中[4]。
己二酸俗称肥酸,是一种重要的有机合成中间体和化工原料,它可以参与成盐、酯化、胺化、酰卤化及成酐等反应,广泛应用于尼龙66、工程塑料、医药、杀虫剂、粘合剂、染料和香料等的合成[5]。工业上主要通过环己醇和环己酮经硝酸氧化法合成。该方法存在以下缺点:产生氮氧化物和强酸废液,严重污染环境,且腐蚀设备。因此,寻找环境友好的合成己二酸的新方法具有重要的意义。
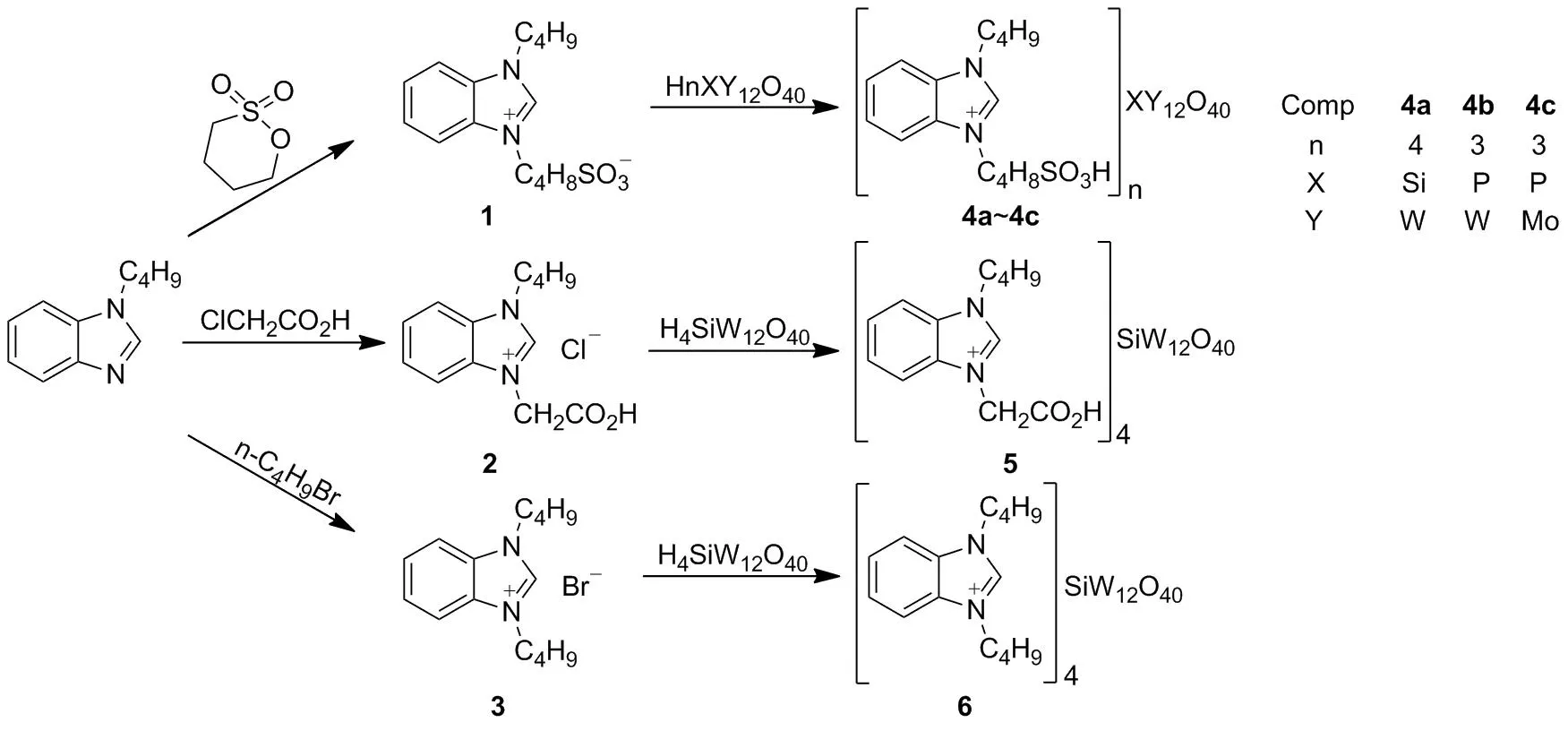
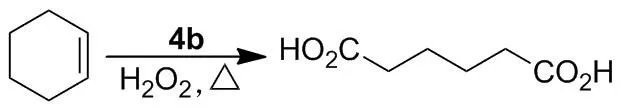
近年来,合成己二酸的绿色方法主要是以O2, O3和H2O2为氧化剂[6],磷钨酸[7]、钨酸[8]、三氧化钨[9]、钨酸盐[10]、过氧杂多酸盐[11]和离子液体[12]等为催化剂。为了丰富和发展己二酸的绿色合成方法,在前期将离子液体用于氧化反应研究的基础上[13],本文以1-丁基苯并咪唑为起始原料,合成了1-丁基-3-(4-磺酸基丁基)苯并咪唑內盐[BSbBim](1), 1-丁基-3-羧甲基苯并咪唑氯盐[CMbBim]Cl(2)和1,3-二丁基苯并咪唑溴盐[BbBim]Br(3)三种中间体;1~3分别与硅钨酸、磷钨酸和磷钼酸在水或者乙醇中反应,合成了5个新型的杂多酸盐离子液体——1-丁基-3-(4-磺酸基丁基)苯并咪唑硅钨酸盐[BSbBim]4SiW12O40(4a), 1-丁基-3-(4-磺酸基丁基)苯并咪唑磷钨酸盐[BSbBim]3PW12O40(4b), 1-丁基-3-(4-磺酸基丁基)苯并咪唑磷钼酸盐[BSbBim]3PMo12O40(4c), 1-丁基-3-羧甲基苯并咪唑硅钨酸盐[CMbBim]4SiW12O40(5)和1,3-二丁基苯并咪唑硅钨酸盐[BbBim]4SiW12O40(6)(Scheme 1),其结构经1H NMR,13C NMR和IR表征。并考察了4~6在30%H2O2催化氧化环己烯制备己二酸反应中的催化性能(Scheme 2)。
Scheme 1
Scheme 2
1实验部分
1.1仪器与试剂
Varian Inova-MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker FTIR EQUINOX-55型
红外光谱仪(KBr压片)。
1[14]和3[15]参考文献方法合成;其余所用试剂均为分析纯。
1.2合成
(1) 2的合成
在圆底烧瓶中加入1-丁基苯并咪唑3.48 g(20 mmol)和甲苯10 mL,搅拌使其溶解;滴加氯乙酸1.809 8 g(24 mmol),滴毕,升温至110 ℃,反应48 h。析出大量白色固体,冷却至室温,抽滤,滤饼用甲苯(3×10 mL)洗涤,真空干燥得白色固体2 4.725 3 g,产率88%, m.p.169.4~171.1 ℃;1H NMRδ: 13.93(s, 1H, CO2H), 9.99(s, 1H, NCH), 8.15~7.54(m, 4H, ArH), 5.54(s, 2H, CH2), 4.59(t,J=7.6 Hz, 2H, CH2), 1.91~1.88(m, 2H, CH2), 1.37~1.34(m, 2H, CH2), 0.93(t,J=7.2 Hz, 3H, CH3);13C NMRδ: 168.04, 143.47, 131.34, 130.83, 126.98, 126.73, 114.09, 113.92, 79.47, 47.72, 30.67, 19.17. 13. 53。
(2) 4a~4c的合成(以4a为例)
在圆底烧瓶加入硅钨酸1.439 1 g(0.5 mmol) 和水7 mL,搅拌使其溶解; 加入1 0.620 4 g(2 mmol),于室温反应24 h。旋蒸除溶,于80 ℃真空干燥24 h得白色固体4a 2.018 0 g。
用类似方法合成白色固体4b和墨绿色固体4c。
4a: 产率98%;1H NMRδ: 9.83(s, 1H, NCH), 8.14~8.09(m, 2H, ArH), 7.71~7.69(m, 2H, ArH), 5.86(s, 1H, SO3H), 4.55~4.49(m, 4H, CH2), 2.58(t,J=7.6 Hz, 2H, CH2), 2.05~2.01(m, 2H, CH2), 1.92~1.89(m, 2H, CH2), 1.67~1.63(m, 2H, CH2), 1.38~1.32(m, 2H, CH2), 0.93(t,J=7.2 Hz, 3H, CH3);13C NMRδ: 142.32, 131.35, 126.75, 114.03, 113.90, 50.57, 46.65, 30.71, 27.84, 22.07, 19.32, 13.60; IRν: 3 422, 3 141, 3 072, 1 564, 1 459, 1 144, 1 014, 972, 883, 794 cm-1。
4b: 产率94%;1H NMRδ: 9.83(s, 1H, NCH), 8.14~8.08(m, 2H, ArH), 7.71~7.68(m, 2H, ArH), 5.49(s, 1H, SO3H), 4.54~4.48(m, 4H, CH2), 2.56(t,J=7.6 Hz, 2H, CH2), 2.05~2.01(m, 2H, CH2), 1.92~1.88(m, 2H, CH2), 1.66~1.63(m, 2H, CH2), 1.38~1.32(m, 2H, CH2), 0.93(t,J=7.2 Hz, 3H, CH3);13C NMRδ: 142.32, 131.35, 126.74, 114.03, 113.87, 50.56, 46.64, 30.70, 27.83, 22.08, 19.31, 13.59; IRν: 3 424, 3 144, 1 565, 1 458, 1 144, 1 079, 978, 896, 809 cm-1。
4c: 产率94%;1H NMRδ: 9.83(s, 1H, NCH), 8.15~8.08(m, 2H, ArH), 7.71~7.67(m, 2H, ArH), 5.10(s, 1H, SO3H), 4.54~4.32(m, 4H, CH2), 2.54(t,J=7.6 Hz, 2H, CH2), 2.43~1.94(m, 2H, CH2), 1.92~1.86(m, 2H, CH2), 1.67~1.62(m, 2H, CH2), 1.38~1.31(m, 2H, CH2), 0.93(t,J=7.6 Hz, 3H, CH3);13C NMRδ: 142.38, 131.34, 126.73, 114.03, 113.87, 50.56, 46.62, 30.69, 27.87, 22.16, 19.30, 13.58; IRν: 3 426, 3 143, 1 563, 1 457, 1 142, 1 062, 958, 879, 800 cm-1。
(3) 5和6的合成(以5为例)
在反应瓶中加入硅钨酸1.439 1 g(0.5 mmol), 2 0.509 g(2 mmol)和乙醇10 mL,搅拌使其溶解;于75 ℃反应24 h。析出白色沉淀,冷却至室温,过滤,滤饼干燥得白色固体5 1.713 2 g。
用3替代2,用类似方法合成白色固体6。
5: 产率90%;1H NMRδ: 13.86(s, 1H, CO2H), 9.74(s, 1H, NCH), 8.15~8.05(m, 2H, ArH), 7.74~7.71(m, 2H, ArH), 5.60(s, 2H, CH2), 4.61(t,J=7.2 Hz, 2H, CH2), 1.93~1.90(m, 2H, CH2), 1.37~1.31(m, 2H, CH2), 0.93(t,J=7.2 Hz, 3H, CH3);13C NMRδ: 166.82, 143.39, 131.71, 130.83, 127.10, 126.93, 114.09, 113.97, 62.23, 47.59, 46.85, 30.66, 19.17, 14.14, 13.54; IRν: 3 471, 3 136, 3 069, 2 957, 1 952, 1 016, 975, 885, 795 cm-1。
6: 产率85%;1H NMRδ: 9.78(s, 1H, NCH), 8.11~8.09(m, 2H, ArH), 7.71~7.69(m, 2H, ArH), 4.51(t,J=7.2 Hz, 4H, CH2), 1.95~1.87(m, 4H, CH2), 1.38~1.32(m, 4H, CH2), 0.93(t,J=7.2 Hz, 6H, CH3);13C NMRδ: 142.15, 131.33, 126.75, 113.88, 46.65, 30.72, 19.29, 13.58; IRν: 3 136, 3 075, 2 969, 1 139, 1 013, 973, 883, 794 cm-1。
1.3催化反应
在反应瓶中加入4b 0.152 4 g(0.04 mmol)和30%H2O210.0 g(88 mmol ),搅拌使其溶解;于室温反应20 min。加入环己烯1.623 0 g(20 mmol),于75 ℃反应4 h。升温至95 ℃,回流反应6 h。冷却至室温,置冰箱(2~4 ℃)中过夜。析出大量白色固体,抽滤,滤饼用冰水洗涤,干燥得白色固体己二酸,产率70.9%, m.p.150.5~153.4 ℃(149~152 ℃[16]);1H NMRδ: 12.01(s, 2H, CO2H), 2.23~2.20(m, 4H, CH2), 1.51~1.48(m, 4H, CH2)。
2结果与讨论
2.1表征
4a~4c, 5和6的1H NMR 分析表明:δ9.83~9.37处的单峰归属苯并咪唑中CH=N,δ8.15~7.69处多重峰归属ArH;13C NMR 谱中δ143~142处吸收峰为苯并咪唑中C=N的特征吸收峰。
4a~4c, 5和6的IR分析表明: 3 140 cm-1和3 070 cm-1附近出现苯并咪唑2-位C-H吸收峰;1 560 cm-1和1 450 cm-1附近出现咪唑环骨架吸收峰,1 144 cm-1附近出现S=O伸缩振动峰。4a~4c和5在3 400 cm-1附近出现O-H的吸收峰。从4a, 5和6的IR谱图(图略)可见,硅钨酸阴离子的特征吸收峰出现在1 015 cm-1, 975 cm-1, 883 cm-1和795 cm-1; 4b的磷钨酸阴离子特征吸收峰在1 079 cm-1, 978 cm-1, 896 cm-1和809 cm-1附近出现;4c在1 062 cm-1, 958 cm-1, 879 cm-1和800 cm-1附近出现磷钼酸阴离子特征吸收峰。
2.24~6的催化性能
为了探索4~6催化合成己二酸的最佳反应条件,考察了4~6的催化效果、用量及后期反应温度和时间等对己二酸产率的影响。
(1) 催化剂
环己烯20 mol,其余反应条件同1.3,考察4~6的催化效果。实验结果表明: 4b对催化氧化环己烯合成己二酸有较好的催化效果,己二酸产率达70.9%。在相同条件下,4a, 4c, 5和6无催化效果。这可能是因为该反应过程与溶液的酸性成正比[17],酸性弱条件不利于反应的进行。因此,最佳离子液体催化剂为4b。
(2) 催化剂用量
以4b为催化剂,其余反应条件同2.2(1),考察4b的用量对己二酸产率的影响,结果见表1。从表1可见,随着4b用量的增加,产率先增加后减小。当4b用量为0.16 mmol时,产率最高(71%);继续增加4b的用量,产率有所下降。这是因为双氧水氧化环己烯的反应中,酸性的影响较大,而该反应体系酸性由离子液体调节,故催化剂的用量直接影响己二酸的产率。因此,4b最佳用量为0.16 mmol。
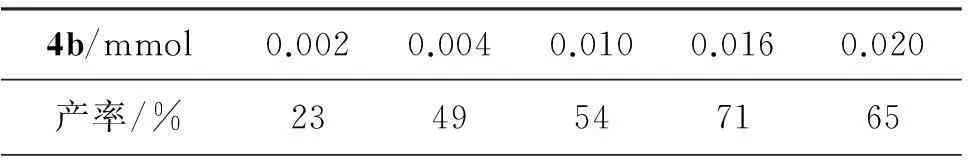
表1 4b用量对己二酸产率的影响*
*4b为催化剂,其余反应条件同2.2(1)。
(3) 后期反应时间和温度
4b 0.16 mmol,其余反应条件同2.2(1),考察后期反应时间和温度对己二酸产率的影响,结果见表2。从表2可见,己二酸的产率随后期温度增加呈先升高后降低的变化趋势,当后期反应温度为95 ℃时,产率最高。这可能是因为后期反应温度较低,双氧水的利用率下降,中间产物转化不充分,导致产率较低;而当后期反应温度过高时,有副产物生成或己二酸在高温下脱羧分解,反应结束后溶液呈褐色,因而己二酸的产率下降。因此,4b催化环己烯制备己二酸反应后期的最佳温度是95 ℃。
从表2还可见,己二酸的产率与反应时间成正比(No.3, No.5~7),但是当后期反应时间超过4.5 h后,反应溶液呈黑色,有大量副产物产生,产率下降(No.8)。因此,该反应中后期的最佳时间为4.5 h。
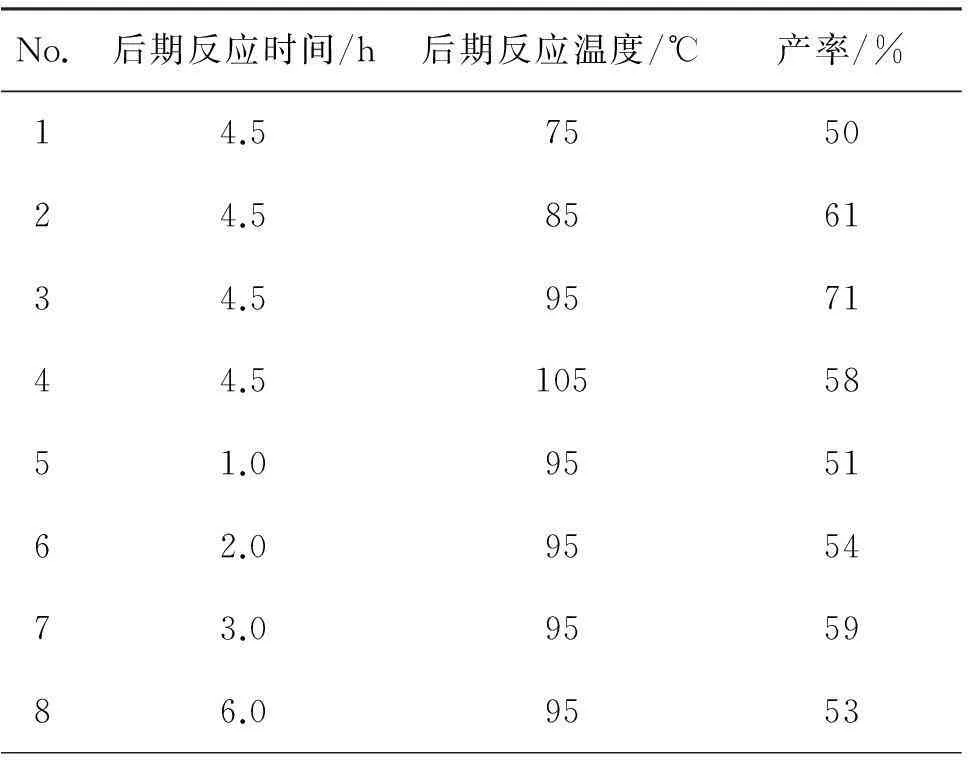
表2 后期反应时间和温度对己二酸产率的影响*
*4b 0.16 mmol,其余反应条件同表1。
综上所述,催化反应的最佳条件为:环己烯20 mmol, 4b 0.16 mmol,后期于95 ℃反应4.5 h,己二酸产率71%。
3结论
以1-丁基苯并咪唑为起始原料,合成了5种新型的杂多酸盐离子液体(4a~4c, 5和6)。在最佳反应条件[环己二烯20 mmol, 4b 0.16 mmol,后期于95 ℃反应4.5 h]下,己二酸的产率71%。4a, 4c, 5和6对该反应无催化性能。
参考文献
[1]Hallett J P, Welton T. Room-temperature ionic liquids:Solvents for synthesis and catalysis.2[J].Chem Rev,2011,111:3508-3576.
[2]Olivier-Bourbigou H, Magna L, Morvan D. Ionic liquids and catalysis:Recent progress from knowledge to applications[J].Appl Catal Gen,2010,373:1-56.
[3]Chi Y S, Li C P, Jiao Q Z,etal. Desulfurization by oxidation combined with extraction using acidic room-temperature ionic liquids[J].Green Chem,2011,13:1224-1229.
[4]江春涛,戚红亮,李猛,等. 杂多酸离子液体在催化有机合成反应中的研究进展[J].精细石油化工进展,2014,15(5):47-54.
[5]汪家铭. 己二酸市场前景及发展建议[J].精细化工原料及中间体,2010,10:38-40.
[6]Vyver S V de, Román-Leshkov Y. Emerging catalytic processes for the production of adipic acid[J].Catal Sci Technol,2013,3:1465-1479.
[7]张英群,王春,李贵深,等. 磷钨酸催化过氧化氢氧化环己烯合成己二酸[J].有机化学,2003,23(1):104-105.
[8]Wen Y, Wang X, Wei H,etal. A large-scale continuous-flow process for the production of adipic acid via catalytic oxidation of cyclohexene with H2O2[J].Green Chem,2012,14:2868-2875.
[9]阎松,姜恒,宫红,等. 三氧化钨催化氧化环己烯合成己二酸[J].中国钨业,2005,20(2):33-36.
[10]Noyori R, Aoki M, Sato K. Green oxidation with aqueous hydrogen peroxide[J].Chem Commun,2003:1977-1986.
[11]Jin P, Wei D H, Wen Y Q,etal. A combined experimental and DFT study of active and self-cycle mechanisms of mononuclear tungsten peroxo complexes in oxidation reactions[J].J Mol Struct,2011,992:19-26.
[12]Wu J H, Jiang, P P, Leng Y,etal. Synthesis of dicationic alkyl imidazolium peroxopolyoxotungsten-based phase transfer catalyst and its catalytic activity for olefin epoxidation[J].Chin J Chem,2013,342:236-2244.
[13]Li H, Liu C J, Zhang Y H,etal. Green method for the synthesis of chromeno[2,3-c]pyrazol-4(1H)-ones through ionic liquid promoted directed annulation of 5-(aryloxy)-1H-pyrazole-4-carbaldehydes in aqueous media[J].Org Lett,2015,17:932-935
[14]王斌,刘晨江,王吉德,等. 功能化苯并咪唑类离子液体的合成及性质[J].高等学校化学学报,2012,33(1):76-81.
[15]Huang W, Guo J P, Xiao Y J. Palladium-benzimidazolium salt catalyst systems for Suzuki coupling:Development of a practical and highly active palladium catalyst system for coupling of aromatic halides with arylboronic acids.Tetrahedron,2005,61:9783-9790
[16]曹发斌,孙盈建,刘云义,等. 磷钨酸-有机酸性助剂催化氧化环己酮合成己二酸[J].合成化学,2004,14(6):603-605
[17]王向宇,苗永霞,贾琦,等. 己二酸绿色合成中溶液酸性的影响[J].石油化工,2003,7(32):608-610.
Preparation of Novel Benzimidazole Heteropolyanion-based Ionic Liquids and Their Application in the Catalytic Synthesis of Adipic Acid
HU Hai-yan,GUO Zong-yang,LIU Wen-bo,ZHANG Yong-hong,LIU Chen-jiang*
(Key Laboratory of Oil and Gas Fine Chemicals, Ministry of Education & Xinjiang Uygur Autonomous Region, Urumqi 830046, China)
Abstract:Five novel heteropolyacid-based ionic liquids [BSbBim]4SiW(12)O(40)(4a), [BSbBim]3PW(12)O(40)(4b), [BSbBim]3PMo(12)O(40)(4c), [CMbBim]4SiW(12)O(40)(5) and [BbBim]4SiW(12)O(40 )(6) were synthesized by reaction of heteropolyacid with [BSbBim](1), [CMbBim]Cl(2) and [BbBim]Br(3), which were prepared from 1-butyl-1H-benzo[d]imidazole. The structures were characterized by 1 H NMR, (13)C NMR and IR. Oxidation of cyclohexene to adipic acid with hydrogen peroxide catalyzed by 4~6 were investigated. And the results showed that 4b has the best catalytic activity. The yield of adipic acid was up to 71% under the optimized conditions that cyclohexene was 20 mmol, 4b was 0.16 mmol, n(cyclohexene) ∶n(H2O2) ∶n(ILs) was 1 ∶4.4 ∶0.008.
Keywords:benzimidazol; heteropolyanion-based ionic liquid; cyclohexene; preparation; catalytic oxidation; adipic acid
中图分类号:O626.3
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.15139
作者简介:胡海燕(1989-),女,汉族,甘肃张掖人,硕士研究生,主要从事有机合成的研究。 E-mail: h1019908791@126.com通信联系人: 刘晨江,教授, E-mail: pxylcj@126.com
基金项目:国家自然科学基金资助项目(21162025, 21262035)
收稿日期:2015-04-20;
修订日期:2016-01-08

