Sirt1转基因小鼠股动脉结扎后血管新生的初步研究
·研究快报·
Sirt1转基因小鼠股动脉结扎后血管新生的初步研究
李晓坤,麻晓婷,聂磊,窦永青,韩梅*(河北医科大学基础医学院生物化学与分子生物学教研室,河北 石家庄 050017)
[关键词]新生血管化,生理性;股动脉;小鼠
doi:10.3969/j.issn.1007-3205.2016.03.026
血管新生是在血管新生因子刺激下,已存在的血管通过内皮细胞迁移、增殖形成新血管的过程[1-3]。生理情况下,血管新生可以为组织提供更多血流,而当其调节紊乱时会发生血管新生异常,包括血管新生过度或血管生成不足,进而造成多种疾病,如恶性肿瘤、糖尿病视网膜病变、动脉粥样硬化、缺血性心脏病、风湿性关节炎等。因此,研究血管新生性疾病的治疗靶点具有重要意义。沉默信息调节因子1(silent information regulator 1,SIRT1)是烟酰胺腺嘌呤二核苷酸依赖的去乙酰化酶[4-5],对调节衰老、细胞存活、代谢和炎症、肿瘤形成等起重要作用,有研究报道SIRT1在血管新生中起关键调节作用[6]。本研究利用野生型(wild type,WT)C57BL/6及Sirt1转基因(Sirt1-Transgenic,Sirt1-Tg)小鼠建立下肢股动脉结扎手术模型,对组织缺血后血管新生情况进行初步研究。
1材料与方法
1.1实验动物C57BL/6小鼠由河北省实验动物中心提供,Sirt1-Tg小鼠由中国协和医科大学刘德培教授惠赠,本实验室自行繁殖培育。所有动物均饲养于无特定病原体(specefic pathogen free,SPF)级动物房,温度湿度恒定的独立通气笼盒,清洁饮水,自由取食。环境采用12 h明暗循环,早7:00到晚7:00照明,晚7:00到次日早7:00无照明。所有动物实验均按照河北医科大学动物管理条例进行。
1.2Sirt1-Tg小鼠基因型鉴定随机选取6~8周龄Sirt1-Tg小鼠,按照雌雄比例为2∶1的方式交配[7],自由饮水取食,孕鼠自然分娩。仔鼠出生3周后断奶,雌雄分笼,取鼠耳基因组DNA,用聚合酶链反应(polymerase chain reaction,PCR)技术进行基因型鉴定。引物序列如下:上游引物 5′-CTTCAGGTCAAGGGATGGTAT-3′,下游引物 5′-GCGTGTCTATGTTCTGGGTAT-3′。PCR扩增产物长度为233 bp。PCR反应条件为:94 ℃ 5 min,94 ℃ 20 s、53 ℃ 20 s、72 ℃ 30 s(30个循环),72 ℃ 10 min。对PCR产物进行1%琼脂糖凝胶电泳并观察结果。
1.3左下肢股动脉结扎小鼠模型建立随机挑选8周龄的成年雄性C57BL/6(WT)小鼠及Sirt1-Tg小鼠各10只,手术全程在小动物麻醉机下进行,采用异氟烷持续吸入麻醉方式麻醉小鼠,取俯卧位,用透明胶带将小鼠四肢固定于手术板上,在固定条件(室温24 ℃、无强光、无噪声)下采用血流测量仪PeriCam PSI测量术前双下肢血流灌注情况并采用激光散斑对比分析技术记录图像。仰卧位下,常规褪毛备皮,75%酒精消毒左下肢侧,用眼科镊提起皮肤,用剪刀从左侧腹股沟到左大腿内侧沿血管走行方向纵行剪开一长1~1.5 cm的切口。在解剖显微镜视野下,用眼科镊钝性分离皮下组织,刺破膜状血管鞘,充分暴露股动脉、股静脉及其分支和股神经。轻轻分离股神经使其游离,然后将股动脉与股静脉分离,用弯头眼科镊剥离股动脉至股动脉分支处,防止损伤血管,用2根7号手术缝线穿过股动脉进行双端结扎,上端紧靠股动脉分支,下端距上端约5 mm,剪断两结扎点间的股动脉[8],缝合皮肤。再次用血流测量仪PeriCam PSI测量俯卧位时小鼠双下肢血流灌注情况,结扎侧无血流灌注即为模型建造成功。分别于术后3、7、14 d进行血流监测分析。
2结果
2.1小鼠基因型鉴定琼脂糖凝胶电泳结果显示,Sirt1-Tg小鼠PCR产物在250 bp附近可见清晰的条带,WT小鼠无此条带(图1)。
2.2血流监测激光散斑对比分析技术血流监测显示,结扎术前,Sirt1-Tg小鼠及WT小鼠双下肢血流灌注信号分布均一(图2 A,B);左下肢股动脉结扎后,该侧肢体血流灌注信号明显减弱甚至消失(图2 C,D);结扎术后3 d,左下肢显示局部微弱的血流灌注信号(图2 E,F);结扎术后7 d(图2 G,H)、14 d(图2 I,J)Sirt1-Tg小鼠及WT小鼠左下肢血流灌注均有所恢复,但Sirt1-Tg小鼠左下肢血流灌注恢复情况明显较WT小鼠差。
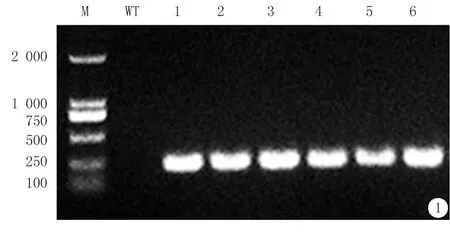
图1Sirt1-Tg小鼠基因型鉴定
M.Marker;WT.野生型C57BL/6小鼠;1~6.Sirt1-Tg小鼠
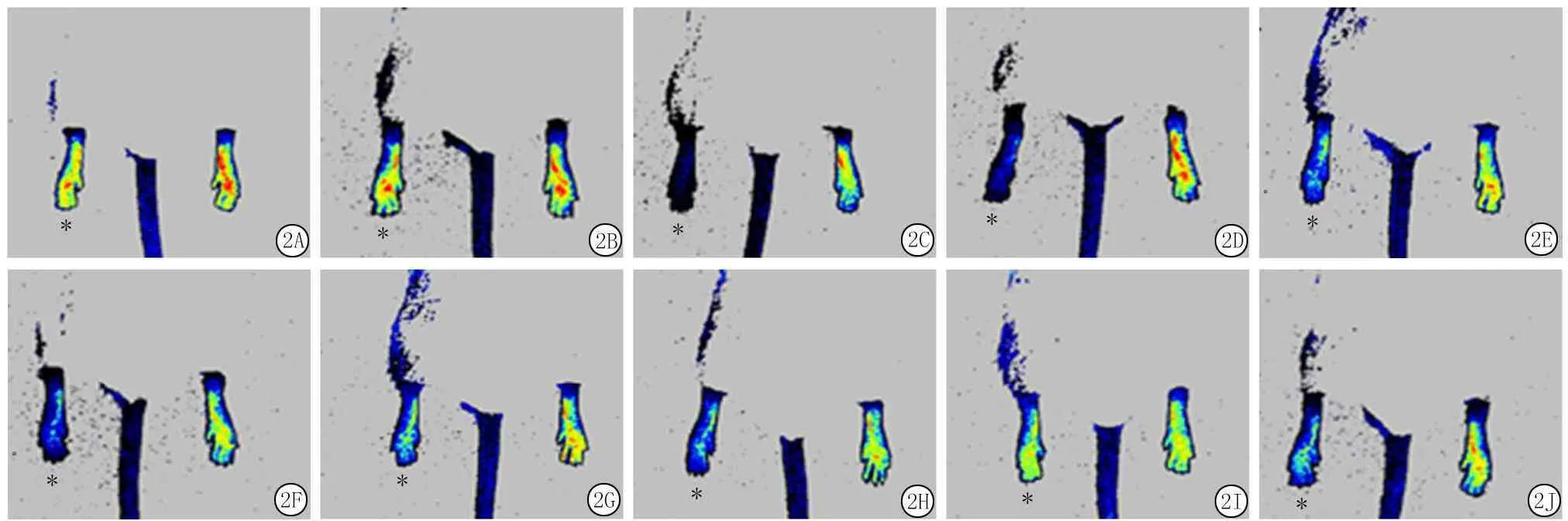
图2股动脉结扎术后2组小鼠下肢血流变化示意图
*为小鼠左下肢,未标示侧为小鼠右下肢。血流信号图像对应不同的颜色:红色表示最大血流灌注量,蓝色(或深蓝色)相反,黄色介于两者之间
A.结扎术前WT小鼠;B.结扎术前Sirt1-Tg小鼠;C.术后即刻WT小鼠;D.术后即刻Sirt1-Tg小鼠;E.术后3 d WT小鼠;F.术后3 dSirt1-Tg小鼠;G.术后7 d WT小鼠;H.术后7 dSirt1-Tg小鼠;I.术后14 d WT小鼠;J.术后14 dSirt1-Tg小鼠
3讨论
新生血管性疾病,无论是血管生成过度或是血管生成不足均同人类健康和疾病的发生有着密切的关系,如血管新生过度参与肿瘤的发生发展和转移,血管新生不足则会引起各种缺血性疾病。SIRT1在应激反应、代谢、衰老、肿瘤发生发展等多个生理病理过程中发挥重要作用[9],有研究显示SIRT1在肿瘤血管新生中发挥负调节作用[10]。本研究结果显示Sirt1-Tg小鼠在股动脉结扎后血流灌注恢复差。提示血管新生受到抑制,但其具体的影响机制尚须进一步探索。缺血缺氧状态下低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)[11]对血管内皮生长因子(vascular endothelial growth factor,VEGF)影响最大,VEGF具有促血管内皮细胞生长和分化功能的作用[12],能够促进血管新生[13]。有研究报道,SIRT1通过下调HIF-1α表达而抑制VEGF的转录活性及蛋白表达,从而抑制血管新生[14]。也有研究显示在缺氧环境下,SIRT1通过使HIF-1α发生脱乙酰作用而失活[10]。这些为后续研究提供了一定的思路。
本实验的创新点在于引入了Sirt1-Tg小鼠制作组织缺血-血管新生模型。初步结果提示,SIRT1可能对血管新生过程具有抑制作用,该发现对理解肿瘤生长调节和缺血性损伤修复机制提供了新的观点。
[参考文献]
[1]Carmeliet P,Jain RK. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature,2011,473(7347):298-307.
[2]Troidl K,Schaper W. Arteriogenesis versus angiogenesis in peripheral artery disease[J]. Diabetes Metab Res Rev,2012,28(Suppl 1):27-29.
[3]Liu J,Wang Y,Akamatsu Y,et al. Vascular remodeling after ischemic stroke:mechanisms and therapeutic potentials[J]. Prog Neurobiol,2014,115:138-156.
[4]D′Onofrio N,Vitiello M,Casale R,et al. Sirtuins in vascular diseases:Emerging roles and therapeutic potential[J]. Biochim Biophys Acta,2015,1852(7):1311-1322.
[5]Yang Y,Duan W,Li Y,et al. New role of silent information regulator 1 in cerebral ischemia[J]. Neurobiol Aging,2013,34(12):2879-2888.
[6]Zhang H,He S,Spee C,et al. SIRT1 mediated inhibition of VEGF/VEGFR2 signaling by Resveratrol and its relevance tochoroidal neovascularization[J]. Cytokine,2015,76(2):549-552.
[7]高亚坤,林燕玲,段志莉,等.一种繁育Sm22α基因敲除纯合子小鼠的方法[J].河北医科大学学报,2015,36(11):1356-1358.
[8]Nei L,Guo X,Esmailzadeh L,et al. Transmembrane protein ESDN promotes endothelial VEGF signaling and regulates angiogenesis[J]. J Clin Invest,2013,123(12):5082-5097.
[9]Bae HJ,Noh JH,Kim JK,et al. MicroRNA-29c functions as a tumor suppressor by direct targeting oncogenic SIRT1 in hepatocellular carcinoma[J]. Oncogene,2014,33(20):2557-2567.
[10]Lim JH,Lee YM,Chun YS,et al. Sirtuin 1 modulates cellular responses to hypoxia by deacetylating hypoxia-inducible factor 1 alpha[J]. Mol Cell,2010,38(6):864-878.
[11]Ahluwalia A,Tarnawski AS. Critical role of hypoxia sensor--HIF-1α in VEGF gene activation. Implications for angiogenesis and tissue injury healing[J]. Curr Med Chem,2012,19(1):90-97.
[12]Cheng Y,Jiang S,Hu R,et al. Potential mechanism for endothelial progenitor cell therapy in acute myocardial infarction:Activation of VEGF-PI3K/Akte-NOS pathway[J]. Ann Clin Lab Sci,2013,43(4):395-401.
[13]Simons M. An inside view:VEGF receptor trafficking and signaling[J]. Physiology(Bethesda),2012,27(4):213-222.
[14]Kim HY,Park SY,Lee SW,et al. Inhibition of HMGB1-induced angiogenesis by cilostazol via SIRT1 activation in synovial fibroblasts from rheumatoid arthritis[J]. Plos One,2014,9(8):e104743.
(本文编辑:赵丽洁)
[中图分类号]R331.3
[文献标志码]B
[文章编号]1007-3205(2016)03-0340-03
[作者简介]李晓坤(1991-),女,河北平山人,河北医科大学基础医学院医学硕士研究生,从事血管生物学研究。*通讯作者。E-mail:hanmei@hebmu.edu.cn
[基金项目]国家自然科学基金(91439114,31471092,31271222)
[收稿日期]2015-12-23;[修回日期]2016-02-01

