基于Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极的电化学发光分析法测定脯氨酸
高红方,王玉凤,漆红兰
(陕西省生命分析化学重点实验室,陕西师范大学化学化工学院,陕西西安710062)
基于Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极的电化学发光分析法测定脯氨酸
高红方,王玉凤,漆红兰*
(陕西省生命分析化学重点实验室,陕西师范大学化学化工学院,陕西西安710062)
利用滴涂法和静电吸附作用制备了Ru(bpy)32+/AuNPs/Nafion修饰的玻碳电极,基于脯氨酸对Ru(bpy)32+电化学发光的信号增强作用,建立了测定脯氨酸的电化学发光分析新方法。实验结果表明,在pH9.5的碳酸盐介质中,电化学发光强度与脯氨酸浓度在2.0×10-10~1.0×10-8mol/L范围内呈良好的线性关系,检出限为3.7×10-11mol/L(S/N=3)。
电化学发光;脯氨酸;Ru(bpy)32+;修饰电极
0 引言
脯氨酸 (proline,Pro)是一种氨基酸类药物,研究表明人体体液中Pro含量变化与多种疾病如骨病[1]、癌症[2-3]、慢性尿毒症[4]等有关。建立灵敏、快速检测脯氨酸的分析方法具有重要意义。文献报道的测定Pro的方法有质谱法[5]、液相色谱法[6]、化学发光法[7]等。这些方法有些操作复杂,有些灵敏度不高。电化学发光分析方法具有操作简单,灵敏度高,检测速度快等优点[8]。在前期工作[9]的基础上,以玻碳电极作为基底电极,利用滴涂法和静电吸附作用制备了Ru(bpy)32+/ AuNPs/Nafion/GCE修饰电极。基于Pro对Ru(bpy)32+电化学发光行为的增强作用,建立简单、灵敏的检测脯氨酸的电化学发光分析方法。
1 实验部分
1.1 试剂和仪器
氯化三(2,2'-联吡啶)钌(II)六水合物(Ru(bpy)3Cl2,Ru(bpy)32+)、Nafion(perfluoinated ionexchange resin)和脯氨酸 (Pro)均购自Sigma-Aldrich;氯金酸、柠檬酸钠、铁氰化钾、碳酸钠、碳酸氢钠和氯化钾均购自国药集团化学试剂有限公司。 实验所用溶液均用Millipore Milli Q water (<18 M/cm)水配制。
CHI 600B电化学工作站 (上海辰华仪器公司,上海,中国);发光测量系统为MPI-E型电致化学发光分析系统(西安迈瑞分析仪器有限公司,中国),超声波清洗器 (昆山市超声仪器有限公司)。三电极系统包括玻碳电极(Φ=2 mm)或者修饰电极为工作电极,铂片电极为对电极,Ag/AgCl电极为参比电极。
1.2 修饰电极的制备和电化学发光测量脯氨酸
Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极制备参考文献[9]。在1 mL含不同浓度脯氨酸的0.1 mol/L碳酸盐缓冲溶液(pH=9.5)中,利用线性单扫描伏安法,以扫描速率0.05 V/s在0~1.4 V电位范围内扫描,记录电化学发光-电位曲线;或者利用阶跃脉冲技术,初始电压为0 V,最高电压为1.10 V,脉冲时间为30 s,记录电化学发光-时间曲线。 光电倍增管(PMT)负高压设置为600 V。以电化学发光强度为分析信号,进行脯氨酸的检测。
2 结果与讨论
2.1 Pro增强Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极的电化学发光行为
根据文献[9],利用滴涂法和静电吸附作用制备了Ru(bpy)32+/AuNPs/Nafion修饰的玻碳电极。制备的金纳米粒子的透射电镜图如图1所示。从电镜可以观察到,金纳米粒子表面光滑,分布均匀,粒径在12 nm左右。

图1 金纳米粒子的电镜图Fig.1 TEM image of AuNPs
图2为Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极在含有 8.0×10-10mol/L Pro的0.1 mol/L碳酸盐缓冲液中的电化学发光-电位曲线图。从图2可以看出,在没有Pro的缓冲溶液中,Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极在 1.1 V左右产生弱的电化学发光信号(1241);加入8.0×10-10mol/L Pro后,在1.1 V处的电化学发光强度增加到4263。说明 Pro在碱性介质中能够增强Ru(bpy)32+的电化学发光,可用于测定Pro。
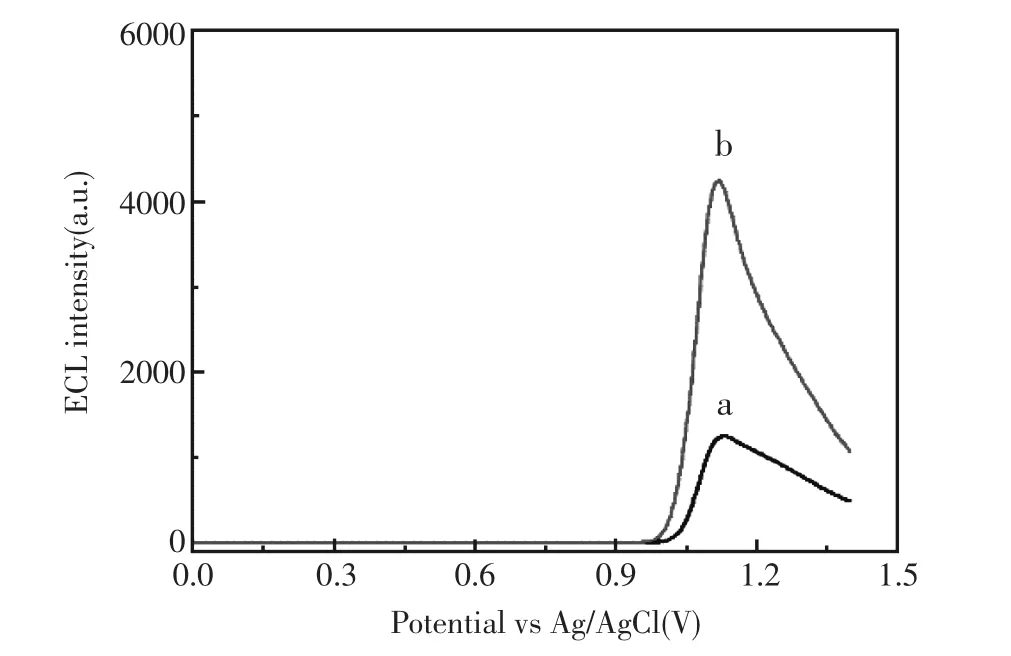
图2 Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极在0.1 mol/L碳酸盐缓冲液(pH=9.5)溶液(a)和含8.0×10-10mol/L Pro的0.1 mol/L碳酸盐缓冲液(pH=9.5)中的电化学发光-电位曲线图(b)Fig.2 ECL intensity-potential profiles obtained at Ru (bpy)32+/AuNPs/Nafion/GCE electrode in 0.1 mol/L carbonate buffer(pH9.5)(a)and 0.1 mol/L carbonate buffer (pH9.5)containing 8.0×10-10mol/L Pro
2.2 条件优化
实验中首先考察电位和溶液pH对电化学发光强度的影响,结果如图3和4所示。从图3可以看出,在1.0 V~1.1V之间增加施加电压,电化学发光信号随之增强;当电压大于1.1 V后,电化学发光强度趋于平稳,实验选择施加电位为1.1 V。
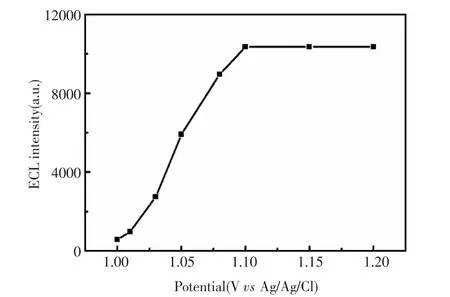
图3 施加电压对电化学发光强度的影响曲线Fig.3 The dependence of ECL intensity of Ru(bpy)32+/ AuNPs/Nafion/GCE on applied potential for the detection of 5×10-9mol/L Pro
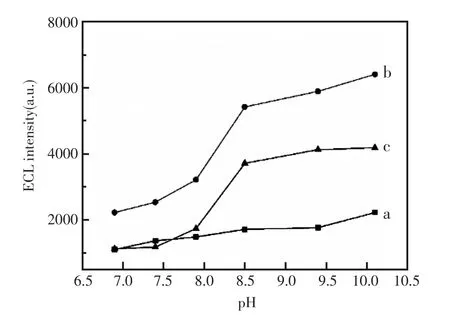
图4 pH对电化学发光强度的影响曲线Fig.4 The dependence of ECL intensity of Ru(bpy)32+/ AuNPs/Nafion/GCE on pH.I0is the ECL peak in the absence of Pro(a),ISis the ECL peak in the presence of 1×10-9mol/L Pro(b),(c)ΔI=IS-I0
根据相关文献的报道[10],缓冲溶液的pH对电化学发光检测过程有着重要影响。为获得最佳检测效果,该研究也对pH进行优化。在pH6.9~ pH10.1范围内,在选定的电位下,考察介质pH对5×10-9mol/L脯氨酸-Ru(bpy)32+电化学发光强度的影响。实验结果如图4所示。结果表明,在pH6.9~pH9.4范围内脯氨酸-Ru(bpy)32+的电化学发光强度随pH增大而增大,在pH9.4~pH10.1范围内脯氨酸Ru(bpy)32+的电化学发光强度基本不随pH的变化而变化。因此,实验选择pH=9.5的0.1 mol/L碳酸盐缓冲液为测定的缓冲条件。
2.3 工作曲线与检出限
在优化的实验条件下,采用阶跃脉冲技术对脯氨酸进行测定。图5为修饰电极在不同浓度Pro中的电化学发光-时间曲线。从图5可以看出,随着加入Pro浓度的增加,修饰电极的电化学发光强度随之增加;电化学发光强度的变化值ΔI与脯氨酸的浓度在2.0×10-10~1.0×10-8mol/L范围内呈现良好的线性关系(如图5内插图)。线性回归方程为ΔI=1247c+2779(c的单位为nmol/L,相关系数r=0.9939)。脯氨酸的检出限为3.7×10-11mol/L(S/N=3)。该Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极可以通过电化学发光强度的变化实现对脯氨酸的灵敏检测。
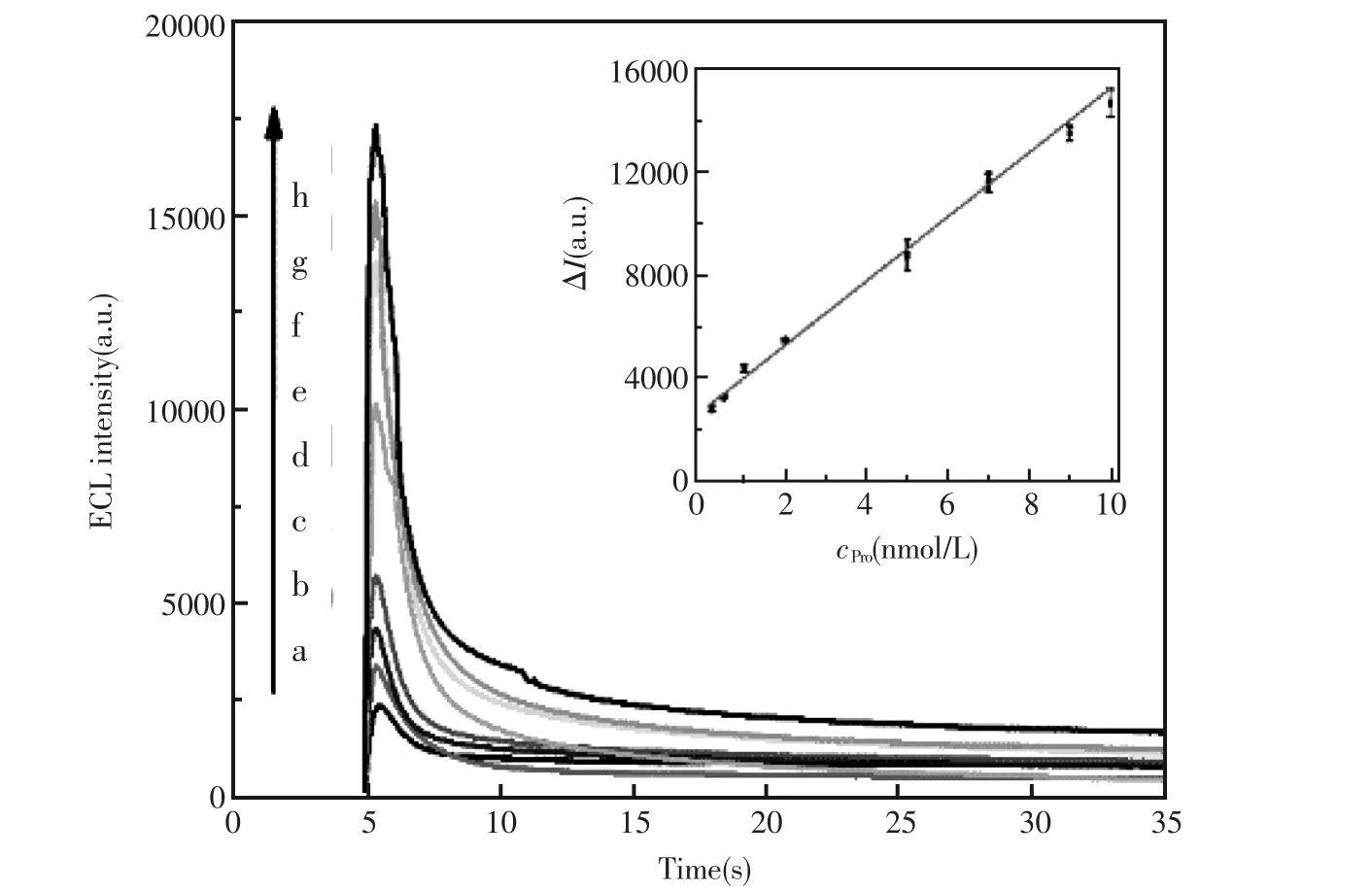
图5 Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极在不同浓度Pro中的电化学发光-时间曲线内插图:脯氨酸的校准曲线Fig.5 ECL intensity vs time profiles of the Ru(bpy)32+/AuNPs/Nafion/GCE for different concentrations of Pro.Insert, the calibration curve of Pro.Concentrations of Pro:2.0×10-10mol/L(a),5.0×10-10mol/L(b),1.0×10-9mol/L(c), 2.0×10-9mol/L(d),5.0×10-9mol/L(e),7.0×10-9mol/L(f),9.0×10-9mol/L(g)and 1.0×10-8mol/L(h)
3 结论
基于脯氨酸对Ru(bpy)32+电化学发光强度的增强作用,利用Ru(bpy)32+/AuNPs/Nafion/GCE修饰电极,建立了一种高灵敏检测脯氨酸的电化学发光分析新方法。实验结果表明,该方法测定脯氨酸具有较高的灵敏度和较低的检出限。
[1]Smith R.Collagen and disorders of bone[J].Clin.Sci., 1980,59:215-223.
[2]Powles T J,Rosset G,Leese C L,et al.Early morning hydroxyproline excretion in patients with breast cancer[J]. Cancer,1976,38:2564-2566.
[3]Gasser A B,Depierre D,Courvoisier B,et al.Total urinary and free serum hydroxyproline in metastatic bone disease[J].Br.J.Cancer,1979,39:280-283.
[4]Inoue H,Kohashi K,Tsuruta Y,et al.Simultaneous determination of serum and urinary hydroxyproline and proline by liquid chromatography using two fluorescent labeling reagents[J].Analytica Chimica Acta,1998, 365:219-226.
[5]Goshe M B,Anderson V E.Determination of amino acid isotope ratios by electrospray ionization-mass spectrometry[J].Anal.Biochem.,1995,231(2):387-392.
[6]Harada M.High performance liquid chromatographic determination of peptidase activity toward proline-containing peptides[J].Anal.Chim.Acta,1997,352 (1-3): 179-185.
[7]Costin J W,Barnett N W,Lewis SW,et al.Determination of proline in wine using flow injection analysis with tris (2,2-bipyridyl)ruthenium(II)chemiluminescence detection[J].Talanta,2004,64:894-898.
[8]Miao W J.Electrogenerated chemiluminescence and its biorelated applications[J].Chem.Rev.,2008,108: 2506-2553.
[9]Qi H L,Li M,Dong M M,et al.Electrogenerated chemiluminescence peptide-based biosensor for the determination of prostate-specific antigen based on target induced cleavage of peptide[J].Anal.Chem.,2014,86: 1372-1379.
[10]Rubinstein I,Bard A J.Electrogenerated chemiluminescence.37.aqueous ecl systems based on Ru(2,2’-bipyridine)32+and oxalate or organic acids[J].J.Am. Chem.Soc.,1981,103:512-516.
Electrogenerated chemiluminescence determination of proline using Ru(bpy)32+/AuNPs/Nafion modified electrode
Gao Hong-fang,Wang Yu-feng,Qi Hong-lan*
(School of Chemistry and Chemical Engineering,Shaanxi Normal University,Xi’an 710062,China)
The Ru(bpy)32+/AuNPs/Nafion/GCE modified electrode was fabricated and applied to detect proline by electrogenerated chemiluminescence (ECL)method.A sensitive ECL method was developed for determination of proline in the linear range of 2.0×10-10~1.0×10-8mol/L in pH9.5 carbonate buffer solution.The detection limit was 3.7×10-11mol/L.
ECL;proline;Ru(bpy)32+;modified electrode
国家自然科学基金资助(No 21375084)
*通信联系人,E-mail:honglanqi@snnu.edu.cn

