玛咖多糖提取工艺的优化及其抗氧化活性
郑朋朋,李 珊,戚丽蓉,敖新宇
(西南林业大学生命科学学院,云南昆明650224)
玛咖多糖提取工艺的优化及其抗氧化活性
郑朋朋,李 珊,戚丽蓉,敖新宇*
(西南林业大学生命科学学院,云南昆明650224)
为了更好地开发和利用云南地区的功能食品玛咖,选取玛咖多糖作为研究对象,在单因素试验基础上设置响应面优化试验对玛咖多糖提取工艺进行优化以提高玛咖多糖提取效率,并测定玛咖多糖的抗氧化性强弱,评价玛咖多糖的活性价值;采用Sephadex G-100凝胶层析纯化玛咖多糖,用去离子水进行洗脱(洗脱速度为1mL/min),通过多糖对羟自由基、DPPH自由基、ABTS自由基的清除效率研究玛咖多糖的抗氧化性作用。结果表明:在液料比59mL/g、浸提温度82℃、提取时间157min的条件下,玛咖多糖的提取率为9.60%。对纯度为65.6%的玛咖粗多糖进行纯化,得到纯度为90.7%的纯化多糖。当粗多糖和纯多糖浓度为6mg/mL时,对羟自由基和DPPH自由基的清除率达到最大,分别为63.9%、46.5%和72.8%、81.7%;粗多糖浓度为5mg/mL时,对ABTS自由基清除率达到最大,为61.4%;纯多糖浓度为8mg/mL时,对ABTS自由基的清除率最大,为83.8%。
玛咖多糖;响应面;Sephadex G-100凝胶层析;抗氧化性
玛咖(Maca)为十字花(Cnlcifera)科独行菜属(Lepidium L)草本植物,原生长于秘鲁海拔4 000~4 500m的安第斯山脉。在该地区,玛咖作为药食兼用的植物已有悠久的历史。大量研究表明,玛咖具有抗疲劳、抗氧化、改善性功能、减少前列腺增生、缓解更年期综合症、抑制癌细胞、增加骨密度等多种功效。玛咖除含有丰富蛋白及微量元素等营养成分,还含有多种次生代谢物质,如玛咖烯、生物碱、芥子油苷及其水解衍生物、甾醇、多酚等,这些次生代谢物质被认为与玛咖的保健功效有着密切关系。因玛咖独特全面的功效,已受到世界保健食品行业的广泛关注[1-3]。
多糖是由10个以上单糖通过糖苷键连接而成的聚糖,在自然界分布极广,在植物、动物和微生物体内均有存在,是自然界含量最丰富的生物聚合物。由于多糖多种多样的生物活性功能以及在功能性食品和临床上的广泛应用,使多糖生物资源的开发利用和研究日益活跃,成为食品科学、天然药物、生物化学和生命科学研究的热点。
由于云南省高寒山区独特的区域优势,在丽江市古城区、玉龙县和曲靖市会泽县等高寒冷凉山区开展了玛咖人工驯化栽培与种植,截至2010年云南省玛咖种植面积达175hm2,玛咖产量780t,分别占全国玛咖种植面积、产量的90%和93%,成为全国最大的玛咖生产基地,对中国玛咖生产起着举足轻重的作用[4-7]。通过查阅数据库,已有玛咖多糖提取与生物活性的报道,其中玛咖多糖提取工艺方法均为正交试验,未有响应面优化玛咖提取工艺的报道,响应面法是非常有效的优化提取方法,与正交试验相比响应面优化试验优化出的提取条件更准确,溶剂消耗更少,时间更加合理,提取稳定性好,已经广泛应用于植物物质提取工艺的优化过程;抗氧化剂体外抗氧化活性的强弱是抗氧化剂的重要指标,并且体外抗氧化活性对体内活性有指导意义,对多糖的抗氧化性测定的方法多为清除羟自由基、清除氧负自由基和还原力等试验,现在国际上比较公认的体外抗氧化性试验为清除DPPH和ABTS自由基试验[8-11]。因此,笔者针对玛咖多糖的提取工艺条件进行响应面优化,采用凝胶层析进行多糖纯化,并通过体外清除DPPH和ABTS自由和羟自由基试验进一步研究玛咖多糖的抗氧化性作用,旨在更好地开发和利用云南地区的功能食品玛咖。
1材料与方法
1.1材料
玛咖块根:生产于云南省丽江市。
试剂:1,1-二苯基-2-三硝基苯肼(DPPH自由基,Sigma公司),2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,Sigma公司);过硫酸钾、30%双氧水、甲醇、乙醇、氯仿、正丁醇、浓硫酸、苯酚、葡萄糖、水杨酸、硫酸亚铁、磷酸氢二钠、磷酸二氢钠(AR,国药集团化学试剂有限公司)
仪器:电热恒温鼓风干燥箱(DHG-9240A型,上海一恒科学仪器有限公司),电子天平(BS224S,SARTORIUS公司),粉碎机(M20,KIKA-WERKE公司),80目筛子、真空旋转蒸发仪(B490,BUCHI公司),冷冻干燥器(FD5-8,GOLD SIM公司),真空干燥箱(DZF-6030A,上海一恒科学仪器有限公司),紫外分光光度计(TU-1901,北京普析通用仪器有限责任公司),离心机(5430R,Eppendorf),水浴锅(HWS-12,上海一恒科学仪器有限公司)。
1.2多糖的提取与测定
称取1.0g样品,置于50mL离心管中,按照液料比30mL/g、超声时间10min、浸提温度70℃、提取时间120min的条件水浴浸提;浸提完成后6 000r/min离心10min,将上清液转移到250mL烧杯中,加一定量无水乙醇使乙醇的体积分数为80%,静置沉淀12h;6 000r/min离心15min、收集多糖沉淀,将沉淀复溶于水中,用Sevag法除蛋白后,冷冻干燥后溶解并定容到100mL待测。
葡萄糖标准曲线绘制:准确称取105℃恒重的葡萄糖10.0mg,溶解后定容到100mL,配成100μg/mL葡萄糖标准溶液;精确量取100μg/mL的葡萄糖标准溶液0mL、0.2mL、0.4mL、0.6mL、0.8mL和1.0mL,补水至1.0mL,分别制成0μg/mL、20μg/mL、40μg/mL、60μg/mL、80μg/mL和100μg/mL待测标准溶液,加4%苯酚1.0mL、浓硫酸5.0mL,待冷却后,在490nm波长条件下测定吸光值,以浓度为横坐标,吸光值为纵坐标做标准曲线。
多糖测定:将待测液稀释10倍后,取1.0mL,加4%苯酚1.0mL、浓硫酸5.0mL,放入水槽中冷却10min,待冷却后,在490nm波长条件下测定吸光值,多糖含量按照(1)式计算。
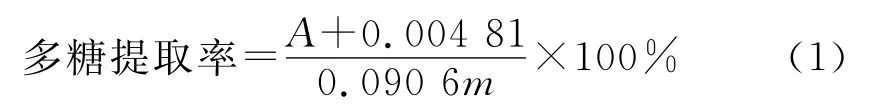
式中:A为样品待测液的吸光值;m为样品的质量。
1.3不同因素的考察
液料比:分别在液料比20mL/g、30mL/g、40mL/g、50mL/g、60mL/g和70mL/g,浸提温度70℃,提取时间120min,醇析浓度75%条件下提取,并测定多糖提取率(下同)。
浸提温度:分别在浸提温度40℃、50℃、60℃、70℃、80℃和90℃,液料比60mL/g,提取时间120min,醇析浓度75%条件下提取。
提取时间:分别在提取时间30min、60min、90min、120min、150min和180min,液料比60mL/g,提取温度80℃,醇析浓度75%条件下提取。
1.4响应面试验设计
根据单因素试验结果,采用Desigin-Expert 8.0.6软件中Box-Behnken中心组合设计原理,选取液料比、浸提温度和提取时间3个影响因素的最佳提取条件,采用3因素3水平的响应面分析方法,分别用A、B、C表示3个因素,并以-1、0、+1分别代表因素的水平,多糖提取率(%)为响应值。采用多元回归设计方法,拟合二次多项模型的Box-Behnken试验设计,响应面因素与水平设计见表1[12]。
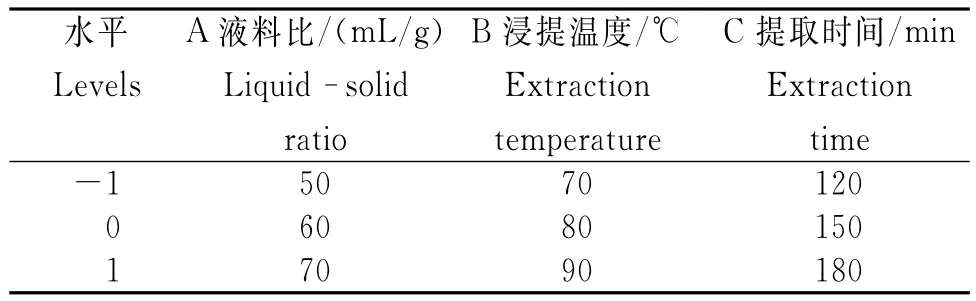
表1 玛咖多糖提取的响应面试验因素及水平Table 1 Factors and levels of the response surface test
1.5多糖纯化
将活化的Sephadex G-100装入2.6×50cm色谱层析柱,用去离子水平衡后准备上样。称取100mg粗多糖用10mL去离子水溶解后,6 000r/min离心10min,取上清液上样,上样浓度为10mg/mL。用去离子水进行洗脱,洗脱速度为1mL/min,每管收集5mL,隔管检测多糖含量(苯酚-硫酸法A490nm)。按多糖含量检测值分别合并收集单一峰组分,冷冻干燥。
1.6多糖抗氧化性的测定
羟自由基清除测定[13]:将样品(粗多糖和纯化多糖)用蒸馏水溶解后配制成质量浓度10mg/mL的溶液,并稀释成不同浓度梯度(1mg/mL,2mg/mL,3mg/mL,4mg/mL,5mg/mL,6mg/mL,7mg/mL,8mg/mL,9mg/mL,10mg/mL),在试管中依次加入9mmol/L FeSO4溶液1.0mL和9mmol/L水杨酸-乙醇溶液1.0mL和1.0mL样品溶液(VC溶液作参比,浓度为0.01~10mg/mL),最后加入8.8mmol/L H2O2溶液1.0mL启动反应。将试管迅速移入37℃水浴锅中,静置反应30min后于510nm处测定不同质量浓度样品液的吸光值。用蒸馏水代替H2O2测得对应质量浓度样品溶液的本底吸光值,用蒸馏水代替样品溶液测得对照吸光值。按式(2)计算样品对·OH的清除率。

式中:Ax为不同样品溶液吸光值,Ax0为样品本底吸光值,A0为对照溶液吸光值。
DPPH自由基清除测定[14]:将样品用蒸馏水溶解后配制成质量浓度10mg/mL的溶液,并稀释成不同浓度梯度(1mg/mL,2mg/mL,3mg/mL,4mg/mL,5mg/mL,6mg/mL,7mg/mL,8mg/mL,9mg/mL,10mg/mL),取1.0mL不同质量浓度的样品溶液(VC溶液作参比参比,浓度为0.01~10mg/mL)于试管中,分别加入4.0mL提前配制的DPPH溶液(0.023 7g DPPH,甲醇定容至1 000mL,浓度为6mmol/避光放置),振摇混匀后置于暗室中静置反应30min,于517nm处测定吸光值,1.0mL不同质量浓度的样品溶液与4.0mL甲醇混合液测定样品本底吸光值,4.0mL DPPH 与1.0mL甲醇混合液测定对照溶液吸光值,按式(3)计算DPPH自由基清除率。
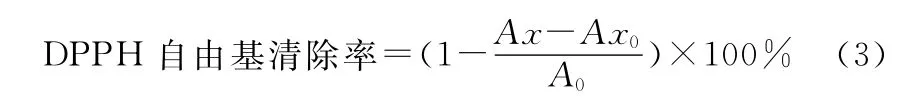
式中:Ax为不同样品溶液吸光值,Ax0为样品本底吸光值,A0为对照溶液吸光值。
ABTS自由基清除测定[15]:用去离子水将ABTS溶解,使ABTS浓度为7mmol/L,加入过硫酸钾使过硫酸钾的浓度为2.45mmol/L,然后,将该溶液在室温下避光反应12~16h。之后再将生成的ABTS+·溶液,用磷酸缓冲液(PBS,pH=7.4)稀释至适当浓度,使其在30℃、734nm波长条件下的吸光值为0.700±0.002,便得到ABTS自由基工作液。在试管中加入2.0mL不同质量浓度样品溶液(VC溶液作参比,浓度为0.01~10mg/mL),再加入2.0mL的ABTS自由基工作液,混合、摇匀,在室温下反应6min后,在734nm条件下测定其吸光值。用蒸馏水代替样品溶液作为空白对照,ABTS自由基清除率由下式计算:
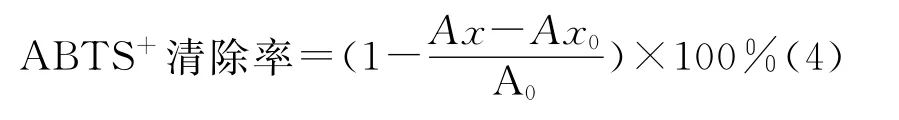
式中:Ax为不同样品溶液吸光值,Ax0为样品本底吸光值,A0为对照溶液吸光值。
2结果与分析
2.1多糖葡萄糖标准曲线
由Qrigin8.0对试验数据处理,得到标准曲线的线性回归方程:A=8.358 95C-0.004 81;R2=0.998,并做出葡萄糖标准曲线(图1)。
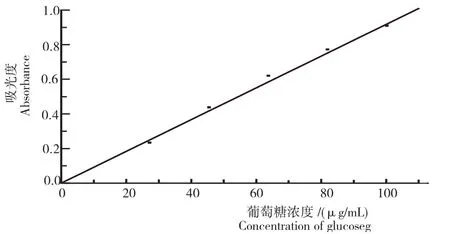
图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
2.2不同因素对玛咖多糖提取率的影响
2.2.1液料比 由图2可知,液料比在20~60mL/g时,玛咖多糖的提取率随着液料比的增加而逐渐增大,当液料比为60mL/g时,玛咖多糖的提取率达到最大值,液料比再增加,多糖提取率不再增加,表明最佳液料比为60mL/g附近。浸提多糖的过程,实际是多糖再固液两相的分配过程,溶剂确定的情况下,多糖的分配系数是一定的,可以通过增加提取溶剂的量而增大提取率,当溶剂量超过一定值后,会增加后续造作的难度,使多糖有所损失,从而导致实际提取率下降。
2.2.2浸提温度 由图2还可知,浸提温度在40~80℃时,浸提温度升高,玛咖多糖的提取率也随之增大,浸提温度为80℃时,玛咖多糖的提取率达到最大,继续升高浸提温度多糖提取率有所下降,表明最佳浸提温度为80℃附近。理论上,温度升高,提取率增大,这是因为温度越高,分子的热运动越剧烈,细胞越易破碎,从而使多糖进入水相增加提取率,当温度超过某一温度后,虽然增加了多糖的溶出,但可引起多糖与其他物质之间的有机反应,或者导致多糖裂解反应,使实际多糖提取率下降。
2.2.3提取时间 提取时间在30~150min时,提取时间增长,玛咖多糖的提取率也随之增大,提取时间为150min时,玛咖多糖的提取率达到最大,继续增加时间多糖提取率略有下降,表明最佳提取时间为150min附近(图2)。时间越长,提取率应不断增加,但由于液料比一定,提取一定时间后,体系会达到提取平衡,故提取率在平衡值附近波动,不再增加。
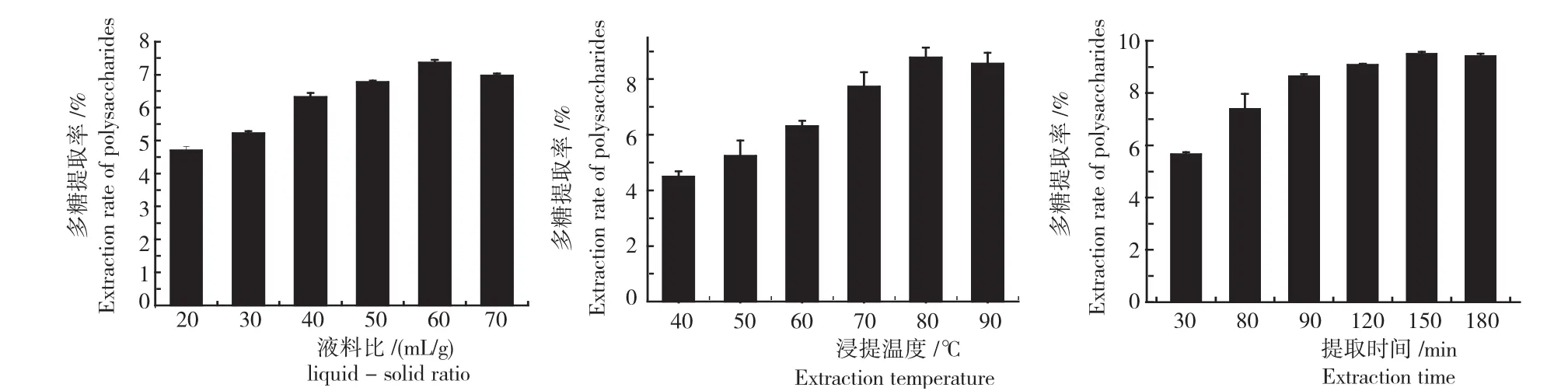
图2 不同液料比、浸提温度和提取时间的玛咖多糖提取率Fig.2 Effect of different liquid-solid ratio,temperature and time on Maca polysaccharide extraction rate
2.3响应面优化试验
2.3.1响应面优化结果 由表2可知响应面优化玛咖多糖提取的试验设计及各处理的提取率,采用经Design-Expert 8.0.6软件对表2试验结果进行多元回归拟合,建立二次多项式回归模型,对各因素进行二次多项式回归拟合后,得到二次多项式回归方程:
多糖提取率=9.59-0.023A+0.14B+0.038C-0.023AB-0.022AC+4.5×10-3BC-0.077A2-0.24B2-0.086C2。
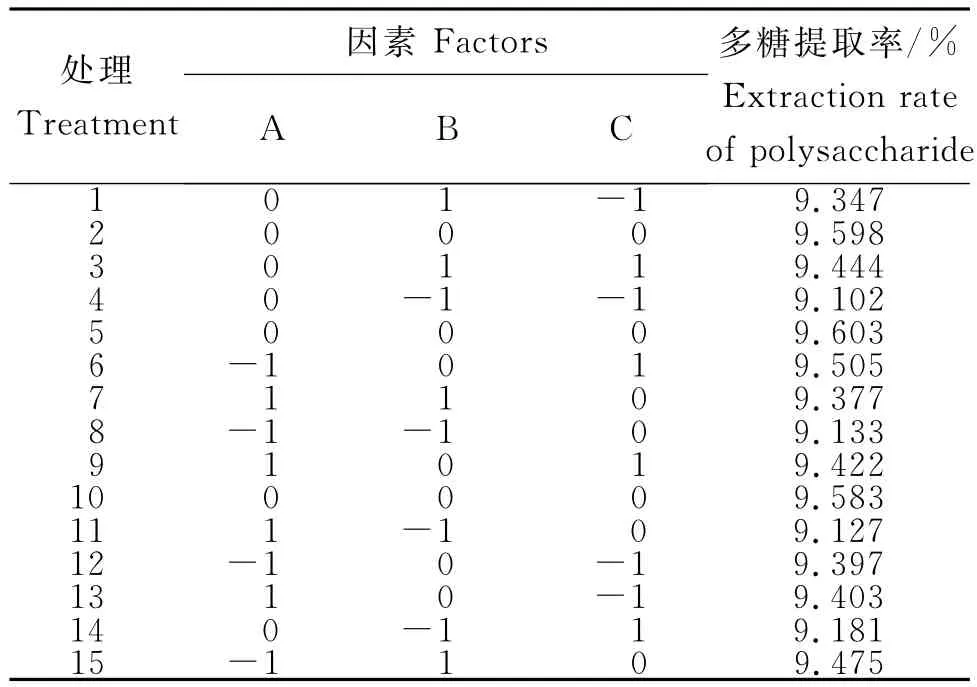
表2 响应面优化玛咖多糖提取的试验设计及结果Table 2 Design and results of response surface optimization for Maca polysaccharide extraction
对其进行方差分析可知,该回归模型达到极显著水平(P<0.01)。模型中的B、C、A2、B2、C2对响应值影响极显著(P<0.01),A、AB、AC对响应值影响显著(P<0.05),表明试验因素对响应值不是简单的线性关系。此模型的决定系数R2=0.989,说明响应值的变化有98.9%来源于所选变量,该方程与实际情况拟合良好,试验误差小,能够正确反映多糖提取率与液料比、浸提温度和提取时间之间的关系。失拟项P=0.21>0.05,差异不显著,表明建立的二次多项式回归模型能运用于玛咖多糖提取优化的理论预测。
2.3.2响应面分析 响应面图直观地反映各因素对响应值的影响,而存在极值的条件应在等势线图的圆心处。由图3~图5可以看出,液料比(A)与浸提温度(B)及液料比(A)与提取时间(C)之间的交互作用最为显著。液料比、浸提温度、提取时间对玛咖多糖提取的影响均极显著,表现为曲线较陡。
2.3.3最佳提取条件 选择合适的液料比、浸提温度、提取时间可获得较高的玛咖多糖的提取率,通过Design-Expert8.0.6软件分析,预测最佳提取条件为:液料比58.67mL/g,浸提温度82.22℃,提取时间156.67min,此条件下最大提取率达9.621%。考虑到实际操作的方便性,将各因素修正为液料比59mL/g、浸提温度82℃、提取时间157min,在修正条件下进行验证试验,玛咖多糖的提取率为9.60%,与理论预测值相符合。
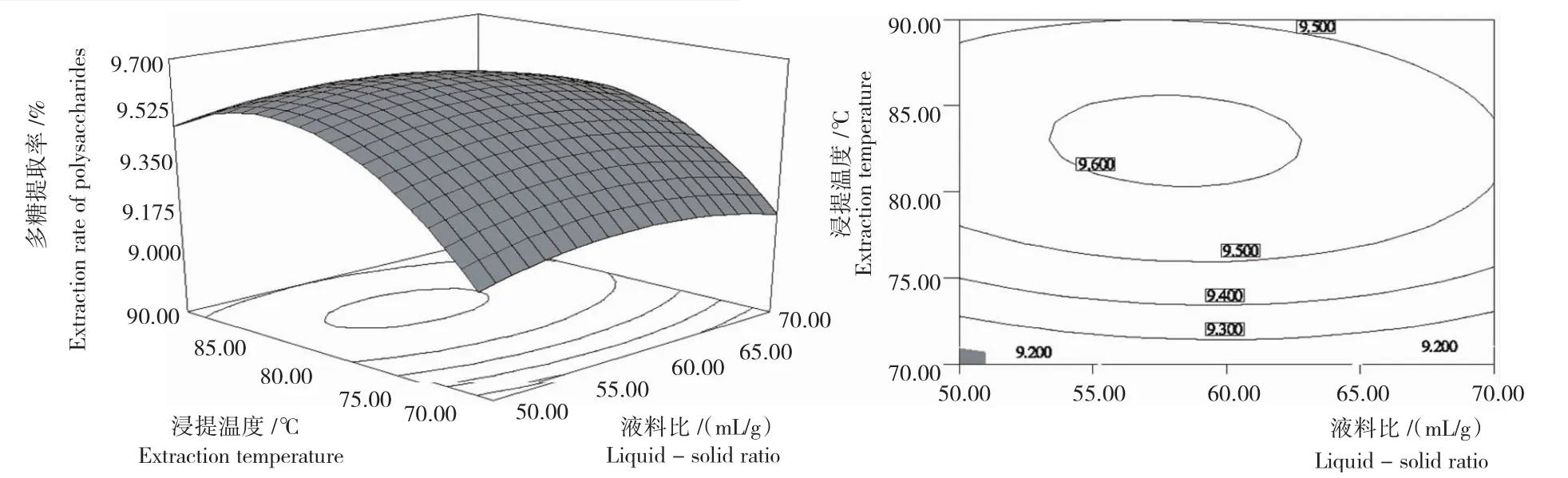
图3 液料比与浸提温度相互作用玛咖多糖的提取率Fig.3 Maca polysaccharide extraction rate under interaction between liquid-solid ratio and extraction temperature
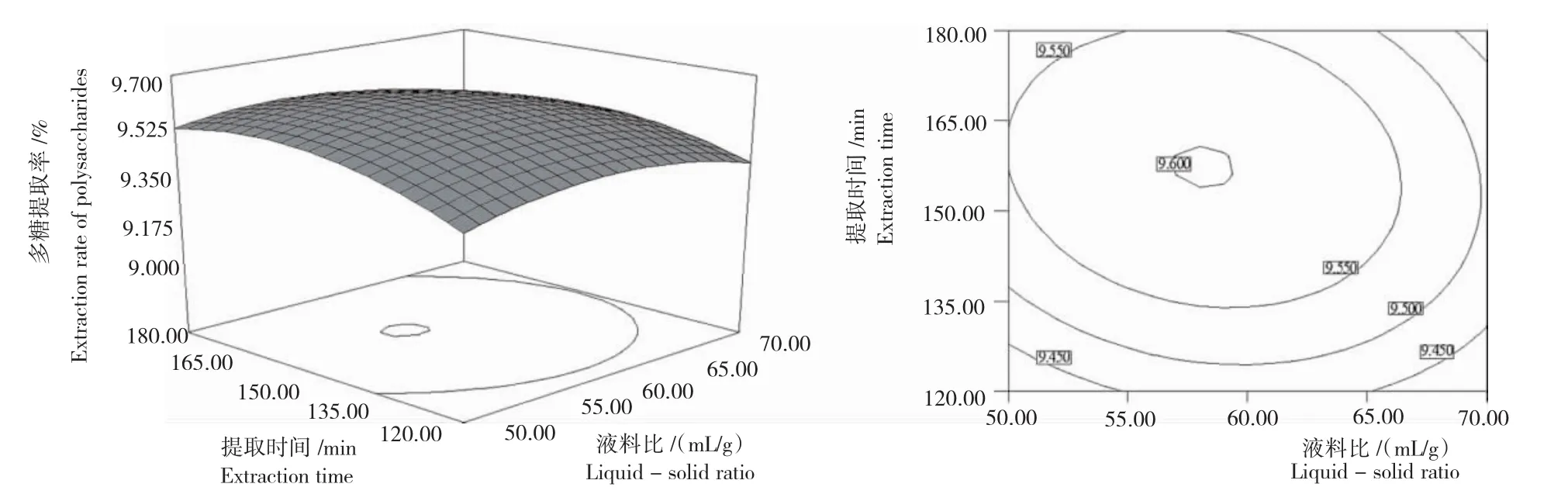
图4 液料比与提取时间相互作用玛咖多糖的提取率Fig.4 Maca polysaccharide extraction rate under interaction between liquid-solid ratio and extraction time
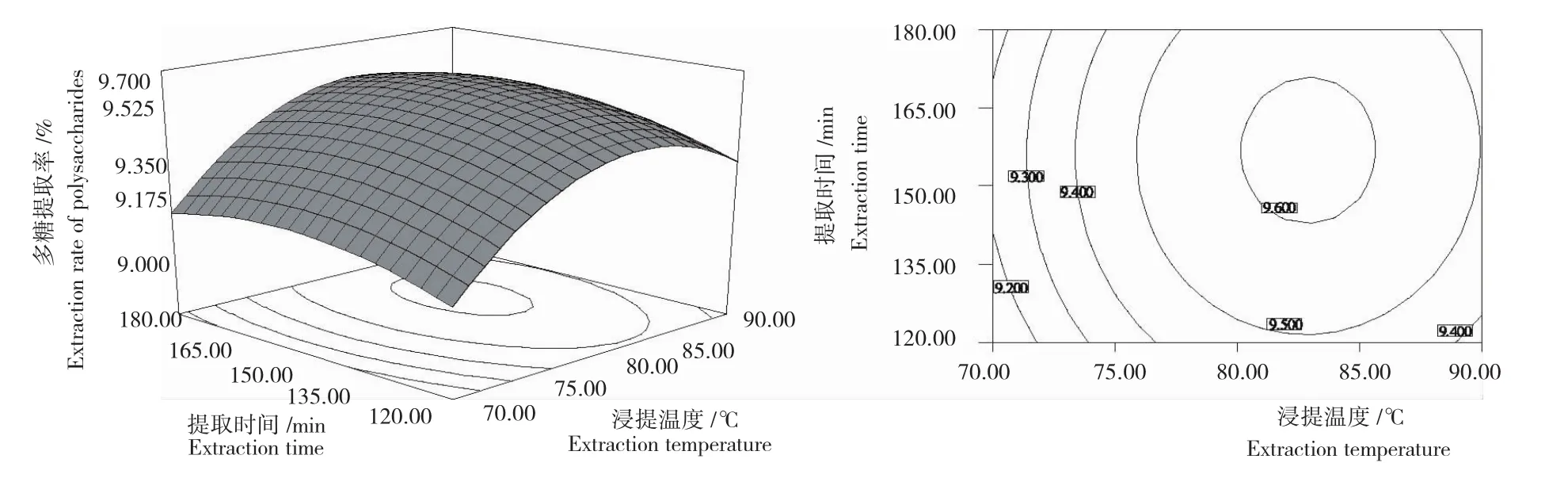
图5 浸提温度与提取时间相互作用玛咖多糖的提取率Fig.5 Maca polysaccharide extraction rate under interaction between extraction temperature and extraction time
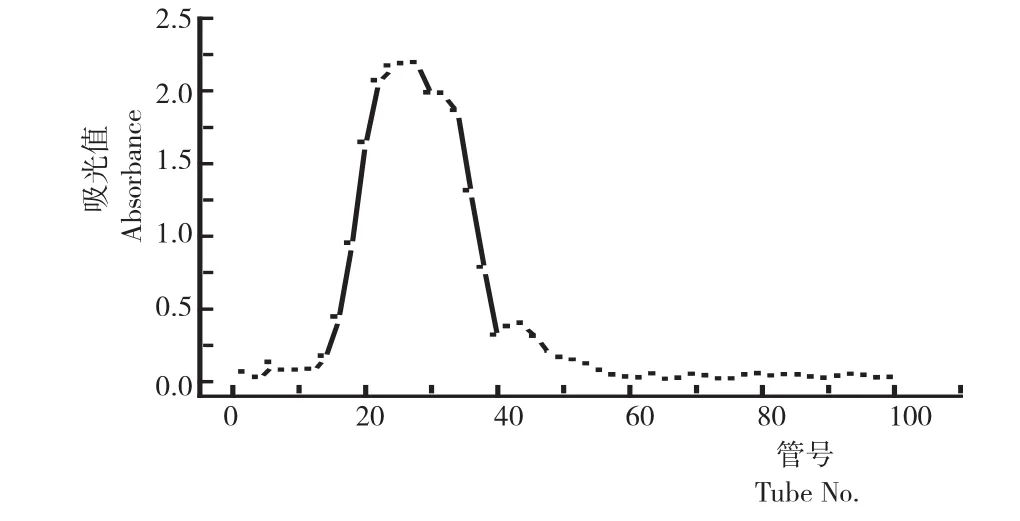
图6 玛咖多糖的洗脱曲线Fig.6 The elution curve of Maca polysaccharide
2.4多糖纯化
苯酚-硫酸法隔管检测各管多糖含量得到洗脱曲线。由图6可知,18管~40管出现单一峰,合并从18管~40管的洗脱液,预冷后进行冷冻干燥,得到纯化的玛咖多糖。进过层析纯化玛咖多糖的纯度由粗多糖的65.5%提高到纯多糖的90.7%。
2.5玛咖多糖的抗氧化性
2.5.1羟自由基的清除率 图7A可以看出,在试验质量浓度范围内,随着质量浓度的增加,玛咖多糖对·OH清除率呈逐渐上升趋势,在1~6mg/mL时粗多糖和纯多糖清除作用不断增加,6~10mg/mL时多糖清除作用趋于稳定,粗多糖与纯多糖清除作用相比,纯多糖的清除作用更强,最大的清除作用分别为63.9%和72.8%。VC在质量浓度0.002~0.010mg/mL时,随着质量浓度的增加,其对·OH清除率增加迅速,超过0.010mg/mL后,清除率基本没有变化,维持在87.6%。与VC相比较,玛咖多糖对·OH清除能力弱于VC。
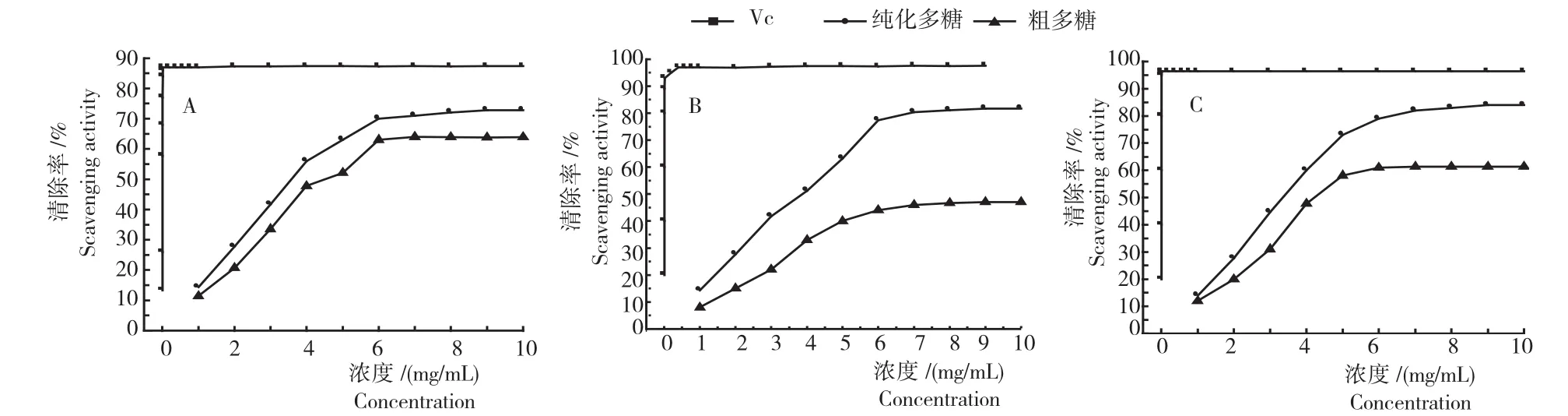
图7 玛咖多糖对羟自由基、DPPH和ABTS自由基的清除作用Fig.7 Scavenging effect of Maca polysaccharide to free radicals of hydroxyl,DPPH and ABTS
2.5.2PPH自由基清除率 图7B可以看出,在试验质量浓度范围内,随着质量浓度的增加,玛咖粗多糖和纯多糖对DPPH自由基清除率呈逐渐上升趋势,两者趋势基本一致,但是清除率均低于相同质量浓度条件下VC对DPPH自由基的清除率;在6mg/mL之后多糖清除效率趋于稳定,分别为81.7%和46.5%。VC在质量浓度0.002~0.020mg/mL时,随着质量浓度的增加,其对DPPH自由基清除率增加迅速,超过0.020mg/mL后,清除率变化不大,维持在97%左右。与相同质量浓度的VC相比,玛咖粗多糖和纯多糖对DPPH自由基的清除率低于VC。
2.5.3ABTS自由基清除率 从图7C可以看出,随着质量浓度的增加,玛咖多糖对ABTS自由基清除率呈逐渐上升趋势,粗多糖在5mg/mL之后清除作用趋于稳定,清除率为61.4%;纯多糖在8mg/mL之后趋于稳定,清除率为83.8%;VC在质量浓度0.002~0.010mg/mL时,随着质量浓度的增加,其对ABTS自由基清除率增加迅速,超过0.010mg/mL后,清除率基本没有变化,维持在96.4%左右。相比VC,玛咖多糖对ABTS自由基清除率要低于VC。
3结论与讨论
在单因素试验的基础上,运用响应面优化试验对玛咖多糖提取工艺进行优化,获得最佳提取条件,结果表明,液料比、浸提温度、提取时间对玛咖多糖提取影响显著,对提取过程的影响不是简单的线性关系,由此建立的回归模型拟合程度良好,预测最佳提取条件为液料比58.67mL/g、浸提温度82.22℃、提取时间156.67min,此条件下最大提取率达9.621%。考虑到实际操作的方便性,将各因素修正为液料比59mL/g、浸提温度82℃、提取时间157min,在修正条件下进行验证试验,玛咖多糖的提取率为9.60%,与理论预测值相符合,因此采用响应面法优化得到的浸提条件参数准确可靠,具有实用价值;Sephadex G-100凝胶层析纯化玛咖多糖得到一种纯化玛咖多糖;通过清除自由基试验评价玛咖多糖的抗氧化能力表明,玛咖纯多糖对3种自由基的清除效率均大于玛咖粗多糖,纯多糖对羟自由基、DPPH自由基和ABTS自由基的最大清除效率为72.8%、81.7%和83.8%;虽然与VC相比玛咖多糖抗氧化性要弱,但是玛咖多糖,尤其是纯多糖的抗氧化能力较强,因此玛咖具有较好的使用价值,纯化玛咖多糖可以进行进一步研究和开发,以期成为功能性食品和药物。
[1]尹子娟,杨成金,尹品耀,等.玛咖的营养成分及功效研究进展[J].云南农业科技,2012(5):61-64.
[2]甘 瑾,冯 颖,张 弘.三种色型玛咖芥子油苷组分及含量分析[J].中国农业科学,2012,45(7):1365-1371.
[3]王 未,毛日文,赵 婷,等.玛咖营养成分分析[J].江苏农业科学,2013,41(4):285-286.
[4]杨少华,李国政,薛润光,等.云南玛咖产业发展现状及促进对策分析[J].世界科学技术:中医药现代化,2012,14(4):1921-1925.
[5]胡 强,康平德,杨少华.云南玛咖种子产业化发展的现状、优势与对策[J].种子,2013,32(1):59-62.
[6]李 磊.玛咖的食品营养与安全评价及开发前景[J].食品工业科技,2012,33(5):376-379.
[7]牛晓云.玛咖高产栽培技术[J].云南农业科技,2012 (2):32-32.
[8]孙晓东,唐 辉,杜 萍,等.丽江玛咖的营养成分分析及多糖体外的抗氧化作用[J].光谱实验室,2013,30(5):2365-2371.
[9]郝利民,张建春,鲁吉珂.云南种植玛咖中多糖提取工艺的优化研究[J].食品工业科技,2013,34(3):262-264.
[10]陈燕青,郑 静,陆海翔.羧甲基玛咖多糖制备及抗氧化性研究[J].中国食品添加剂,2010(2):94-96.
[11]浦跃武.超声波提取玛咖多糖的工艺研究[J].食品科技,2010(3):174-177.
[12]赵 鹏.响应面法优化金银花多糖羧甲基化工艺及抗氧化性研究[J].天然产物研究与开发,2015,27(1):114-119.
[13]胡位荣,孙 茹,李昭露,等.霸王花水溶性多糖提取工艺及其对羟自由基的清除作用[J].食品科学,2013,34(14):104-107.
[14]王倩倩,杨晓艳,马 骥.荚果蕨多糖的组成分析及其抗氧化活性[J].光谱实验室,2013,30(4):1647-1651.
[15]白海娜,王振宇,刘瑞海,等.白藜芦醇与黑木耳多糖协同清除ABTS自由基活性的研究[J].现代食品科技,2014,30(3):64-68.
(责任编辑:孙小岚)
Optimization of Polysaccharide Extraction Technology from Maca and Its Antioxidant Activity
ZHENG Pengpeng,LI Shan,QI Lirong,AO Xinyu1*
(College of Life Science,Southwest Forestry University,Kunming,Yunnan 650224,China)
The polysaccharide extraction technology from Maca was optimized by the response surface optimization test based on the results of single-factor test to improve the extraction rate of Maca polysaccharide.Maca polysaccharide was purified by Sephadex G-100gel chromatography under the condition of 1mL/min elution speed.The antioxidant activity of Maca polysaccharide was determined by studying the scavenging effect of Maca polysaccharide on hydroxyl radical,DPPH radical and ABTS radical to further develop and utilize functional food Maca in Yunnan.Results:The polysaccharide extraction rate can reach 9.60%under the extraction conditions of 59mL/g liquid/solid ratio,82℃and 157min.The polysaccharide with 90.7%purity can be purified from crude polysaccharide with 65.6%purity.The highest scavenging rate of crude polysaccharide with 6mg/mL concentration and purified polysaccharide with 6mg/mL concentration to hydroxyl radical and DPPH radical is 63.9%,72.8%,and 46.5%,81.7% separately.The highest scavenging rate of crude polysaccharide with 5mg/mL concentration and purified polysaccharide with 8mg/mL concentration to ABTS radical is 61.4%and 83.8%respectively.
Maca polysaccharide;response surface;Sephadex G-100gel chromatography;antioxidant activity
Q539
A
1001-3601(2016)02-0085-0143-06
2015-05-18;2015-12-30修回
云南省优势特色重点学科生物学一级学科建设项目(50097505)
郑朋朋(1990-),男,在读硕士,研究方向:生物化学与分子生物学。E-mail:zhengpp12@163.com
*通讯作者:敖新宇(1978-),男,副教授,从事生物化学与分子生物学研究。E-mail:54700875@qq.com

