去卵巢合并单侧输尿管结扎诱导小鼠肾脏病变的研究
李晓莉, 李晓敏, 刘金鑫, 杨久琳, 张 岩
(上海理工大学 系统生物医学研究中心,上海 200093)
去卵巢合并单侧输尿管结扎诱导小鼠肾脏病变的研究
李晓莉,李晓敏,刘金鑫,杨久琳,张岩
(上海理工大学 系统生物医学研究中心,上海200093)
摘要:为研究去卵巢合并单侧输尿管结扎引起小鼠肾脏的病理变化及可能机制,选取C57BL/6J雌性小鼠为研究对象,分别设立对照组和模型组.手术3周后,取肾脏样本.使用H&E,Masson’s Trichrome两种方法进行肾石蜡切片染色,通过RT-PCR技术检测肾纤维化相关因子TGF-β,CTGF,VEGF,fibronectin,炎症因子MCP-1,RANTES,肾素-血管紧张素系统(RAS)组分肾素(renin)、肾素受体(renin receptor)、血管紧张素原(AGT)的mRNA表达.结果显示,模型组小鼠肾小球萎缩,肾小管腔隙体积增加、膨大,肾小管间质纤维化.模型组小鼠肾脏fibronectin,MCP-1,RANTES的mRNA表达都显著上调,RAS组分renin receptor的基因表达显著上调.研究表明,去卵巢合并单侧输尿管结扎通过上调肾脏肾素受体表达,诱发肾脏纤维化与炎症反应.
关键词:去卵巢; 单侧输尿管结扎; 肾脏
单侧输尿管结扎作为诱导梗阻性肾病的研究方法在雄性小鼠中已得到广泛应用[1-3].最近的实验数据显示,雌激素具有重要的保护肾功能的作用[4],雌激素代谢系统紊乱易引起女性患慢性肾脏病[5].雌激素受体基因敲除小鼠生长到9月龄时即发生肾小球纤维化,而雌激素类似物17β-雌二醇通过作用于细胞外信号,调节激酶(ERK)信号通路抑制由TGF-β或TNF-α刺激的肾小球足细胞损伤与凋亡[6],选择性雌激素受体调节剂Raloxifene显示较好的肾保护作用[7].以上研究都表明雌激素具有重要的调控肾组织形态、生理功能的作用.
中老年妇女由于绝经后体内雌激素水平显著下降,导致患有慢性肾脏病的风险提高.本文通过建立雌激素缺乏状态下行单侧输尿管结扎术,引起小鼠肾脏的病理变化,并对其可能机制进行初步探索.对该问题的研究与阐述,有助于认识绝经后妇女发生慢性肾脏病的组织病变特征,同时,对于相关药物研发提供了潜在的实验动物模型.
1材料与方法
1.1试剂与仪器
1.1.1试剂
H&E试剂从上海太阳生物技术有限公司购得.Masson三色染色试剂盒从南京森贝伽生物科技有限公司购得.引物均由上海赛百盛基因技术有限公司合成.去除植物雌激素的动物饲料AIN-93M由美国Research Diets公司制备与提供.RNA抽提试剂Trizol、M-MLV反转录酶由美国Invitrogen公司购得,其他RT-PCR试剂从Fermentas公司购得.
1.1.2仪器
匀浆器(Miccra,德国);常规PCR仪(Applied Biosystem,美国);凝胶成像系统(SynGene,英国);正置荧光显微镜(Leica,德国);超微量紫外、可见分光光度计(Thermo,美国).
1.2动物处理
3月龄C57BL/6J雌性小鼠,体重19~21 g.适应环境1周后,根据体重随机分为以下2组:假手术组(n= 6);去卵巢合并单侧输尿管结扎组(n= 7).实验期间,所有动物喂饲不含植物雌激素的饲料AIN-93M.术后3周处死,迅速取出双侧肾脏,一份放入4%甲醛固定液待组织形态检测,另一份放入1.5 mL离心管并于-80 ℃保存.
1.3提取RNA
将肾脏置于1 mL Trizol中,通过匀浆器碾碎,根据说明书操作步骤提取总RNA.经超微量紫外分光光度计测定RNA浓度,并测定260,280 nm处吸光度(A)值,A260/A280的比值在1.8~2.0之间,表明该RNA质量较好.
1.4RT-PCR
取4 μg总RNA于20 μL反应体系内,经M-MLV反转录酶制备cDNA,扩增肾纤维化相关因子TGF-β,CTGF,VEGF,fibronectin,炎症因子MCP-1,RANTES,以及肾素-血管紧张素系统组分肾素(renin)、肾素受体(renin receptor,RR)血管紧张素原(AGT),以GAPDH作为内参基因.加1 μL cDNA模板于20 μL PCR反应体系内,反应程序最初于94 ℃变性3 min开始,最后于72 ℃延伸2 min结束.中间PCR循环包括:变性94 ℃、15 s;退火56 ℃、20 s;延伸72 ℃、20 s.PCR产物于2%琼脂糖凝胶电泳后,使用凝胶成像系统检测基因表达、拍照并定量.
1.5肾脏组织形态学检测
1.5.1切片制备
肾脏由甲醛溶液取出,经脱水、透明、浸蜡处理后进行石蜡包埋,蜡块完全凝固后放入-20 ℃备用.切3 μm的样本切片,展平,烘干备用.
1.5.2苏木精&伊红(H&E)染色
将切片依次放入二甲苯、浓度梯度的乙醇(100%,90%,70%),随后,放入苏木精水溶液中染色1 min.染完苏木精后,用蒸馏水洗去切片上多余的染色剂,进行伊红染色.完成染色后的片子快速经由低浓度到高浓度的酒精进行脱水,最后经二甲苯使切片透明.切片干燥后用中性树脂和盖玻片进行封片.待树脂干燥后,即在正置显微镜下观察并拍照.
1.5.3Masson’s Trichrome染色
同上经脱蜡处理后,根据说明书操作步骤将脱完蜡的切片依次放入Masson’s Trichrome染色试剂盒各组分中进行染色.完成染色的片子经脱水、透明、封片处理,待树脂干燥后在正置显微镜下观察及拍照.
1.6统计学方法
2实验结果
2.1肾组织切片H&E染色
肾组织石蜡切片经H&E染色并在镜下观察(见图1),发现模型组小鼠肾小球明显萎缩(a),使得肾小球腔隙增加(b),同时,手术处理后的小鼠由于输尿管结扎,引起肾小管腔隙体积增加、膨大(c).
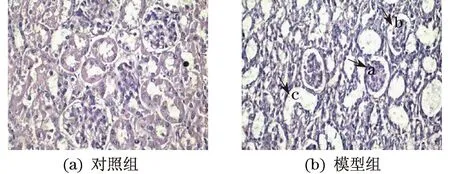
图1 肾组织石蜡切片苏木精&伊红染色
2.2肾组织切片Masson’s Trichrome染色
肾组织石蜡切片经Masson’s Trichrome染色并在镜下观察(见图2).相对于对照组,发现模型组小鼠肾小管间质较多处出现蓝色阳性信号,表明模型组小鼠肾间质纤维化严重.
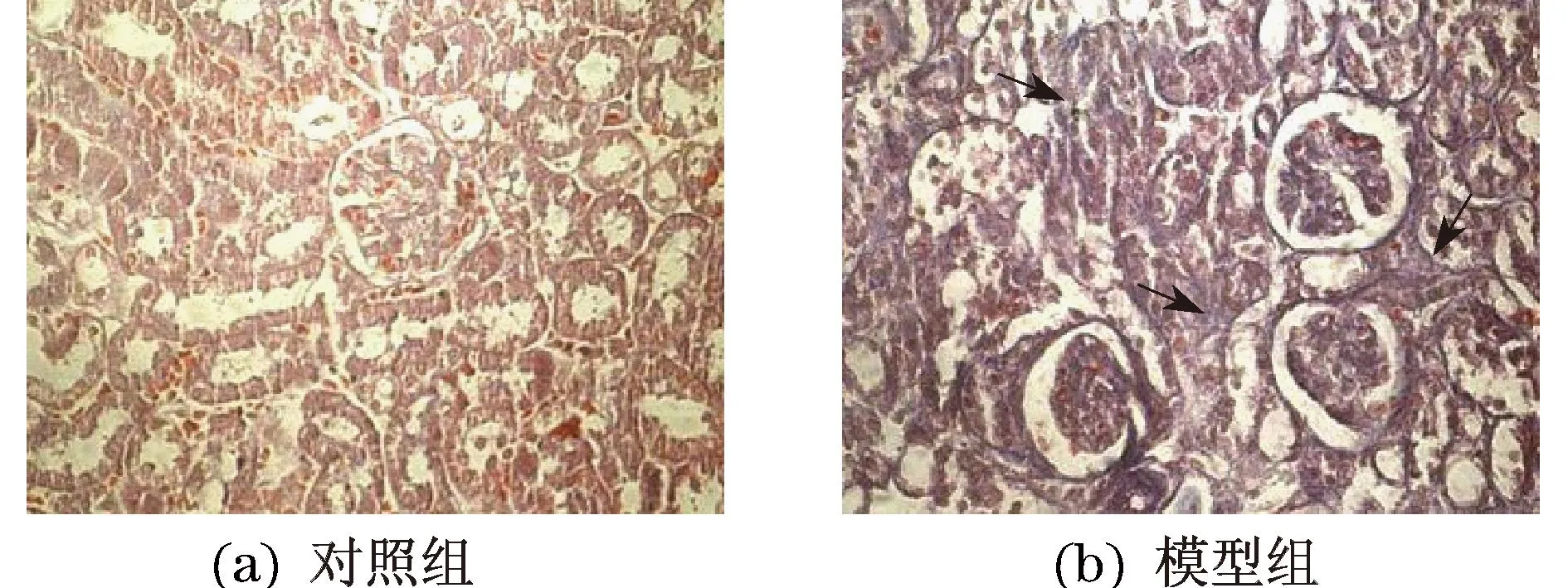
图2 肾组织石蜡切片Masson’s Trichrome染色
2.3肾组织纤维化因子、炎症因子的基因表达
纤维粘连蛋白fibronectin是组织纤维化的指标,而单核细胞趋化因子-1(MCP-1)、趋化因子RANTES参与肾脏炎症反应、介导白细胞的游走和浸润.基因表达检测结果显示,模型组小鼠肾脏fibronectin(P=0.031),MCP-1(P=0.015),RANTES(P= 0.029)的mRNA表达都显著上调(见图3),而前纤维化因子TGF-β,CTGF,VEGF的基因表达在两组间的差异不显著(数据未提供).
2.4肾组织肾素-血管紧张素系统(RAS)组分基因表达
肾组织RAS组分RR,AGT,renin的基因表达检测结果显示,模型组小鼠肾脏RR的基因表达显著上调(见图4,P= 0.035),但AGT,renin在两实验组间的表达没有显著差异.
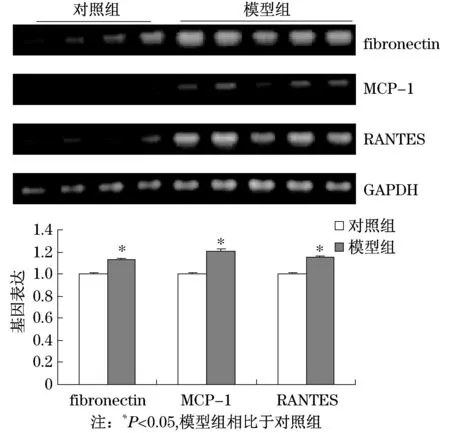
图3 肾脏纤维化因子、炎症因子的基因表达
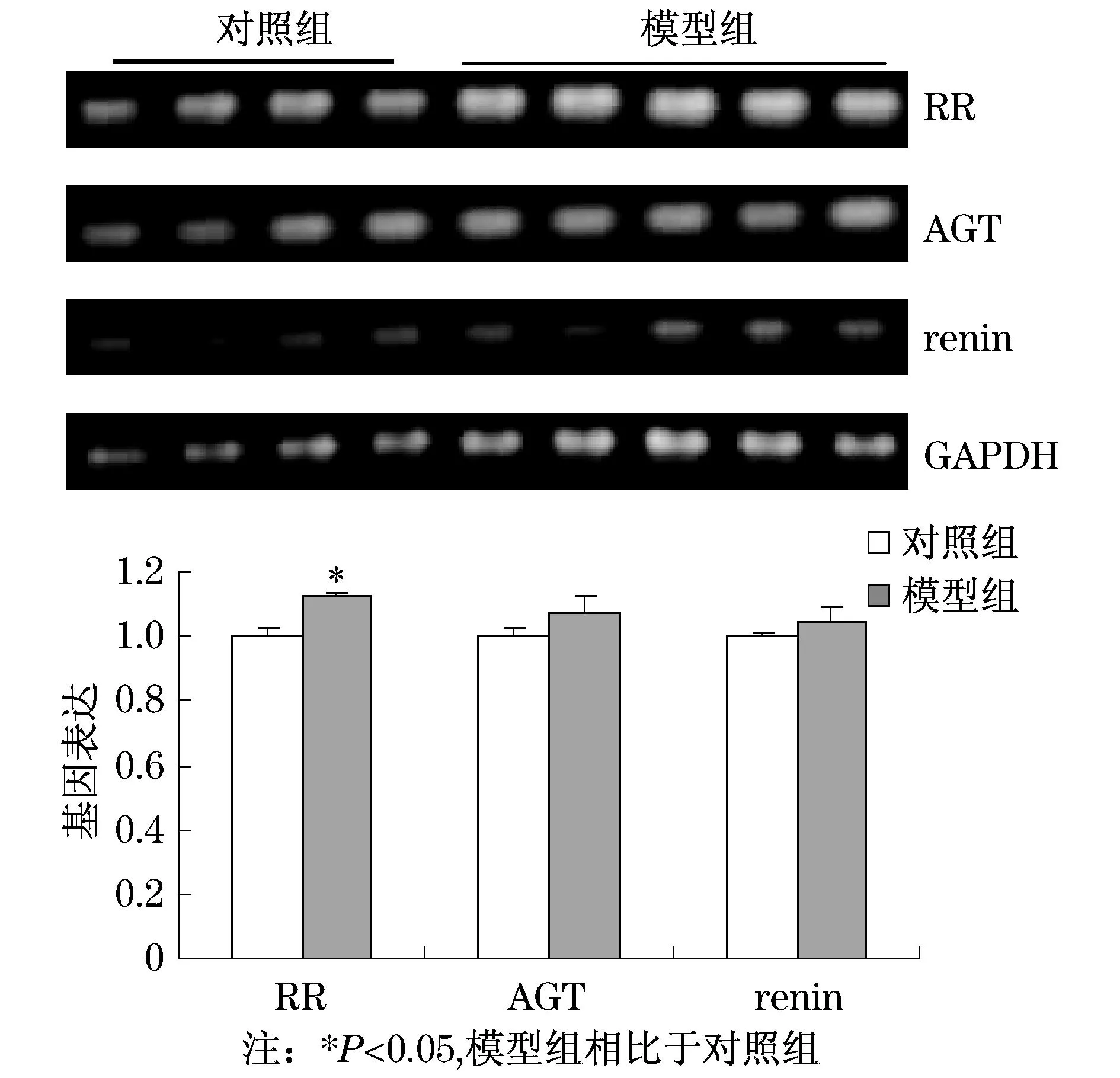
图4 肾脏RAS组分的基因表达
3讨论
绝经后妇女由于体内雌激素水平显著下降,性激素系统代谢紊乱,是多种慢性病如骨质疏松、心血管疾病、糖尿病等发生、发展的主要诱因[8-9].近来,研究显示雌激素缺乏提高了女性患慢性肾脏病的风险[5].本文通过双侧去卵巢术作为模拟绝经后妇女体内雌激素缺乏的实验模型,并结合单侧输尿管结扎(UUO)诱导梗阻性肾病研究去卵巢小鼠肾脏病变特征以及可能的病理机制.
本研究显示,去卵巢合并UUO术后3周,由于输尿管结扎,尿液不能顺利排出,在管腔中滞留,造成小鼠肾小管膨胀、扩张.同时,发现肾小球严重萎缩,肾小管间质纤维化严重,说明去卵巢合并UUO后,肾小球、肾间质都发生显著病理改变,这些同去卵巢合并糖尿病肾病大鼠[10]、去卵巢DSS(高敏感型盐摄入Dahl)大鼠[11]、去卵巢合并肾性高血压大鼠[12]的肾脏病理特征类似.本文研究发现去卵巢合并单侧输尿管结扎小鼠模型同样能够较好地模拟临床肾脏病变.
本研究从(前)纤维化因子、炎症因子、肾素-血管紧张素系统等角度探讨了去卵巢合并UUO致肾脏病理改变的可能机制.研究发现,去卵巢合并UUO上调肾纤维粘连蛋白fibronectin表达,但并没有引起前纤维化因子TGF-β,CTGF,VEGF的异常表达,这与之前报道的UUO雄性小鼠其肾脏前纤维化因子表达显著上调的结果不一致[1].因此,今后的研究有必要关注UUO致肾脏病变的分子通路是否存在性别差异性.
研究组前期研究显示,RAS活性升高能够诱发肾脏的纤维化、炎症反应[1,13-14].此外,最近的许多研究都证明,肾素受体在肾脏疾病中具有重要意义[15].在糖尿病引起的终末期肾脏病患者的肾脏中,RR表达上调[16].RR表达上调还能够刺激促纤维化因子的表达,加重肾脏纤维化[17].结合本实验结果,去卵巢合并UUO诱导RR表达升高,而RR介导了肾素/肾素原的致组织病变的生物学作用[18].因此,去卵巢合并UUO通过上调RR表达,进而诱发由fibronectin介导的肾脏纤维化的发生,同时,导致炎症趋化因子MCP-1,RANTES表达增强,提示去卵巢合并UUO潜在的致肾脏炎症的作用.
因此,本实验建立的去卵巢合并UUO的小鼠模型表现出临床肾脏病变的主要特征,去卵巢合并UUO主要通过上调肾素受体表达,诱发肾脏纤维化与炎症反应,这为今后的药物研发提供了潜在的作用靶点.
参考文献:
[1]Zhang Y,Kong J,Deb D K,et al.Vitamin D receptor attenuates renal fibrosis by suppressing the renin-angiotensin system[J].Journal of the American Society of Nephrology,2010,21(6):966-973.
[2]Zhang Y,Wu S Y,Gu S S,et al.Changes of renal vitamin D metabolic enzyme expression and calcium transporter abundance in obstructive nephropathy[J].Nephrology,2011,16(8):710-714.
[3]Gu S S,Zhang Y,Chen X,et al.Trabecular bone deterioration at the greater trochanter of mice with unilateral obstructive nephropathy[J].Asian Journal of Andrology,2013,15(4):564-566.
[4]Hutchens M P,Kosaka Y,Zhang W,et al.Estrogen-mediated renoprotection following cardiac arrest and cardiopulmonary resuscitation is robust to GPR30 gene deletion[J].PLoS One,2014,9(6):e99910.
[5]Satta E,Magno C,Galì A,et al.Sexual dysfunction in women with diabetic kidney[J].International Journal of Endocrinology,2014,2014:346834.
[6]Doublier S,Lupia E,Catanuto P,et al.Testosterone and 17β-estradiol have opposite effects on podocyte apoptosis that precedes glomerulosclerosis in female estrogen receptor knockout mice[J].Kidney International,2011,79(4):404-413.
[7]Melamed M L,Blackwell T,Neugarten J,et al.Raloxifene,a selective estrogen receptor modulator,is renoprotective:a post-hoc analysis[J].Kidney International,2011,79(2):241-249.
[8]Goyal S,Baruah M,Devi R,et al.Study on relation of metabolic syndrome with menopause[J].Indian Journal of Clinical Biochemistry,2013,28(1):55-60.
[9]Kumawat M,Sharma T K,Singh N,et al.Study of changes in antioxidant enzymes status in diabetic post menopausal group of women suffering from cardiovascular complications[J].Clinical Laboratory,2012,58(3/4):203-207.
[10]Mankhey R W,Bhatti F,Maric C.17β-Estradiol replacement improves renal function and pathology associated with diabetic nephropathy[J].American Journal of Physiollogy Renal Physiology,2005,288(2):F399-F405.
[11]Maric C,Sandberg K,Hinojosa-Laborde C.Glomerulosclerosis and tubulointerstitial fibrosis are attenuated with 17β-estradiol in the aging Dahl salt sensitive rat[J].Journal of the American Society of Nephrology,2004,15(6):1546-1556.
[12]Ji H,Menini S,Zheng W,et al.Role of angiotensin-converting enzyme 2 and angiotensin(1-7)in 17β-oestradiol regulation of renal pathology in renal wrap hypertension in rats[J].Experimental Physiology,2008,93(5):648-657.
[13]Zhang Y,Deb D K,Kong J,et al.Long-term therapeutic effect of vitamin D analog Doxercalciferol on diabetic nephropathy:strong synergism with AT1 receptor antagonist[J].American Journal of Physiology Renal Physiology,2009,297(3):F791-F801.
[14]Zhang Z Y,Zhang Y,Ning G,et al.Combination therapy with AT1 receptor blocker and vitamin D analog markedly ameliorates diabetic nephropathy:blockade of compensatory renin increase[J].Proceedings of the National Academy Sciences of United States of America,2008,105(41):15896-15901.
[15]杜然,丁国华.肾素(原)受体及其与肾脏疾病相关的研究进展[J].医学研究杂志,2013,42(7):174-176.
[16]Takahashi K,Yamamoto H,Hirose T,et al.Expression of(pro)renin receptor in human kidneys with end-stage kidney disease due to diabetic nephropathy[J].Peptides,2010,31(7):1405-1408.
[17]Feldt S,Batenburg W W,Mazak I,et al.Prorenin and renin-induced extracellular signal-regulated kinase 1/2 activation in monocytes is not blocked by aliskiren or the handle-region peptide[J].Hypertension,2008,51(3):682-688.
[18]Zhang Y,Wang Y L,Chen Y Z,et al.Inhibition of renin activity by aliskiren ameliorates diabetic nephropathy in type 1 diabetes mouse model[J].Journal Diabetes Mellitus,2012,2(3):353-360.
Pathological Effects of Ovariectomy Combined with Unilateral Ureteral Obstruction on Kidney of Mice
LI Xiaoli,LI Xiaomin,LIU Jinxin,YANG Jiulin,ZHANG Yan
(Center for Systems Biomedical Sciences,University of Shanghai for Science and Technology,Shanghai 200093,China)
Abstract:To study the pathological change and the potential mechanism of ovariectomy with unilateral ureteral obstruction on kidney of mice,the female C57BL/6J mice were divided into a control group and a model group.The kidney samples were obtained in 3 weeks after operation.The paraffin kidney slices were stained by H&E and Masson’s Trichrome.The mRNA expressions of fibrotic factors,including TGF-β,CTGF,VEGF and fibronectin,the inflammation factors including MCP-1 and RANTES,and the renin-angiotensin system(RAS)components including renin,renin receptor,AGT,were measured by RT-PCR.The results show that,for the mice of model group,the atrophy of glomerular,the enhancement and inflation of renal tubules,and the tubular interstitial fibrosis can be observed and the mRNA expression of fibronectin,MCP-1,RANTES and renin receptor in kidney are also obviously increased.In conclusion,the ovariectomy combined with unilateral ureteral obstruction may induce the renal fibrosis and inflammation by up-regulating the renin receptor in kidney.
Keywords:ovariectomy; unilateral ureteral obstruction; kidney
中图分类号:R 361+.2; R 364.5
文献标志码:A
通信作者:张岩(1978-),男,副研究员.研究方向:药理学.E-mail:medicineyan@aliyun.com
基金项目:上海市科委浦江人才计划资助项目(10PJ1407700)
收稿日期:2014-10-11
DOI:10.13255/j.cnki.jusst.2016.01.017
文章编号:1007-6735(2016)01-0098-05
第一作者: 李晓敏(1990-),女,硕士研究生.研究方向:药理学.E-mail:1187117257@qq.com

