B淋巴细胞在抗CD45RB 抗体诱导的移植免疫耐受中的作用*
邓春艳, 张国超, 邓绍平, 任莉莉, 蒋锦杏, 俞丽娜, 齐 晖, 李富荣
(暨南大学第二临床医学院/深圳市人民医院干细胞与细胞治疗重点实验室/广东 深圳 518020)
B淋巴细胞在抗CD45RB 抗体诱导的移植免疫耐受中的作用*
邓春艳,张国超,邓绍平,任莉莉,蒋锦杏,俞丽娜,齐晖,李富荣△
(暨南大学第二临床医学院/深圳市人民医院干细胞与细胞治疗重点实验室/广东 深圳 518020)
[摘要]目的: 探讨B淋巴细胞在抗CD45RB抗体诱导的移植免疫耐受中的作用。方法: 抗CD45RB抗体对BALB/c裸鼠进行预处理后制备脾脏单细胞悬液,与BALB/c小鼠T淋巴细胞和C57BL/6小鼠脾细胞混合培养,流式细胞术分析Th1、Th2、Treg和Tm淋巴细胞。以B6.μMT-/-小鼠为受体、BALB/c小鼠为供体建立皮肤移植模型,移植后向受体鼠腹腔注射抗CD45RB 单抗,监测脾淋巴细胞 CD3+CD45RBhi细胞比例。在混合淋巴培养过程中加入抗 CD45RB单抗,分离 B 细胞,建立以BALB/c 小鼠为供体、B6.μMT-/-小鼠为受体的心脏移植模型,通过尾静脉注射B 细胞给 B6.μMT-/-小鼠,观察受体鼠生存期和B细胞分布。结果: 在裸鼠体内用抗 CD45RB 抗体处理过的 B 淋巴细胞,与 T 淋巴细胞混合培养时,可使Treg和Th2 淋巴细胞比例明显升高,Th1淋巴细胞的比例明显下降,Tm细胞无明显变化。在体内B淋巴细胞缺失的情况下,抗 CD45RB 抗体依然能够降低 T 细胞表面 CD45RB 的表达,与对照组B淋巴细胞存在组相比,抗 CD45RB 抗体对 T 淋巴细胞表面 CD45RB 下调更为快速,但最终CD3+CD45RBhiT 细胞比例无明显变化。体外抗 CD45RB 抗体处理过的B淋巴细胞可以延长受体鼠的生存时间。B6.μMT-/-鼠在接受抗CD45RB抗体处理的B细胞并进行同种异体心脏移植后,B细胞可向胸腺迁移。结论: 在抗CD45RB抗体诱导的免疫耐受中,B淋巴细胞可能通过介导各T淋巴细胞亚群比例发挥着重要作用,且在中枢耐受中也起到一定作用,但是仅靠B淋巴细胞无法形成完全耐受。
[关键词]CD45RB抗体; 移植; 免疫耐受
CD45分子是一种广泛地表达在造血系细胞如T细胞、B细胞、自然杀伤细胞等表面的跨膜糖蛋白,是细胞膜上信号转导的关键分子,在淋巴细胞的发育成熟、功能调节及信号传递中具有重要意义。CD45RB是CD45的一种异构体,主要表达在 T、B、DC 细胞表面。大量实验证明针对CD45RB的单克隆抗体能够在同种异体移植模型中诱导移植物长期存活,并在受体体内形成特异性的免疫耐受[1-5]。目前针对抗CD45RB抗体诱导的免疫耐受调节机制的研究大多集中在T细胞介导的免疫调节功能。
近年的研究发现在CD45RB单抗诱导的移植免疫耐受中必须有宿主B淋巴细胞的参与[6-7],但相关作用机制尚不清楚。本实验通过研究在B细胞存在或缺失状态下,抗CD45RB 抗体在体内外对T细胞的作用及诱导移植免疫耐受的影响等,阐述B淋巴细胞在抗 CD45RB抗体诱导的移植免疫耐受中可能发挥的作用机制。
材料和方法
1实验动物
近交系BABL/c小鼠(6~8周龄),雌雄不限,购自广东省医学实验动物中心;近交系雌性C57BL/6小鼠(6~8周龄)及雄性BABL/c裸鼠购自南方医科大学动物实验中心; B6.μMT-/-鼠(B细胞缺失,C57BL/6同源, 6~8周龄),雌雄各半,购自Jackson实验室。动物实验均在深圳市疾病控制中心 (SPF级动物实验中心)完成,所用动物实验符合动物伦理学要求。
2主要试剂
抗CD45RB单克隆抗体购自BioXcell;尼龙柱购自Wako;抗CD3-PECY5、CD19-PE、CD4-PECY5、CD25-Alexa Fluro、CD127-PE、 CD8-FITC、CD44-PE、CD62L-FITC、CD45RB-FITC、IL-4-PE、IFN-γ-PE及相应的同型对照等流式抗体购自eBioscience;流式破膜剂购自Beckman;淋巴细胞分离液购自达科为生物技术有限公司;丝裂霉素、PMA、ionomycin等购自Sigma;DMEM和RPMI-1640培养基购自Thermo;胎牛血清购自HyClone。
3主要方法
3.1抗CD45RB抗体对BALB/c裸鼠进行预处理将BALB/c裸鼠分为2组,每组各5只。 A 组(n=5)在 0、1、3、5、7 d分别腹腔注射100 μL浓度为1 g/L的抗CD45RB单抗;B组(n=5)在0、1、3、5、7 d腹腔注射 100 μL 生理盐水,7 d后待用。
3.2抗CD45RB抗体预处理的B淋巴细胞对T淋巴细胞亚群的作用预处理的BALB/c裸鼠,无菌取脾脏制备脾淋巴细胞悬液,采用尼龙柱分离法分离B淋巴细胞备用。分别以抗CD3-PEcy和CD19-PE标记,流式细胞术检测CD3+T细胞纯度>90%,CD19+B细胞>90%,将提取的C57BL/6小鼠脾淋巴细胞与丝裂霉素C共孵育后作为刺激细胞。将3 种细胞按1∶2∶1的比例加至6孔板混合培养,实验分为实验组:BALB/c小鼠T淋巴细胞+B淋巴细胞(来自抗CD45RB抗体预处理BALB/c裸鼠)+C57BL/6脾淋巴细胞;对照组:BALB/c小鼠T淋巴细胞+B淋巴细胞(来自生理盐水预处理BALB/c裸鼠)+C57BL/6脾淋巴细胞。
共培养0、1、3、5、7 d时每组取3个复孔分别收获悬浮细胞,流式细胞术检测T细胞亚群包括Treg(CD4+CD25+CD127-)、Th1(CD3+CD8-IFN-γ+)、Th2(CD3+CD8-IL-4+)和Tm(CD4+CD62L-CD44hi)。取待检测细胞(1×106)于试管中,分别加入抗体及相应同型对照进行细胞免疫荧光染色。IL-4、IFN-γ等细胞内细胞因子的检测需先经过PMA及BFA刺激,染色前采用破膜剂进行破膜处理。孵育后流式细胞仪(FACSC Canto Ⅱ,Beckton Dickinson)分别进行检测。
3.3抗CD45RB抗体对B细胞缺馅鼠CD3+CD45RBhiT细胞的影响取BALB/c小鼠耳背部皮肤移植到B6.μMT-/-或C57BL/6小鼠背部,移植方法参照文献进行[8]。实验按照随机对照原则分为4组,每组受体鼠24只。A组(实验组)和B组均为B6.μMT-/-鼠移植 BALB/c 鼠耳背皮肤; C组和D组均为C57BL/6鼠移植 BALB/c鼠耳背皮肤。移植后0、1、3、5、7 d,分别向 A、C 组受体鼠腹腔注射100 μL浓度为1 g/L的抗 CD45RB 单抗,B、D 组腹腔注射 100 μL 生理盐水。每组分别在腹腔注射后0、1、3、5、7、9 d取4只受体鼠脾脏,制备单细胞悬液,同上方法,流式细胞术检测CD3+CD45RBhi的百分率。
3.4抗CD45RB抗体处理的B淋巴细胞在同种异体心脏移植中诱导耐受的作用取8周龄雌性C57BL/6小鼠和8周龄雌性BALB/c小鼠,无菌取脾制成单细胞悬液。将C57BL/6小鼠脾淋巴细胞作为反应细胞,BALB/c小鼠脾淋巴细胞用丝裂霉素C处理后作为刺激细胞进行混合培养。实验组细胞在0、1、3、5、7 d分别加入1 g/L的抗CD45RB抗体10 μg,对照组加入PBS 10 μL。将混合培养淋巴细胞在第9天经尼龙柱法分离B淋巴细胞,调整细胞浓度2.5×1010/L。B6.μMT-/-鼠经尾静脉注射分别来自实验组和对照组的5×106B细胞后作为受体,BALB/c小鼠作为供体开始行同种异体的心脏移植,移植方法见文献[9]。每组小鼠各6只,每天通过视、触诊观察供心的搏动情况。以供心搏动有力,且小鼠存活72 h以上视为移植成功,记录移植小鼠的生存时间。
3.5B细胞经抗CD45RB抗体处理后向胸腺迁移状况的检测按照随机数字表法将60只B6.μMT-/-分为3组,每组20只。正常的B6小鼠 B细胞约5×106经抗CD45RB抗体10 μg处理,CFSE标记上述细胞后通过尾静脉向实验组和 B6.μMT-/-鼠注射,将 BALB/c 小鼠心脏移植到B6.μMT-/-鼠,方法同前。以接受不经抗CD45RB抗体处理组的B细胞移植受体鼠作为对照组1,接受抗CD45RB抗体处理组的B细胞但不做心脏移植的 B6.μMT-/-鼠为对照组2。在1、3、5、7、10 d每组取4只小鼠胸腺制备单细胞悬液,通过流式细胞仪监控CD19+CFSE+B细胞迁移到胸腺的程度。
4统计学处理
所有结果以 SPSS 13.0 统计软件分析。数据以均数±标准差(mean±SD)表示,统计方法使用两样本t检验和析因设计的方差分析,各组均数间的两两比较采用Bonferroni校正的t检验,生存期采取log-rank检验,以P<0.05为差异有统计学意义。
结果
1抗CD45RB抗体处理过的B细胞在体外对T 细胞亚群的影响
为了观察B淋巴细胞在抗CD45RB抗体诱导免疫耐受中对 T 细胞亚群的影响,我们将来自抗CD45RB抗体注射后BALB/c裸鼠的B细胞与BALB/c小鼠的T细胞一起作为反应细胞进行混合淋巴细胞培养。混合淋巴培养7 d内,2组调节性Treg细胞比例均呈逐渐上升趋势,但实验组中上升幅度明显高于对照组(P<0.05);2组Tm细胞比例呈逐渐上升趋势,但上升幅度无明显差别;2组Th1细胞阳性率均呈逐渐上升趋势,实验组升幅明显低于对照组;Th2细胞阳性率也呈逐渐上升趋势,但实验组升幅明显高于对照组;实验组Th1/Th2较对照组降低(P<0.05),见图1。
2抗CD45RB抗体对B细胞缺陷鼠外周成熟T细胞的影响
为了解抗CD45RB抗体在B细胞缺失的情况下,对同种异体移植模型外周T细胞的影响,我们选取体内B细胞缺陷小鼠B6.μMT-/-鼠作为受体进行同种异体皮肤移植,并与非B细胞缺陷鼠进行比较。A 组B6.μMT-/-鼠注射抗CD45RB抗体后,第1天的CD3+CD45RBhi细胞在CD3+细胞中的比例即降到 40%左右,继续注射抗体无法使其比例再降低。B组B6.μMT-/-鼠未使用抗CD45RB抗体,CD3+CD45RBhi的比例随时间几乎没有变化。C 组 C57BL/6 鼠在注射抗 CD45RB抗体后,CD3+CD45RBhi的比例随时间逐渐降低,在第9天降到了和B细胞缺陷鼠A组相同的水平(P<0.05)。D组C57BL/6鼠在移植皮肤之后注射生理盐水,随时间的延长,CD3+CD45RBhi的比例呈明显升高,见图1。
3体外诱导耐受的B细胞对心脏移植受体鼠生存期的影响
为了观察抗CD45RB抗体对外周耐受的诱导是否仅仅依靠B细胞就可以完成,我们在体外用抗CD45RB抗体诱导B细胞的耐受,将诱导耐受后的B细胞静脉注入B细胞缺陷鼠体内,观察心脏移植的生存期。在体外混合培养6 h后观察细胞形态,可见未加抗体组的淋巴细胞分布较均匀,无细胞成团现象。而加入抗体组的细胞大部分形成大小不等的团状分布,散在单个分布细胞较少。将抗CD45RB抗体处理过的C57BL/6小鼠B细胞分离出来,经尾静脉注射给同种异体心脏移植受体B细胞缺陷B6.μMT-/-鼠能延长移植物存活时间。实验组移植心脏平均存活时间为(14.3±3.5)d,对照组移植心脏平均存活时间为(4.2±1.2)d。经log-rank检验,实验组移植心脏存活时间较对照组明显延长(P<0.05),见图2。
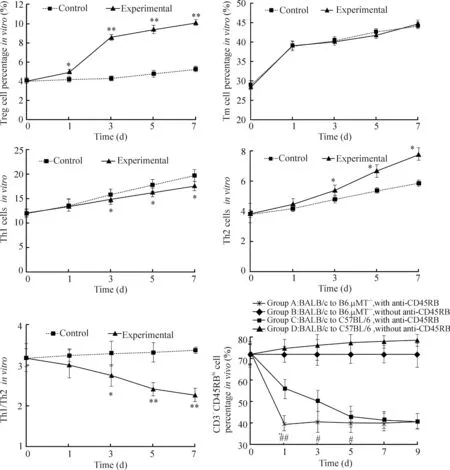
Figure 1.The influence of anti-CD45RB mAb-disposed B cells on T-cell subgroups. Mean±SD.n=3~4.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsgroup C.
图1抗CD45RB抗体处理过的B细胞对T细胞亚群的影响
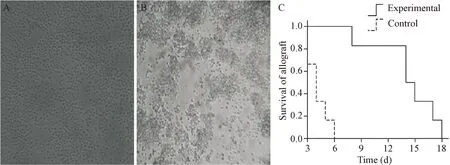
Figure 2.The influence ofinvitroinduced tolerance B cells on the lifetime of rats after allogeneic heart transplantation. A: the cells in mixed lymphocyte culture without anti-CD45RB mAb (×200); B: the cells in mixed lymphocyte culture with anti-CD45RB mAb (×200); C: the survival curve after transplantation (n=6).
图2体外诱导耐受的 B 细胞对同种异体心脏移植受体鼠生存期的影响
4B细胞经抗CD45RB抗体处理后向胸腺迁移状况
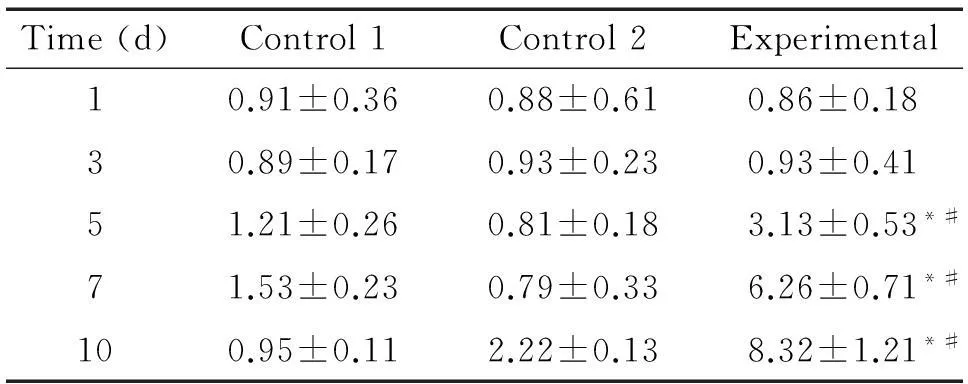
实验组于第5天在胸腺中开始检测到少量经 CFSE 标记过的B细胞[(3.13±0.53) %],随后逐渐增多,第10天达到约(8.32±1.21) %;对照组1中B细胞未经过抗CD45RB抗体处理,胸腺中未出现明显的CD19+CFSE+B细胞;对照组2虽然接受了抗CD45RB抗体处理的B细胞,但未进行移植,前期胸腺中未能检测到CD19+CFSE+B细胞,直到第10天,在胸腺中仅检测到微量B细胞[(2.22±0.13) %],见图3、表1。
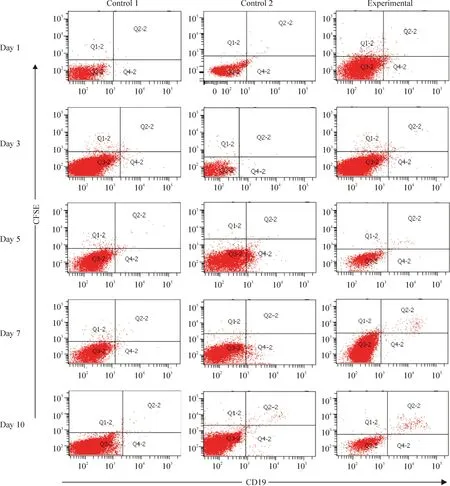
Figure 3.The migration of B cells treated with anti-CD45RB mAb to the thymus.Control 1: B cells was untreated with anti-CD45RB mAb in the transplantion model; control 2: B cells was treated with anti-CD45RB mAb but without transplantation.
图3B细胞经抗CD45RB抗体处理后向胸腺迁移状况
讨论
B 细胞是体内数目最多的抗原提呈细胞,也是体内惟一能产生抗体的细胞,但是它在免疫耐受中发挥的作用仍然是有争议的,它可能对免疫排斥具有两种决然不同的作用。在某些情况下B细胞会加速排斥反应、促进细胞免疫,清除B细胞可能延长移植物存活[10-12]。而在另一些研究中,B 细胞在抗CD45RB抗体耐诱导的耐受中被证明是必须的[6-7, 13]。
表1B细胞经CD45RB抗体处理后向胸腺迁移状况
Table 1.The migration of B cells treated with anti-CD45RB mAb to the thymus (%. Mean±SD.n=4)
Time(d)Control1Control2Experimental10.91±0.360.88±0.610.86±0.1830.89±0.170.93±0.230.93±0.4151.21±0.260.81±0.183.13±0.53*#71.53±0.230.79±0.336.26±0.71*#100.95±0.112.22±0.138.32±1.21*#
*P<0.05vscontrol 1;#P<0.05vscontrol 2.
本实验研究发现,在体内用抗CD45RB抗体对裸鼠 B 细胞进行处理,处理后的 B 细胞在体外能上调裸鼠体内缺少的T细胞。用抗CD45RB 抗体进行处理时,体内B细胞在缺少胸腺、无T细胞和没有抗原刺激的情况下,一方面抗CD45RB抗体可能通过竞争性结合B细胞表面CD45RB,从而阻断活化信号的传导,起到抑制增殖的作用;另一方面抗CD45RB抗体可能改变B细胞表面某些分子的表达,使B细胞转变成介于静息状态B细胞和耐受状态B细胞之间的一种状态。当把此种B细胞取出体外,在混合淋巴细胞培养中与T细胞、抗原刺激相混合时,这种中间状态可能改变B细胞提呈抗原、与 T 细胞共刺激等作用,从而使 Th2、Treg 细胞比率升高,Th1 细胞比率下降,T 细胞反应朝向耐受的方向发展。对Tm细胞无明显影响可能是因为T 细胞第一次遇到外界抗原刺激,记忆T细胞增殖作用占主导地位,而抗CD45RB 抗体处理过的 B 细胞对其增殖的抑制影响被忽略所致。
Blaylock等[14]实验证实, 抗CD45RB抗体的免疫调节作用与清除外周血中某种特异性 T 细胞亚群有关。有研究[15-16]证明抗 CD45RB抗体可改变受体外周血CD45RBhiT细胞和CD45RBloT细胞的比值来诱导耐受,CD45RBloCD4+T能够表达调节性转录因子Foxp3,分泌细胞因子IL-4,且具有调节作用,而CD45RBhiCD4+T低表达Foxp3,分泌介导排斥反应的Th1类细胞因子,且具有效应细胞的作用。因此,调节性CD45RBloT和效应性CD45RBhiT之间平衡的改变对于CD45RB单抗的免疫功能是至关重要的。本实验发现,在B细胞缺失的情况下,抗CD45RB抗体对脾内CD45RBhiT的减少作用依然存在,只是减少的方式与B细胞存在的情况下有所不同。B细胞缺陷鼠皮肤移植注射抗CD45RB抗体后,第1天CD3+CD45RBhi细胞在CD3+阳性细胞中的比例就降到40%左右,以后再注射抗体都无法使其比例再降低。而C57BL/6皮肤移植鼠在注射抗CD45RB 抗体后,CD3+CD45RB+的比例随时间逐渐降低,在第9天降到了和 B 细胞缺陷鼠实验组相同的水平。原因可能是CD45RB广泛表达在T、B细胞表面,在B细胞存在的情况下,B细胞能够和 T 细胞竞争抗CD45RB的结合位点,不至于使CD45RBhiT细胞降低过快。C57BL/6小鼠生理盐水组CD45RBhiT 细胞比例稍有增加,而B6.μMT-/-鼠生理盐水组基本没有变化,可能是因为在接受抗原刺激时,作为抗原提呈细胞的B细胞可上调 T细胞表面CD45RB分子的表达,CD45RBhiT细胞具有效应细胞的作用,从而产生更为强烈的免疫反应。实验结果说明,在抗CD45RB抗体减少外周CD45RBhiT细胞的作用中,B细胞起到一定的作用,但并不是决定性的作用。B细胞可以使CD45RBhiT细胞的减少不至于过快,这也可能是抗CD45RB抗体诱导耐受后,机体仍对其它抗原保持正常免疫反应的一个原因。
CD45RB诱导的免疫耐受中,B细胞起到重要作用,B细胞的缺失将导致诱导耐受的失败,但抗CD45RB 抗体对耐受的诱导仅仅依靠B细胞能形成吗?本实验在将体外诱导耐受的B细胞注入到B细胞缺陷鼠体内重建其免疫系统,可延长移植物的生存期,但不能诱导完全免疫耐受。这也说明了在抗CD45RB诱导耐受中B细胞的耐受并不能诱导整个机体的耐受,还需要T、DC等细胞的参与。在体外制备耐受B细胞时,我们注意到在混合淋巴细胞培养中加入抗CD45RB抗体后,B细胞聚集成团生长,单个散在细胞较少。其原因一方面可能是淋巴细胞竞争性地与抗CD45RB抗体结合,导致了一个抗CD45RB分子与多个淋巴细胞结合的现象。另一方面可能是细胞表面的CD54即细胞间黏附分子-1的表达上调,这类分子的上调直接影响到了细胞间的接触,导致了细胞的成团分布。本实验还发现应用抗 CD45RB加速了同种异体移植模型中B细胞向胸腺的迁移,进而提呈移植物特异性抗原给胸腺,介导了胸腺对能与移植物特异性抗原结合的T细胞的克隆清除,从而导致了中枢耐受,证实了在抗CD45RB抗体所介导的中枢耐受中需要宿主B细胞的参与。
综上所述,抗CD45RB抗体诱导的免疫耐受中,B细胞发挥着重要作用,但是,仅仅依靠B细胞无法形成完全耐受。免疫耐受的诱导是一个多种机制参与的免疫调节过程。我们需要对抗CD45RB抗体诱导的免疫耐受调节规律进行更深入的研究,才能够更好地发掘抗CD45RB抗体作为新的免疫抑制药物在临床移植中的应用潜力。
[参考文献]
[1]Camirand G, Rousseau J, Ducharme ME, et al. Novel Duchenne muscular dystrophy treatment through myoblast transplantation tolerance with anti-CD45RB, anti-CD154 and mixed chimerism[J]. Am J Transplant, 2004, 4(8):1255-1265.
[2]Lee EN, Kim EY, Lee J, et al. Changes in expression of T-cell activation-related molecules and cytokines during tolerance induction in an allogeneic skin transplantation murine model[J]. Transplant Proc, 2004, 36(8): 2425-2428.
[3]Visser L, Poppema S, de Haan B, et al. Prolonged survival of rat islet xenografts in mice after CD45RB monotherapy[J]. Transplantation, 2004, 77(3):386-391.
[4]Rayat GR, Gill RG. Indefinite survival of neonatal porcine islet xenografts by simultaneous targeting of LFA-1 and CD154 or CD45RB[J]. Diabetes, 2005, 54(2):443-451.
[5]Zhong T, Liu Y, Jiang J, et al. Long-term limb allograft survival using a short course of anti-CD45RB monoclonal antibody, LF 15-0195, and rapamycin in a mouse model[J]. Transplantation, 2007, 84(12):1636-1643.
[6]Deng S, Moore DJ, Huang X, et al. Cutting edge: transplant tolerance induced by anti-CD45RB requires B lymphocytes[J]. J Immunol, 2007, 178(10): 6028-6032.
[7]Lee KM, Kim JI, Stott R, et al. Anti-CD45RB/anti-TIM-1-induced tolerance requires regulatory B cells[J]. Am J Transplant, 2012, 12(8):2072-2078.
[8]沈媛,曾耀英,肇静娴. 雌激素处理DCs在诱导小鼠同种皮肤移植免疫耐受中的作用[J]. 中国病理生理杂志,2008, 24(10):2020-2024.
[9]Ono K, Lindsey ES. Improved technique of heart transplantation in rats[J]. J Thorac Cardiovasc Surg, 1969, 57(2):225-229.
[10]Colvin RB, Smith RN. Antibody-mediated organ-allograft rejection[J]. Nat Rev Immunol, 2005, 5(10):807-817.
[11]Noorchashm H, Reed AJ, Rostami SY, et al. B cell-mediated antigen presentation is required for the pathogenesis of acute cardiac allograft rejection[J]. J Immunol, 2006,177(11):7715-7722.
[12]Kelishadi SS, Azimzadeh AM, Zhang T, et al. Preemptive CD20+B cell depletion attenuates cardiac allograft vasculopathy in cyclosporine-treated monkeys[J]. J Clin Invest, 2010, 120(4):1275-1284.
[13]Huang X, Moore DJ, Mohiuddin M, et al. Inhibition of ICAM-1/LFA-1 interactions prevents B-cell-dependent anti-CD45RB-induced transplantation tolerance[J]. Transplantation, 2008, 85(5):675-680.
[14]Blaylock MG, Sexton DW, Walsh GM. Ligation of CD45 and the isoforms CD45RA and CD45RB accelerates the rate of constitutive apoptosis in human eosinophils[J]. J Allergy Clin Immunol, 1999, 104(6):1244-1250.
[15]Luke PP, Deng JP, Lian D, et al. Prolongation of allograft survival by administration of anti-CD45RB monoclonal antibody is due to alteration of CD45RBhi: CD45RBloT-cell proportions[J]. Am J Transplant, 2006, 6(9): 2023-2034.
[16]Chen G, Luke PP, Yang H, et al. Anti-CD45RB monoclonal antibody prolongs renal allograft survival in cynomolgus monkeys[J]. Am J Transplant, 2007, 7(1): 27-37.
(责任编辑: 陈妙玲, 罗森)
Role of B cells in CD45RB antibody-induced transplantation immune tolerance
DENG Chun-yan, ZHANG Guo-chao, DENG Shao-ping, REN Li-li, JIANG Jin-xing, YU Li-na, QI Hui, LI Fu-rong
(TheKeyLaboratoryofStemCellandCellularTherapy,ShenzhenPeople’sHospital,TheSecondClinicalMedicalCollege,JinanUniversity,Shenzhen518020,China.E-mail:frli62@163.com)
[ABSTRACT]AIM: To investigate the role of B cells in CD45RB antibody-induced transplantation immune tolerance. METHODS: Single cell suspension was made from the spleen of BALB/c nude mice disposed by CD45RB antibody, then mixed cultured with T cells of BALB/c mice and spleen cells of C57BL/6 mice. The Th1, Th2, Treg and Tm cells were monitored by flow cytometry during the culture process. The skin graft model was set up with B6.μMT-/-mice as receptors and BALB/c mice as donors. CD45RB antibody was intraperitoneally injected into the receptors after transplantation and then CD3+CD45RBhicells were detected by flow cytometry. In another mixed lymphocyte culture, CD45RB antibody was added, and then B cells were isolated and injected into B6.μMT-/-mice through the tail vein. The heart transplantation model was established with B6.μMT-/-mice as receptors and BALB/c mice as donors, and then the survival and the migration of B cells to the thymus were observed. RESULTS: When T lymphocytes were co-cultured with B lymphocytes treated with anti-CD45RB monoclonal antibody (mAb) in vivo, the percentages of Th2 and Treg cells were up-regulated and Th1 cells were down-regulated, but Tm cells were not altered as compared with the control. In vivo without B lymphocytes, anti-CD45RB mAb also down-regulated the expression of CD45RB in T lymphocytes. The reduction was faster and the percentage of CD3+CD45RBhiT cells was not altered as compared with the control. The B lymphocytes treated with anti-CD45RB mAb in vitro prolonged the lifetime of receptor in heart transplantation model but failed to induce complete tolerance. After recieving B cells treated with anti-CD45RB mAb and allogeneic heart transplantation, B cells migrated to the thymus in B6.μMT-/-mice. CONCLUSION: B lymphocytes play a definite role in the transplantation immune tolerance induced by anti-CD45RB mAb through their affection on T-cell subgroups and also in the central tolerance. However, the induction of immune tolerance can not only rely on B cells.
[KEY WORDS]CD45RB antibody; Transplantation; Immune tolerance
doi:10.3969/j.issn.1000- 4718.2016.03.017
[中图分类号]R392.4; R363
[文献标志码]A
通讯作者△Tel: 0755-22942450; E-mail: frli62@163.com
*[基金项目]国家973前期专项(No.2007CB516811);国家自然科学基金资助项目(No.30772042);深圳市科技计划(No.201001005)
[收稿日期]2015- 09- 01[修回日期] 2016- 01- 26
[文章编号]1000- 4718(2016)03- 0492- 07
杂志网址: http://www.cjpp.net

