ATRA对兔颈动脉粥样硬化斑块和炎症反应的影响
彭忠兴,李翔,刁胜朋,黄叶青,程静,刘爱群,危智盛,余青云,洪铭范
(广东药科大学附属第一医院 神经内科,广东 广州 510080)
ATRA对兔颈动脉粥样硬化斑块和炎症反应的影响
彭忠兴,李翔,刁胜朋,黄叶青,程静,刘爱群,危智盛,余青云,洪铭范
(广东药科大学附属第一医院 神经内科,广东 广州 510080)
目的 通过构建兔颈动脉粥样硬化(AS)模型,观察全反式维甲酸(ATRA)对AS斑块中转化生长因子-β1(TGF-β1)、兔白介素-6(IL-6)、兔白介素-10(IL-10)和兔白介素-17(IL-17)的表达水平,探讨ATRA的抗AS作用及其机制。方法 选取34只纯种雄性新西兰白兔随机分为正常组、模型组、他汀组、ATRA组。正常组给予基础饲料,其余各组给予高脂饲料。实验4周后他汀组予辛伐他汀2 mg/(kg·d)灌胃给药,ATRA组予ATRA 20 mg/d灌胃给药。12周末处死动物,取颈动脉组织观察AS斑块形态及炎症反应情况,并测定血清中血脂、TGF-β、IL-6、IL-10、IL-17的水平。结果 模型组颈动脉可见AS斑块形成,内膜断裂。他汀组及ATRA组内皮细胞形态和内膜尚完整。血清中TGF-β1和IL-10水平结果,ATRA组分别为(3 059.49±599.75)ng/L和(46.83±4.56)ng/L,他汀组分别为(2 709.48±601.44)ng/L和(43.13±4.07)ng/L,均比模型组的(2 039.16±638.07)ng/L和(36.39±7.34)ng/L显著增高(P<0.05)。血清中IL-6和IL-17水平结果,ATRA组分别为(64.92±6.64)ng/L和(1 474.88±140.55)ng/L,他汀组分别为(69.54±8.84)ng/L和(1 518.58±136.69)ng/L,均比模型组的(110.00±7.26)ng/L和(2 002.66±195.57)ng/L显著降低(P<0.05)。结论 ATRA具有抗AS的作用,其机制可能与ATRA的炎症免疫调节作用有关。
颈动脉粥样硬化; 全反式维甲酸; 转化生长因子-β1; 炎症
动脉粥样硬化(atherosclerosis,AS)是动脉粥样硬化性脑梗死(atherosclerotic cerebral infarction,ACI)的主要病理基础,颈AS的进展、斑块的形成与破裂和继发的血栓形成(即易损斑块)是导致ACI的主要原因[1]。因此,抗AS治疗是预防和治疗ACI的主要措施之一,虽然临床上针对AS的治疗方法很多,但结果仍不够理想,寻求新的治疗靶点和新的药物迫在眉睫。炎症反应在AS的形成和发展过程中发挥了重要作用[2],研究显示全反式维甲酸(all-trans-ratinoic acid,ATRA)在炎症及免疫反应中有着重要的调控作用[3]。本文旨在通过建立兔颈AS模型,观察ATRA对AS影响,探讨ATRA对颈AS中炎症反应的机制,为新药开发和临床用药提供理论基础。
1 材料与方法
1.1 实验动物
健康雄性新西兰大白兔34只,80 d龄,体质量(2.0±0.3)kg,广州中医药大学实验动物中心提供,生产许可证号SCXK(粤)2013-0085。
1.2 试剂、药品和主要仪器
基础饲料(广州花东信华实验动物养殖场);胆固醇(广州拓科达生物科技有限公司);兔转化生长因子-β1(TGF-β1)、白介素-6(IL-6)、白介素-10(IL-10)、白介素-17(IL-17)酶联免疫吸附测定(ELISA)试剂盒(上海邦奕生物科技有限公司);ATRA(山东良福制药有限公司,批号2012014);辛伐他汀(杭州默沙东制药有限公司20130146);奥林巴斯BX51生物显微镜(日本奥林巴斯株式会社);HITACHI 7180全自动生化分析仪(日本Hitachi公司)。
1.3 动物模型制备与分组
将健康纯种雄性新西兰白兔34只随机分为4组:空白对照组(正常组)6只、模型组8只、辛伐他汀治疗组(他汀组)10只、ATRA治疗组(ATRA组)10只。正常组每日每只给予基础饲料150 g,其余各组每日每只给予150 g高脂饲料(内含2%胆固醇、0.5%胆酸钠、15%蛋黄粉、10%猪油、72.5%基础饲料),4组均自由饮水,饲养12周。
他汀组和ATRA组高脂饲料饲养4周后开始灌胃给药。他汀组予以辛伐他汀片按2 mg/(kg·d)给药,稀释于1.5 mL生理盐水灌胃8周,直至实验结束。ATRA组予以ATRA 20 mg/d溶于1.5 mL植物油中灌胃8周,直至实验结束。模型组不使用任何药物,但与治疗组在相同时间予以等量生理盐水灌胃8周,直至实验结束。
1.4 血清血脂和炎症细胞因子测定
各组动物于实验12周末穿刺心脏采血,常温静置30 min后,3 000 r/min离心15 min,取上层血清,测定血清中总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)的浓度。采用ELISA试剂盒测定血清中TGF-β1、IL-6、IL-10、IL-17的水平,严格按照试剂盒和酶标仪说明书步骤进行操作。
1.5 血管形态学观察及测定
实验结束,处死动物,取约1.0 cm的颈动脉病变血管等距离切为3~4段,10%(φ)甲醛缓冲溶液固定,石蜡包埋。将病变血管横切面(3~4 μm)行HE染色,光学显微镜下观察管壁结构。
1.6 统计学分析
2 结果
2.1 血脂水平变化情况
表1结果显示,与正常组比较,模型组和ATRA组的TG、TC和LDL-C显著增高(P<0.05);他汀组的TC和LDL-C显著增高(P<0.05)。与模型组比较,ATRA组的TG、TC和LDL-C水平无明显下降(P>0.05);他汀组的TG、TC和LDL-C水平则明显下降(P<0.05)。
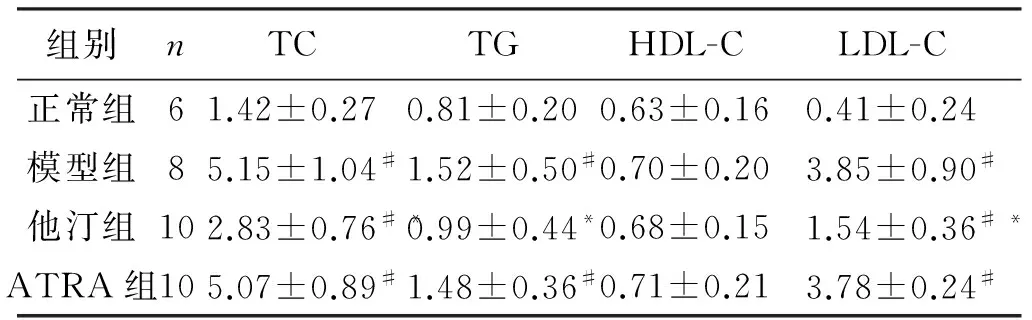
表1 各组兔血清血脂水平比较
与正常组比较,#P<0.05; 与模型组比较:*P<0.05。
2.2 血管组织形态情况2.2.1 肉眼大体观察 肉眼可见正常组兔颈动脉血管管壁光滑,柔软有弹性;模型组兔颈动脉血管管壁增厚、僵硬,可见脂质点及脂质条纹,可见动脉粥样硬化斑块形成。他汀组、ATRA组兔颈动脉血管管壁增厚,略僵硬,偶可见脂质点,与正常组比较病变较轻。2.2.2 显微镜下观察 经HE染色后显示,正常组颈动脉的内皮细胞形态完整,排列整齐,内弹力纤维膜清晰完好,动脉中膜平滑肌细胞排列整齐,形态规则,未见明显斑块形成;模型组颈动脉可见典型的AS斑块,内有纤维帽及脂质核心,以及大量炎性细胞浸润,内弹力纤维膜断裂,平滑肌细胞迁移至内膜下,动脉中膜可见泡沫细胞及胆固醇结晶。他汀组及ATRA组可见内皮细胞形态尚完整,部分中断,内弹力纤维膜清晰完好,可见部分平滑肌细胞迁移至内膜下,动脉中膜平滑肌细胞排列尚整齐,可见部分泡沫细胞形成及少量炎性细胞浸润。

A.正常组; B.模型组; C.他汀组; D. ATRA组。
图1 实验12周各组兔颈动脉血管HE染色(100×)
Figure 1 Morphology of rabbit carotid artery in different groups at 12 weeks (100×)
2.3 血清TGF-β1和IL-10水平检测结果
如表2结果所示,与正常组比较,模型组血清TGF-β1和IL-10水平显著降低(P<0.05);与模型组相比,他汀组及ATRA组血清TGF-β1和IL-10水平显著增高(P<0.05);ATRA组与他汀组比较,血清TGF-β1和IL-10水平差异无统计学意义(P>0.05)。
2.4 血清IL-6和IL-17水平检测结果
表2结果显示,与正常组比较,模型组血清IL-6和IL-17水平显著升高(P<0.05);与模型组比较,他汀组和ATRA组血清IL-6和IL-17水平显著降低(P<0.05)。
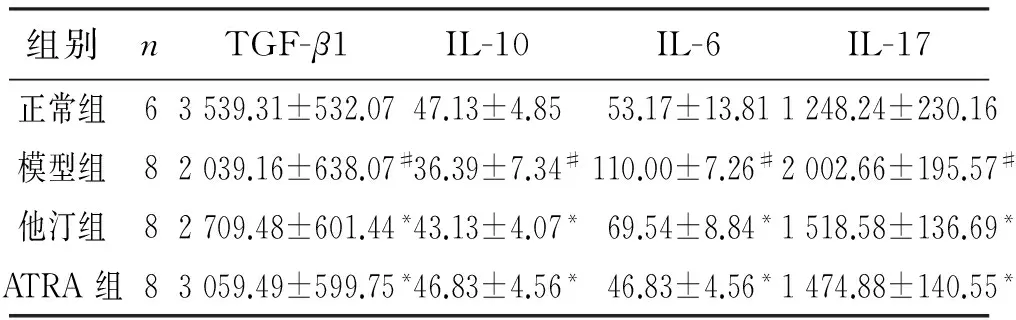
表2 各组兔血清TGF-β1 ELISA检测结果
与正常组比较:#P<0.05; 与模型组比较:*P<0.05。
3 讨论
AS是以血管壁内脂质蓄积、纤维成分增加和血管壁慢性炎症为主要特征[4],炎症反应是AS发病的决定因素,贯穿了AS的形成和发展过程,因此抑制炎症反应是抗AS的重要环节。
ATRA是一种天然维生素A的主要衍生物,ATRA通过与胞核上的受体结合,发挥对组织及细胞的抑制增生、诱导分化和调节凋亡的作用,且对于多种细胞因子、生长因子和激酶等都具有很强的调控增生、诱导分化的作用,是一种较强的分化诱导剂,在炎症及免疫反应中有着重要的调控作用[3]。近年来,有ATRA类药物应用于预防和治疗AS和动脉管腔狭窄的动物实验报道,但对AS的形成与发展中炎症反应的抑制作用鲜有报道。
本研究结果显示,兔经过高脂饲料饲养12周后其颈动脉肉眼及镜下所见典型的AS斑块形成,内弹力纤维膜断裂,平滑肌细胞迁移至内膜下,动脉中膜可见泡沫细胞及胆固醇结晶,管腔狭窄,证明造模成功。模型组及治疗组镜下均可观察到炎症细胞浸润,证实了炎症介质参与了血管炎症反应,参与了AS斑块的形成。ATRA组及他汀组内皮细胞形态完整,内弹力纤维膜清晰完好,部分平滑肌细胞迁移至内膜下,动脉中膜平滑肌细胞排列整齐,部分泡沫细胞形成及少量炎性细胞浸润,未见斑块形成,提示ATRA及辛伐他汀均可以抑制内膜增生及平滑肌细胞的迁移,具有抗AS的作用,但ATRA抗AS作用的具体机制尚未清楚。
TGF-β1是多功能细胞因子,对炎症因子具有调节作用。研究发现TGF-β1作用于血管平滑肌细胞从而影响血管的生成及维持血管壁的正常结构,可逆转及改善AS[5]。另外,在内皮细胞中,TGF-β1通过抑制黏附因子E-选择素的表达,从而抑制内皮细胞活化,使淋巴细胞募集减少;抑制巨噬细胞摄取脂肪颗粒,减少泡沫细胞的形成[6]。TGF-β1促使调节性T细胞分化成熟,降低细胞毒性T细胞对正常细胞和组织的杀伤,从而减轻炎症反应[7]。内皮细胞活化和泡沫细胞的形成是AS早期的表现,可见TGF-β1在AS早期就具有抗AS的作用。
IL-10作为调节性T细胞产生的主要抗炎因子之一,可抑制效应性T细胞、巨噬细胞、肥大细胞等炎症细胞的激活,在AS进程中同样发挥了重要作用[8]。
TGF-β1及IL-10的水平上升可抑制致病性的免疫反应激活,抑制AS的发生发展,反之,TGF-β1及IL-10的水平下降可加重AS斑块内炎症细胞的浸润,促炎因子合成增多,增加胶原的降解,加速易损斑块的形成[9]。前期临床研究也证实TGF-β1水平降低可加剧AS的进展、颈动脉斑块的易损性增加,导致脑梗死的发生[10]。
本研究结果表明兔经过高脂饲料饲养12周后,随着AS的不断发生发展,AS斑块形成,模型组血清抗炎因子TGF-β1和IL-10水平明显下降,Th17细胞分泌的促炎因子IL-6、IL-17水平明显上升,经过他汀及ATRA的干预治疗,血清抗炎因子TGF-β1和IL-10水平明显升高,Th17细胞分泌的促炎因子IL-6、IL-17水平明显下降。提示ATRA具有促进AS斑块内调节性T细胞的聚集,并抑制T细胞向Th17表型的转化,从而降低效应性T细胞对正常细胞及组织的杀伤,减轻局部的炎症反应。
本研究还显示,与他汀类药物主要通过有效降低LDL-C的水平从而发挥抗AS作用不同,ATRA并未降低血清LDL-C的水平,提示ATRA的抗AS作用不依赖于血脂的改变,主要通过抑制动脉局部的炎症反应,在AS的不同阶段均具有抗AS作用。
综上所述,ATRA具有抗AS的作用,其机制可能与ATRA提升血清抗炎因子、降低促炎因子水平的炎症免疫调节作用有关。但炎性因子众多,炎症反应复杂,其抗AS作用的确切机制还有待进一步研究。
[1] GONZALEZ N R,LIEBESKING D S,DUSICK J R,et al. Intracranial arterial stenoses:current viewpoints,novel approaches,and surgical perspectives [J]. Neurosurg Rev,2013,36(2):175-185.
[2] CONTI P,SHAIK-DASTHAGIRISAEB Y. Atherosclerosis:a chronic inflammatory disease mediated by mast cells [J]. Cent Eur J Immunol,2015,40(3):380-386.
[3] ADAMS J,KISS E,ARROYO A B,et al. 13-cis retinoic acid inhibits development and progression of chronic allograft nephropathy [J]. Am J Pathol,2005,167(1):285-298.
[4] FINN A V,NAKANAO M,NARULA J,et al. Concept of vulnerable/unstable plaque [J]. Arterioscler Thromb Vasc Biol,2010,30(7):1282-1292.
[5] PASITHORN A,SUWANABO L,STEPHEN M S,et al. TGF-βincreases vascular smooth muscle cell proliferation through the Smad 3 and ERK MAPK pathways [J]. J Vasc Surg,2012,56(2):446-454.
[6] FRUTKIN A D,OTSUKA G,STEMPIEN A,et al. TGF-β1 limits plaque growth,stabilizes plaque structure,and prevents aortic dilation in apolipoproteinE-null mice [J]. Arterioscler Thromb Vasc Biol,2009,29(9):1251-1257.
[7] TAKIMOTO T,WAKABAYASHI Y,SEKIYA T,et al. Smad2 and Smad3 are redundantly essential for the TGF beta media ted regulation of regulatory T plasticity and Th1 development[J]. J Immunol,2010,185(2):842-855.
[8] KLEEMANN R,ZADELARR S,KOOISTRA T. Cytokines and atherosclerosis:a comprehensive review of studies in mice [J]. Carbohydr Res,2008,79(3):360-376.
[9] TOUSOULIS D,OIKONOMOU E,ECONOMOU E K,et al. Inflammatory cytokines in atherosclerosis:current therapeutic approaches [J]. Eur Heart,2016,759(2):759-762.
[10] 彭忠兴,甄毅锋,陈瑞芳,等.转化生长因子-β1和斑块稳定性与动脉粥样硬化脑梗死关系的研究[J].实用医学杂志,2011,27(22):4043-4045.
(责任编辑:幸建华)
Effect of all-trans retinoic acid on the atherosclerotic plaque and inflammatory response in carotid artery of rabbits
PENG Zhongxing,LI Xiang,DIAO Shengpeng,HUANG Yeqing,CHENG Jing,LIU Aiqun,WEI Zhisheng,YU Qingyun,HONG Mingfan
(DepartmentofNeurology,theFirstAffiliatedHospitalofGuangdongPharmaceuticalUniversity,Guangzhou510080,China)
Objective To investigate the effect and mechanism of all-trans retinoic acid (ATRA) on the development of atherosclerotic plaque and the expression of TGF-β1,IL-6,IL-10 and IL-17 on the rabbit carotid atherosclerosis model. Method 34 male New Zealand rabbits were randomly divided into four groups,including the normal group,the model group,statin group and ATRA group. The normal group was given basic feed,and other groups were fed with high fat diet. After 4 weeks,rabbits were treated intragastrically with simvastatin D at 2 mg/kg per day or ATRA at 20 g/day. The atherosclerotic plaque and inflammatory response in carotid artery were examined at the end of 12 weeks. Meanwhile,the serum levels of lipids,TGF-β1,IL-6,IL-10 and IL-17 were measured. Result The AS plaque and broken intima were observed in the model groups. The endothelial cell morphology and endometrium were intact in statin- and ATRA-treated groups. Compared with the model group,the levels of TGF-β1 and IL-10 were significantly increased in ATRA group (3 059.49±599.75) and (46.83±4.56)ng/L and statin group (2 709.48±601.44) and(43.13±4.07)ng/L. By contrast,the levels of IL-6 and IL-17 were significantly lowered in ATRA group (64.92±6.64) and (1 474.88±140.55)ng/L and statin group (69.54±8.84) and (1 518.58±136.69)ng/L. Conclusion ATRA ameliorates the development of atherosclerosis in rabbit model,which may be related to reduction of the inflammatory response.
carotid atherosclerosis; all-trans retinoic acid; TGF-β1; inflammation
2016-06-19
广东药学院科技处-附属第一医院联合自然科学培育基金项目(GYFYLH201322)
彭忠兴,男,硕士,主任医师,主要从事脑血管病的基础和临床研究,Email:pzx802@163.com。
时间:2016-10-21 11:10:58
http://www.cnki.net/kcms/detail/44.1413.R.20161021.1110.001.html
R965
A
1006-8783(2016)05-0639-04
10.16809/j.cnki.1006-8783.2016061902

