茎瘤芥(榨菜)子叶及带下胚轴茎段离体培养研究
朱学栋,何晓蓉,刘华强,杨 霞,朱菲菲,周春江
(重庆市渝东南农业科学院中心实验室,重庆涪陵408000)
茎瘤芥(榨菜)子叶及带下胚轴茎段离体培养研究
朱学栋,何晓蓉,刘华强,杨霞,朱菲菲,周春江
(重庆市渝东南农业科学院中心实验室,重庆涪陵408000)
摘 要:以茎瘤芥永安小叶品种无菌苗子叶和带下胚轴茎段为材料,初步探索愈伤组织诱导、分化及再生植株生根培养.结果表明,子叶与叶柄的切口处极易产生愈伤组织,在MS+1.0mg·L-16-BA+0.2mg·L-1NAA培养基中,愈伤组织分化率达到64%,其不定芽量最大;1/2MS+0.6mg·L-1IBA培养基对不定根形成最为有利,生根率可达到96%.
关键词:子叶;愈伤组织;分化;生根
茎瘤芥(Brassica juncea var.tumida Tsen et Lee)是十字花科(Cruciferae)芸薹属(Brassica)芥菜种叶芥亚种大叶芥变种的变种,其最初由野生芥菜(Brassica juncea)进化而来.
自20世纪70年代至今,芸薹属作物组织培养技术取得了很大进展,在芥菜、甘蓝型油菜、甘蓝、白菜、花椰菜等一系列物种上都建立了较好的再生体系.尽管白菜型油菜(B.campestris),包括大白菜(B.campestris ssp.pekinensis)、白菜(B.campestris ssp.chinemis)等是组织培养比较困难的一些品种,但到目前为止,白菜等一些蔬菜已经获得了组织培养较高的再生体系频率.
我国对芸薹属作物离体培养研究起步较晚,张智奇等[1]以小白菜的子叶为外植体、候喜林等[2]以不结球白菜的矮脚黄品种的子叶为外植体进行离体培养的时候,均发现了器官不经过愈伤组织诱导而直接分化成不定芽的结果.1991年雷建军等[3]对中国芥菜的器官培养进行了研究,发现基因型、外植体、生理状态对器官培养植株再生都有很大影响.陈利萍等[4]在2004年利用组织培养技术辅助茎用芥菜育种,解决了大株留种困难、性状鉴定时需牺牲亲本等问题,也可解决育种过程遇到温度过高、水分不足或虫害等不良自然条件而无法正常收获种子时的种质资源保存和繁殖的问题.张艳梅等[5]在榨菜下胚轴愈伤组织诱导及分化中得到了较高频的愈伤组织诱导率及分化率.孙全等[6]用正交试验优选茎瘤芥子叶组培诱导培养基研究中筛选出了子叶诱导的最佳培养基为MS+6-BA 3.0mg·L-1+NAA 0.10 mg·L-1.
植物材料的基因类型直接影响着离体培养的效果,不同材料再生能力不同[7],因此,作者选定一个供试品种,从愈伤组织诱导、不定芽分化、生根培养角度研究茎瘤芥组织培养技术,为今后茎瘤芥诱变育种、多倍体育种等茎瘤芥材料创制提供技术支撑.
1 材料与方法
1.1 供试材料
供试材料为重庆市涪陵区本地品种永安小叶,材料由重庆市渝东南农业科学院提供.
1.2 实验方法
1.2.1 无菌苗诱导
将永安小叶种子在自来水下冲洗2h.清洗干净后拿到无菌操作台升汞消毒7min(此过程需要不停地震荡),无菌水清洗5遍后接种在无菌苗诱导培养基上.无菌苗诱导培养基为1/2MS+琼脂5.5g·L-1,温度(25±2)℃,光照12h·d-1.
1.2.2 愈伤组织诱导和不定芽分化
诱导和分化培养基均以MS为基本培养基,添加质量分数为0.55%的琼脂、3%的蔗糖,以及添加不同浓度的NAA(0.1、0.2)mg·L-1+6-BA(0.5、1.0、1.5、2.0)mg·L-1,调节pH为5.8.考察不同激素配比对愈伤组织诱导和不定芽分化的影响.无菌苗子叶每瓶接种10片,(25±2)℃,暗培养;带下胚轴茎段每瓶接种6个,(25±2)℃,光照12h·d-1,分别接种在上述不同激素配比的培养基中.30d后统计愈伤组织诱导率及不定芽分化率.
1.2.3 生根培养
生根培养以1/2MS为基本培养基,附加质量分数为0.55%的琼脂、2%的蔗糖,添加不同浓度的IBA(0.2、0.4、0.6、0.8)mg·L-1或NAA(0.2、0.4、0.6、0.8)mg·L-1.每瓶培养基接种高度2cm左右的不定芽小苗5~7根.暗培养3d后光照培养,光照12h·d-1,培养30d后统计生根率.
1.2.4 炼苗和移栽
将已生根的小苗移到玻璃温室,不开盖炼苗7d,打开盖子,炼苗4d,用清水将小苗根部的培养基洗净,移栽到装有普通营养土的花钵中,遮阴,保持土质湿润,温度控制在27℃左右,其余常规管理.
1.2.5 实验材料编号
实验编号由“主编号-副编号”组成,主编号由实验材料决定,子叶材料编号为1,带下胚轴茎段编号为2,再生植株编号为3,副编号由实验所使用的激素浓度决定,由激素浓度由低到高依次编号.
2 结果与分析
2.1 不同浓度激素配比对子叶愈伤组织和不定芽分化的影响
愈伤组织诱导和不定芽分化中添加不同浓度的6-BA和NAA组合后,出愈率和分化率见表1.
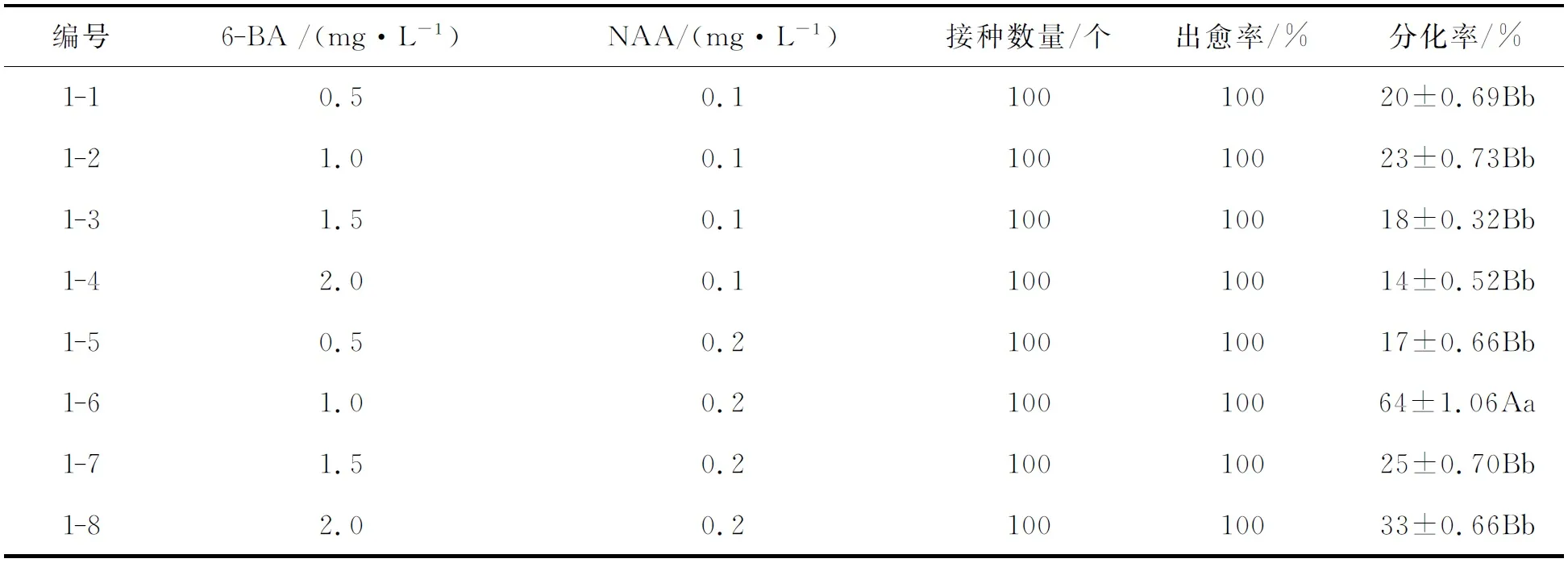
表1 不同浓度的激素对子叶愈伤组织和不定芽分化的影响Tab.1 Effects of the cotyledon callus and adventitious bud differentiation by different hormone concentration
由表1可以看出,子叶接种在培养基上暗培养30d后子叶出愈率可达到100%,主要在子叶与子叶柄切口处形成大量淡黄色愈伤组织,愈伤量小,且伴有大量的毛状根的形成.不定芽分化率均不高,最高分化率为编号1-6,分化率达到64%,激素用量为1.0mg·L-16-BA+0.2mg·L-1NAA;最低分化率为编号1-4,分化率达到14%,激素用量为2.0mg·L-16-BA+0.1mg·L-1NAA.从表1中可以看出,NAA用量一定的情况下,随着6-BA浓度的升高,分化率先升高后降低,说明过高浓度的6-BA对愈伤组织分化有一定的抑制作用;在6-BA浓度一定的情况下,随着NAA浓度的升高,分化率有一定的提高,说明适当提高NAA浓度有利于愈伤组织不定芽的分化.
2.2 不同浓度的激素对带下胚轴茎段出苗率的影响
将带下胚轴的茎段接种在不同浓度梯度的MS培养基种,出苗率及植株长势见表2.
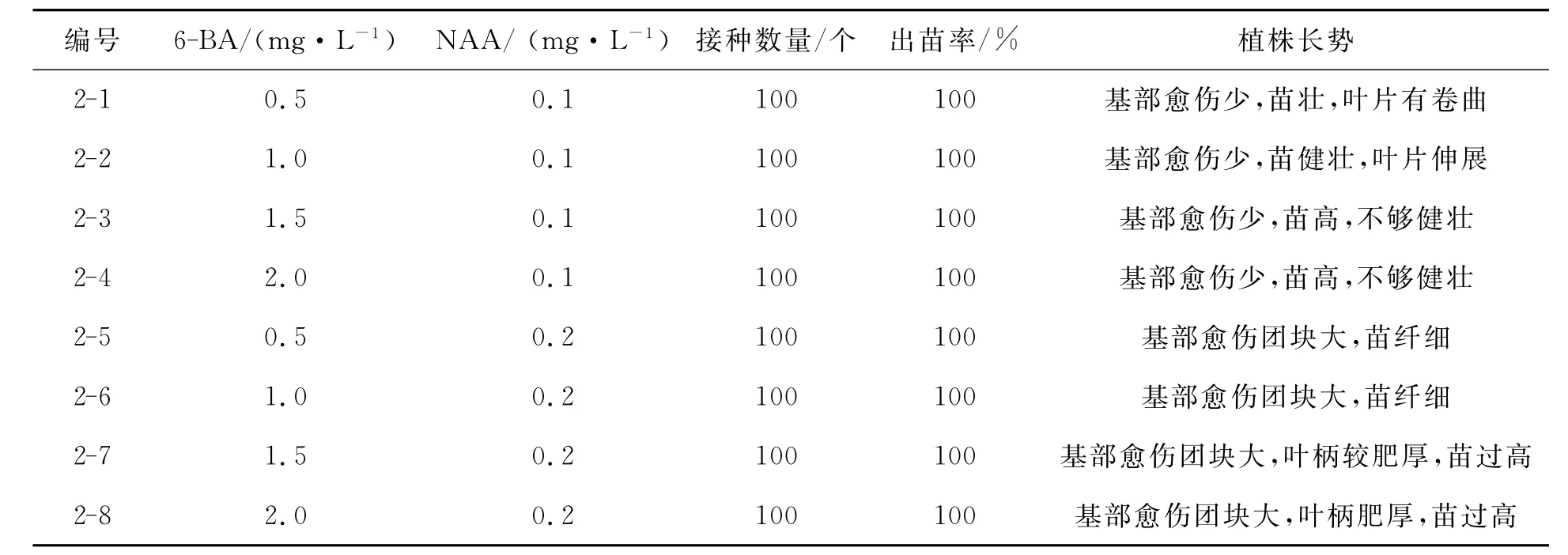
表2 不同浓度的激素对带下胚轴茎段出苗率的影响Tab.2 Effect of the hypocotyl stem section under emergence rate by different hormone concentration
由表2可以看出,在不同浓度梯度的激素配比下带下胚轴的茎段均能出苗,出苗率达到100%,且在基部均有愈伤组织的生成,NAA用量的提高,基部愈伤组织的量明显增加;在NAA浓度不变的情况下,随着6-BA浓度的提高,再生小苗高度增加,叶柄肥厚,叶片细长;在低浓度的6-BA作用下叶片大,小苗较为健壮.在激素浓度为1.0mg·L-16-BA+0.1mg·L-1NAA的作用下,小苗长势最好.
2.3 生根情况
将长高至3cm左右的再生小苗接种含有不同浓度激素的1/2MS培养基上,生根结果见表3.
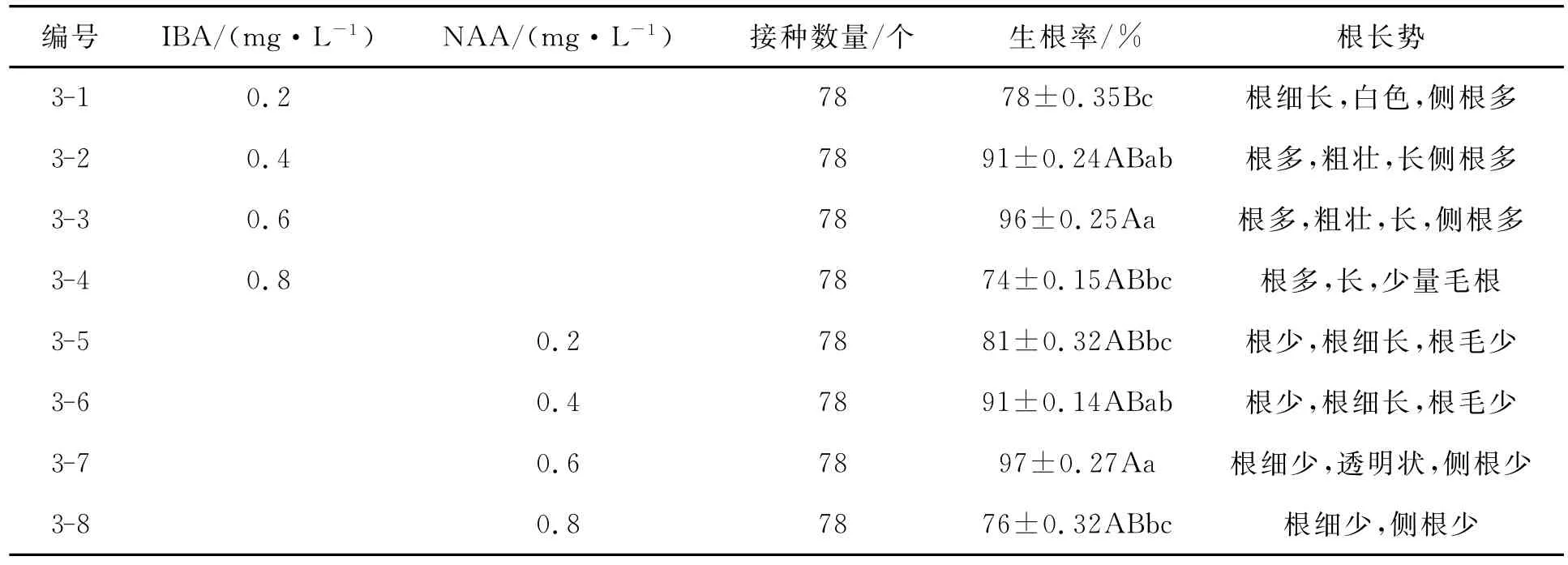
表3 不同浓度的激素对组培苗生根的影响Tab.3 Effect of rooting by different hormone concentration
由表3可看出,IBA和NAA均能不同程度地诱导再生植株生根,最高生根率为添加0.6mg·L-1的NAA,达到97%;最低生根率为添加0.8mg·L-1的IBA,达到74%.随着IBA和NAA浓度的提高,生根率出现先升高后降低的趋势,均在用量为0.6mg·L-1时达到最大生根率,说明高浓度的生长素会抑制再生植株的生根.采用IBA和NAA诱导的再生植株生根基本一致,但根的长势IBA整体情况较好,IBA诱导的生根根多、长、粗壮、侧根较多;NAA诱导根细长、少、侧根少.因此,采用0.6mg·L-1IBA对再生植株诱导生根效果最佳.
2.4 炼苗移栽结果
不定芽生根培养30d以后,将小苗移到玻璃温室中,不开盖炼苗7d,打开盖子,炼苗4d,用清水将小苗根部的培养基洗净,移栽到花钵中,保持水分充足,3d后叶片完全展开,叶色饱满,生长正常,移栽成活率达到98%以上.
3 讨 论
以永安小叶无菌苗子叶和带下胚轴茎段为供试材料,子叶连接叶柄切口处极易形成愈伤组织,但愈伤组织量小、淡黄色,且伴有毛状根的形成;20d后分化出再生植株,下胚轴茎段接种后7d左右即可观察到生长点长出真叶,且长势良好.沈进娟等[8]使用涪陵当地“永安小叶”“郫县榨菜”“蔺市草腰子”3个地方品种进行不定芽诱导,发现植株再生频率与材料基因型有密切的关系.Takasaki等[9]曾报道在白菜子叶培养中BA和NAA是必不可少的激素,而甘蓝型油菜的子叶培养,只有BA是必需激素,不同种类的生长素的作用有明显差异.该实验愈伤组织诱导分化只采用了NAA作为唯一的生长激素,当激素配比达到1.0mg·L-16-BA+0.2mg·L-1NAA时,最高分化率达到64%.Chi等[10]在菜心离体培养中加入AgNO3和ABA,可有效抑制不定根的形成,从而有利于愈伤组织不定芽的分化,陈石头[11]在榨菜带柄子叶分化中添加5mg·L-1AgNO3,能有效提高带柄子叶的分化效率,张鹏等[12]也有类似的研究结论.该实验并未验证该法,有待进一步实验.
该实验在子叶诱导愈伤组织分化的过程中发现再生植株易出现玻璃化苗、畸形苗现象.陈国菊[13]在芥菜离体培养中玻璃化机制进行了深入研究,但并未给出如何控制离体培养中的玻璃化现象,笔者通过降低温度调整效果不明显,现阶段正通过调整培养基成分来控制玻璃化现象,结果尚不明确,而带下胚轴茎段在培养温度不高于27℃条件下培养,可有效抑制玻璃化苗的产生.因此,子叶诱导愈伤组织再分化过程还需要进一步研究,以期获得高频的愈伤组织诱导再生植株.
参考文献:
[1] 张智奇,周音,张玉华,等.小内菜子叶诱导不定芽再生植株[J].上海农业学报,1998,14(2):25-28.
[2] 候喜林,哲寿裕.不结球白菜子叶离体培养再生植株[J].南京农业大学学报,1994,17(4):60-64.
[3] 雷建军,陈世儒,郭余龙,等.茎用芥菜的原生质体培养及植株再生[J].植物学报,1991,33(2):91-97.
[4] 陈利萍,李春顺,戈加欣.利用组织培养技术辅助茎用芥菜育种[J].中国蔬菜,2005(3):22-23.
[5] 张艳梅,于锡宏,蒋欣梅,等.榨菜下胚轴离体培养植株再生体系的建立[J].湖北农业科学,2012,51(16):3628-3631.
[6] 孙全,朱小燕,梁婷,等.应用正交试验优选茎瘤芥子叶组培诱导培养基[J].安徽农业科学,2011,39(34):20962-21020.
[7] 吴慧敏,何勇,邵泱峰,等.叶用芥菜小孢子离体培养条件[J].浙江农林大学学报,2014,31(2):315-321.
[8] 沈进娟,范永红,冷容,等.茎瘤芥(榨菜)高效离体再生体系的建立[J].生物技术通报,2012,5:71-75.
[9] TAKASAKI T,HATAKEYAMA K,OJIMA K,et al.Effects of various factors(hormone combinations,genotypes and antibiotics)on shoot regeneration from cotyledon explants in Brassica rapa[J].Plant Tissue Culture Letter,1996,13:177-180.
[10] CHI G L,BARFIELD D G,SIM G E,et al.Effect of AgNO3and amino-ethoxyvinylglycine on in vitro shoot and root organogenesis from seedling explants of recalcitrant Brassica genotypes[J].Plant Cell Reports,1990,9(4):195-198.
[11] 陈石头,余小林,曹家树,等.榨菜子叶和带柄子叶再生植株的研究[J].浙江农业学报,2005,17(1):27-30.
[12] 张鹏,凌定厚.提高菜心离体植株再生频率的研究[J].植物学报,1995,37(11):902-908.
[13] 陈国菊,雷建军.芥菜离体培养中玻璃化机理的研究[J].西南农业大学学报,2000,22(3):237-239.
(责任编辑 于 敏)
The study of cotyledon and hypocotyl with stem
on Brassica juncea var.tumida Tsen et Lee in vitro culture
ZHU Xuedong,HE Xiaorong,LIU Huaqiang,YANG Xia,ZHU Feifei,ZHOU Chunjiang (The Central Laboratory of Southeast of Chongqing Academy of Agricultural Sciences,Fuling 400800,China)
Abstract:Cotyledon and hypocotyl stem section under as materials of Brassica juncea var. tumida Tsen et Lee named Yongan Xiaoye,are used to explore callus induction,differentiation and regeneration plant rooting culture preliminarily.The results showed that the slit of cotyledon and petiole produce callus.Cultured in MS+1.0mg·L-16-BA+0.2mg·L-1NAA medium,the callus differentiation rate reached to 64%.In 1/2MS+0.6mg·L-1IBA medium for adventitious root formation is most favorable,the rooting rate reached to 96%.
Key words:cotyledons;callus;differentiation;rooting
doi:10.3969/j.issn.1000-2162.2016.01.014
作者简介:朱学栋(1984-),男,甘肃兰州人,重庆市渝东南农业科学院助理研究员,硕士.
基金项目:重庆市涪陵区科委项目(FLKJ,2014ABB2066)
收稿日期:2015-05-08
中图分类号:O156
文献标志码:A
文章编号:1000-2162(2016)01-0086-05

