青海牧区57份自制牦牛乳制品中产EPS乳酸菌的分离鉴定及特性研究
唐超群,永 胜,朱徳锐,刘 静,双 杰
(青海大学医学院)
青海牧区57份自制牦牛乳制品中产EPS乳酸菌的分离鉴定及特性研究
唐超群,永 胜,朱徳锐,刘 静,双 杰*
(青海大学医学院)
目的 从青海牧区牧民家庭自制牦牛乳制品(酸奶、曲拉)中分离产EPS乳酸菌,得到青海地区产EPS乳酸菌种群系统发育树,并鉴定高产EPS乳酸菌,为后期产EPS乳酸菌在乳品工业中的开发及利用提供理论基础。方法 随机采集样本,乳酸菌采用CaCO3的MRS平板法分离,以形态结合生化实验初筛,用分子生物学方法即16s rDNA序列测定、NCBI数据库BLAST比对,构建系统进化树,最终确定乳酸菌种属;用苯酚-硫酸法对乳酸菌进行多糖产量定量分析;用琼脂扩散法行抑菌试验。模拟体外胃肠道环境完成生长实验。结果 从57份样品中分离出纯菌种86株,生化试验结合16s rDNA分析确定乳酸菌菌株52株,归属于5个菌属,分别是嗜热乳酸链球菌(33株)、粪肠球菌(6株)、侧孢短芽孢杆菌(4株)、干酪乳杆菌(5株)、嗜酸乳杆菌(4株);产EPS菌株为31株,以嗜热链球菌为主,EPS浓度为(16.09±5.39)mg/L,最高浓度达28.83 mg/L,产量最高的是嗜热链球菌,来自果洛州;抑菌试验中的52株乳酸菌菌株对四种致病菌均有抑制作用,排除强酸和H2O2干扰后,有部分菌株无抑菌圈,且所有菌株抑制病原菌生长的能力较弱。模拟胃肠道生存实验中,不同时间生存率有差异,χ2=247.87(秩和检验值=卡方值),P<0.01,存活率中位数(四分位数间距,%)为:模拟胃液3 h为92.70(91.75,93.54)、肠液3 h为88.54(87.99,89.18)、肠液6 h为84.36(83.21,86.28)、肠液12 h为76.02(74.42,77.21)、肠液24 h为65.43(64.32,66.94),存活率随时间的延长而降低。结论 青海传统牦牛发酵乳中主要的优势乳酸菌为嗜热链球菌,其次为粪肠球菌和干酪乳杆菌;青海牧区传统牦牛发酵乳中乳酸菌产EPS产量相对较低;乳酸菌对四种肠道病原菌的抑制作用较弱,其中对大肠杆菌抑制作用最强;乳酸菌抵抗胃酸生长能力较强;在不同胃肠道生长环境(模拟)中乳酸菌存活率有差异;不同菌株间存活率不完全相同。
青海 牦牛 乳制品 EPS乳酸菌 特性
青海牦牛发酵乳中产胞外多糖(EPS)乳酸菌的种类、EPS产量与其他地区可能存在一定的差异,此次研究旨在发现产EPS乳酸菌的物种资源及优势菌种,获得青海地区乳酸菌产EPS含量的值域范围及其益生特性,为后期乳酸菌发酵制品的开发利用提供基础和依据。
1 材料与方法
1.1 样品采集
采集青海省四个牧区(果洛州、玉树州、黄南州、海北州)牧民家庭中的自制乳制品(曲拉、酸奶)于灭菌管中,密封好放入冰盒置冰箱(4℃)保存。
1.2 主要试剂与仪器选择
MRS(蛋白胨10.0g、肉膏10.0g、酵母浸粉5.0g、葡萄糖20.0g、磷酸氢二钾2.0g、柠檬酸氢二铵2.0g、碳酸钙20.0g、乙酸钠5.0g、硫酸镁·7H2O 0.2g、硫酸锰·4H2O 0.05g、吐温80 1.0mL、ddH2O 1000mL)固体(琼脂15.0g)、液体(琼脂7.5g)培养基;细菌生理生化鉴定试剂盒(北京陆桥生物制剂公司);细菌DNA提取试剂盒(上海赛百盛公司)。
电子天平(PL203 Mettler To-ledo 公司);小型高速冷冻离心机(5424型,德国Eppendorf公司);PCR仪(TX-XP,杭州博日公司);超纯水系统(HealForceEasy公司);恒温培养箱(ZHWY-100B,上海智城公司);恒温摇床 (ZD85,上海精达公司);无菌操作台(上海博讯公司)。
1.3 目标菌株筛选
将样品划线于含有0.75%CaCO3的MRS平板上,培养48 h(37℃),选出菌落周围形成透明圈的菌落,将革兰阳性菌株继续划线于MRS平板,连续划线培养2次以上直至确定为纯菌,并记录菌落的形态特征,纯化后的菌株接种到MRS斜面培养基后,置冰箱(4℃)保存。
1.4 单个菌落涂片革兰染色、H2O2酶实验及生化实验
革兰染色方法:结晶紫初染1 min,用无菌双蒸水冲洗后以碘液媒染1 min;用无菌双蒸水冲洗后以95%酒精脱色30 s;用无菌双蒸水冲洗后以碱性伊红复染30 s。油镜下观察形态,记录镜下观察结果(形态、大小、革兰染色结果等)。
将革兰阳性、过氧化氢酶实验阴性的纯菌菌株初步确定为乳酸菌。通过生理生化实验结合形态特征对乳酸菌进行种鉴定,并对16S rDNA鉴定结果进行验证。
1.5 牦牛乳制品中乳酸菌总DNA分离提取和16S rDNA鉴定
1.5.1 酸奶样品的前处理
将已分离得到的纯菌用脱脂乳液体培养基活化培养3 d后,取带菌脱脂乳样品5 mL离心(4℃,2000r/min)5 min,收集上清液;将上清液离心(4℃,8000r/min)10 min,去上清液,收集细胞用2%柠檬酸钠洗净。
1.5.2 DNA提取、基因测序分析
将酸奶样品细胞(1g)与2%无菌柠檬酸钠溶液(9mL)混合,混合均匀放置2 min,将分离的乳酸菌菌株用生物试剂盒方法提取菌体总DNA,利用上下游通用引物,扩增16S rDNA(PCR,用1%琼脂糖凝胶电泳检测),-80 ℃保存。
将分离得到的乳酸菌总扩增产物送生物工程公司行16S rDNA测序分析。将测序序列用GenBanK中的Blast程序进行同源性比较,采用DNA MAN和Clustalx l.83b软件比对分析序列后,用MEGA6.0软件,采用Neighbor-Joining法构建乳酸菌系统发育树。
1.6 生长特性实验
将待测菌株过夜培养,至OD600值达1.20左右。纯活菌划线接种于不同NaCl浓度梯度(0、2%、4%、6%、8%、10%和15%)、不同温度(10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃)、不同pH值(3、4.5、6、7、8、9)的MRS固体培养基中,每个梯度设3个平行组,恒温振荡培养(37℃,20h),观察菌落生长情况。
1.7 EPS分离提纯
1.7.1 分离
将分离得到的乳酸菌接种到经灭菌的MRS培养基中,培养活化(37℃,2~3次)。将活化后的菌液调整菌数到2×108CFU/mL,再按2%的接种量分别接种杆菌和球菌到2 mL MRS的培养基中。37 ℃发酵培养24 h后离心 (4℃,10000r/min)10 min,取上清液。加入4倍体积95%冷乙醇于上清液中,过夜沉淀(4℃),离心(4℃,12000r/min)6 min,收集沉淀。再加入2 mL 45 ℃热的超纯水溶解,并装入分子量为8000~14000的透析袋中放置冰箱(4℃)透析24 h,每天换3次水(每隔8 h换水1次),定容测定多糖含量。
1.7.2 糖含量测定
采用苯酚-硫酸法测定糖含量。
准确称取标准葡萄糖20 mg于500 mL容量瓶中,加水定容。各种试剂按照表1所示的量加入试管中后,静置10 min,摇匀,室温放置20 min后于490 nm波长下检测吸光度。将2 mL蒸馏水同样处理后作空白对照。以OD值和多糖含量构建标准曲线。
表1 胞外多糖含量标准曲线

Table 1 The standard curve of Extracellular polysaccharide content
将纯化的多糖(1.7.1),按照标准曲线的测定程序,检测490 nm处的吸光值。根据标准曲线计算EPS的量,并筛选出高产EPS的乳酸菌菌株。
1.8 乳酸菌体外益生功能研究
1.8.1 抑菌能力研究
采用琼脂扩散法行抑菌试验。
乳酸菌发酵上清液准备:将乳酸菌活化两次,调整菌数(1×108CFU/mL),按2%的比例接种到3个不同的10 mL MRS液体培养基中(分别编号1、2、3,37℃下培养24h)。将乳酸菌发酵液离心10 min,取上清液。1、2号管上清液用1.0 mol/L的NaOH调整pH到6.5,排除酸的影响。2号管添加过氧化氢酶溶液(300U/mL,溶于PBS缓冲液),排除H2O2的影响。3号管上清液作为对照管,以2号管的抑菌直径作为实际抑菌结果。
将20 mL营养培养基或脑心浸液培养基(含0.75%琼脂)灭菌后冷却到45 ℃,分别接入已过夜培养的四种不同致病菌(大肠杆菌、金黄色葡萄球菌、李斯特菌、志贺氏菌),使其终浓度为1×106CFU/mL,混匀,倾倒到无菌培养皿中。冷却凝固后,用无菌打孔器在平板上打孔(8mm),孔内分别加入100 μL不同乳酸菌1、2、3号发酵液,4 ℃环境中扩散5 h后放置培养(37℃,24h),最后量取抑菌圈直径(扣除8mm孔径的大小)。
1.8.2 乳酸菌抵抗模拟胃肠道环境生长实验
根据规定[1],设定实验N0的基数为1×106CFU/mL。模拟胃液(pH=3):0.35 g胃蛋白酶溶于100 mL 0.2%的无菌生理盐水,用浓盐酸调节pH到3.0,过0.45 μm滤膜除菌。模拟肠液(pH=8): 0.1 g胰蛋白酶、1.8 g胆盐溶于无菌溶剂含1.1 g NaHCO3、0.2 g NaCl及100 mL蒸馏水,用0.5 mol/L的NaOH调整pH到8.0。溶液过0.45 μm滤膜除菌。
将已活化3次的菌液按10%的接种量接种到模拟胃液(pH=3)中,混匀,厌氧培养(37℃),分别在0、3 h取样做平板计数。在模拟胃液中培养3 h后,吸取I mL培养液接种到9 mL模拟肠液(pH=8)中(肠道的实际pH在6.8~7.3之间,所以加入的胃液可将肠液pH调至6.8~7.3之间),厌氧培养(37℃),分别在0、3、6、11、24 h即刻取样计数。
存活率(%)= (1g N1/1g N0)×100%
N1、N0分别代表经过模拟胃肠道培养后、前的乳酸菌数量。
1.9 统计学处理
数据处理采用SPSS19.0软件,计量资料采用方差分析,计数资料采用χ2检验/确切概率法,不服从正态分布的计量资料(如存活率)采用秩和检验,检验水准P=0.05。
2 结果
2.1 样本
2013年3月~2014年12月随机从青海果洛州、玉树州、黄南州、海北州四个牧区57户牧民家中无菌采集到传统自制牦牛发酵乳制品—曲拉和酸奶57份(表2),4 ℃保存。
表2 牦牛发酵乳制品地区分布
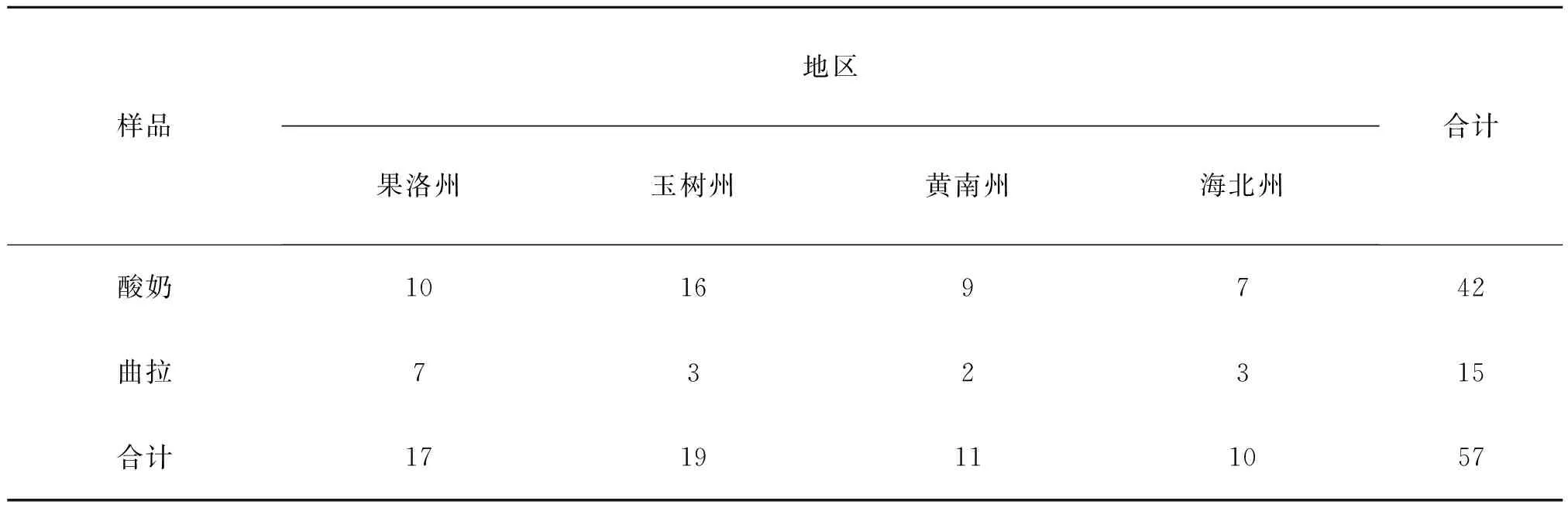
Table 2 The regional distribution of yak fermented dairy products
2.2 革兰染色及构建系统发育树
通过革兰染色从57份样品中分离到G+菌(镜下呈紫色或蓝色)纯菌种86株。其中球菌52株,杆菌34株。生化实验结合16s rDNA比对确定52株乳酸菌菌株,归属于5个菌属,分别是嗜热乳酸链球菌属(33株)、粪肠球菌属(6株)、干酪乳杆菌(5株),嗜酸乳杆菌(4株)、侧孢短芽孢杆菌属(4株)。系统发育树及属种分类单元统计如图1、表3。

图1 52株乳酸菌系统发育树
Figure 1 Phylogenetic tree of 52 strains lactic acid bacteria
表3 属种分类单元统计表

Table 3 A statistical relation between species
2.3 乳酸菌菌株生理实验
所有的菌株在8个温度梯度中均有菌落生长,以35 ℃生长最好,有6株粪肠球菌菌株于45 ℃生长较其他菌株好;pH实验表现为低浓度的4个梯度有菌落生长,后2个梯度无菌落生长,又以pH=6和7两个值的平板菌落生长数目最多;耐盐试验中,NaCl浓度为0、2%、4%、6%的固体培养基上有菌落生长,浓度越大菌落数越少,NaCl浓度为8%、10%、15%时无菌落生长。
2.4 产EPS含量及菌株
对52株乳酸菌产EPS性状分析,发现31株产EPS。地区—含量“方差分析”结果见表4。



地区NEPS含量(mg/L)果洛州917.27±6.99玉树州715.90±3.82黄南州616.25±5.99海北州914.97±4.86F0.26 P0.86
31株所产EPS含量为(16.09±5.39)mg/L,产量最高的为果洛州的嗜热链球菌(28.83mg/L)。对地区—EPS含量行方差分析,统计分析结果显示,P=0.86,表明不同地区产EPS含量无差异。
不同种属产EPS检出情况采用“行×列表卡方检验”中的Fisher′s Exact 法,结果见表5。
表5 不同菌株产EPS检出及含量情况

Table 5 Detection and EPS content in different strains
统计结果显示,P<0.01,表明乳酸菌不同属之间产EPS上存在差异,即五个属中至少有两个以上菌种在产生EPS问题上有差异,进一步对产EPS菌株进行种属—EPS含量分析结果见表6。



乳酸菌种属NEPS含量(mg/L)嗜热链球菌2216.81±5.79粪肠球菌616.27±2.44嗜酸乳杆菌310.47±3.97合计3116.09±5.39
31株乳酸菌产EPS浓度为16.09±5.39 mg/L,22株嗜热链球菌为16.81±5.79 mg/L,粪肠球菌为16.27±2.44 mg/L,嗜酸乳杆菌为10.47±3.97 mg/L,其中侧芽孢乳杆菌和干酪乳杆菌透析液未检出EPS。
2.5 抑菌试验结果
所有的以3号试管内上清液行琼脂扩散法抑菌试验的培养基上均出现了抑菌圈,且抑菌圈直径大于1号管(排除强酸的抑菌作用,存在H2O2影响)、2号管(无强酸、无H2O2影响),2号管的抑菌直径最小,部分培养基上无抑菌圈。该现象的差异表明,青海牧区乳酸菌的可产生酸类抑菌物质和H2O2。对(3号管-2号管)抑菌直径进行方差分析结果见表7。



病原菌N抑菌直径(mm)大肠杆菌465.35±1.95金黄色葡萄球菌323.01±1.23*李斯特菌383.06±1.18*志贺菌414.48±1.96#&F18.84 P<0.01
*:与大肠杆菌比较,P<0.05;#:与金黄色葡萄球菌比较,P<0.05;&:与李斯特菌比较P<0.05.
52株乳酸菌菌株对四种致病菌的抑制数量上略有差异,46株对大肠杆菌、32株对金黄色葡萄球菌、38株对李斯特菌、41株对志贺菌产生抑制作用。总体上来说,乳酸菌对四种常见致病菌的抑制能力普遍较弱,且对各病原菌的抑制作用(抑菌圈直径大小)存在差异(F=18.84,P<0.01)。行SNK法分析,发现乳酸菌对金黄色葡萄球菌的抑制作用与对李斯特菌的抑制作用无差异(P=0.90),对大肠杆菌、志贺菌的抑制作用无差异(P=0.21),对其余病原菌的受抑制作用之间存在差异,三组间的比较,均表现为P<0.01。分别对乳酸菌种属、地区两个因素对大肠杆菌的抑制作用进行统计分析结果见表8~9。


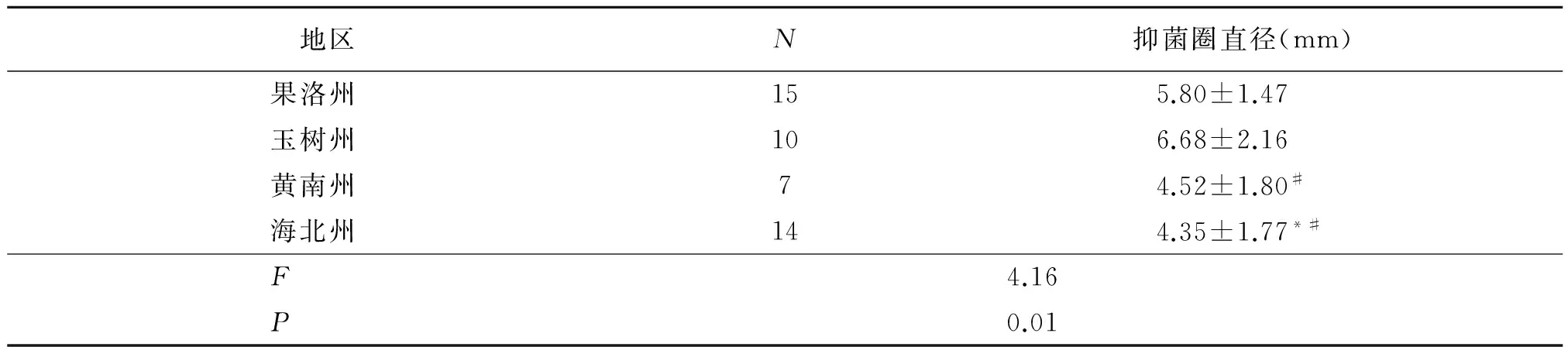
地区N抑菌圈直径(mm)果洛州155.80±1.47玉树州106.68±2.16黄南州74.52±1.80#海北州144.35±1.77*#F4.16 P0.01
*:与果洛州比较,P<0.05;#:与玉树州比较,P<0.05.
统计分析发现对大肠杆菌的抑制作用存在地区差异(F=4.16,P=0.01),行SNK两两比较,显示海北州与果洛州、玉树州与黄南州、玉树州与海北州在抑制大肠杆菌的生长上存在差异(P<0.05),其余各组间无差异。

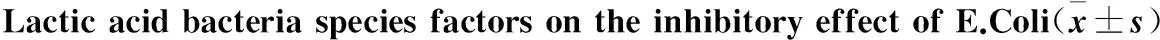

菌种抑菌圈直径(mm)嗜热链球菌6.21±1.76粪肠球菌3.73±1.53*侧芽胞乳杆菌4.83±0.51嗜酸乳杆菌4.53±1.81干酪乳杆菌3.18±0.85*F5.95P<0.01
*:与嗜热链球菌比较,P<0.05.
统计分析发现对大肠杆菌的抑制作用有乳酸菌种属上的差异(F=5.95,P<0.01),行SNK两两比较,显示对大肠杆菌的抑制作用上,嗜热链球菌与侧芽胞乳杆菌、嗜酸乳杆菌无差异(P=0.17、P=0.09),与粪肠球菌、干酪乳杆菌存在差异(P=0.02、P<0.01);粪肠球菌与侧芽胞乳杆菌、干酪乳杆菌、嗜酸乳杆菌均无差异(P=0.15、P=0.58、P=0.49),侧芽胞乳杆菌与嗜酸乳杆菌、干酪乳杆菌无差异(P=0.82、P=0.17),嗜酸乳杆菌与干酪乳杆菌抑菌作用无差异(P=0.26)。
2.6 乳酸菌抵抗模拟胃肠道环境生长实验
2.6.1 整体情况分析
52株菌株进行模拟胃肠道生存实验,将生存率进行SPSS秩和检验,不同时间生存率存在差异,χ2=247.87,P<0.01,活率中位数(四分位数间距,%):模拟胃液3 h为92.70(91.75,93.54),肠液3 h为88.54(87.99,89.18),肠液6 h中位数为84.36(83.21,86.28),肠液12 h中位数为76.02(74.42,77.21),肠液24 h中位数为65.43(64.32,66.94),存活率随时间的延长而降低。
2.6.2 不同菌种间存活率比较
菌株间不同环境不同时间存活率秩和检验分析结果见表10。
表10 不同菌株在不同环境不同时间存活率(%)
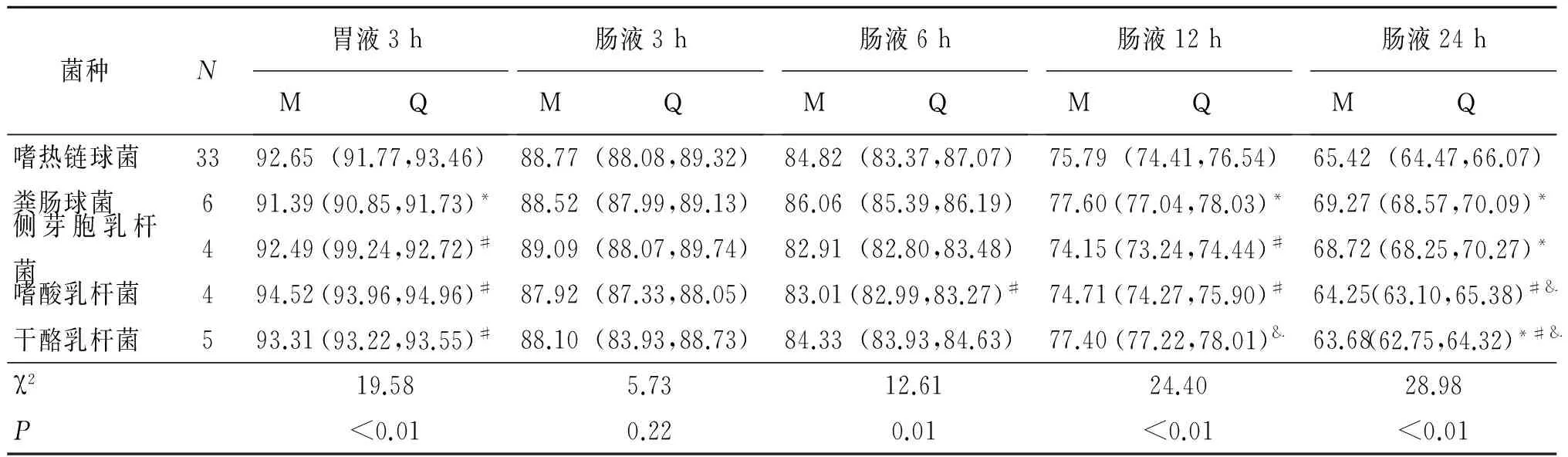
Table 10 Different strains survival rate in different times and different environment(%)
*:与嗜热链球菌比较,P<0.05;#:与粪肠球菌比较,P<0.0;&:与侧芽胞杆菌比较,P<0.05.
结果显示,除了肠液3 h存活率不同菌种间无统计学差异(P=0.22)外,其余各时间组不同菌株存活率均存在统计学差异。模拟胃液3 h存活率粪肠球菌与其余四种菌株均存在差异;模拟肠液6 h存活率嗜酸乳杆菌与粪肠球菌存在差异;模拟肠液12 h存活率粪肠球菌与嗜热链球菌、侧芽胞乳杆菌、嗜酸乳杆菌存在差异,干酪乳杆菌与侧芽胞乳杆菌比较存在差异;模拟肠液24 h存活率嗜热链球菌与粪肠球菌、侧芽胞乳杆菌、干酪乳杆菌存在差异,嗜酸乳杆菌、干酪乳杆菌与粪肠球菌存在差异,侧芽胞乳杆菌与干酪乳杆菌、嗜酸乳杆菌存在差异。
2.6.3 不同地区不同时间存活率比较
将存活率按地区分类,进行秩和检验结果见表11。
表11 不同地区乳酸菌存活率(%)

Table 11 Survival rate of lactobacillus in different areas(%)
*:与果洛州比较,P<0.05.
地区存活率上,胃液3 h、肠液3 h存活率无统计学差异,认为四个地区乳酸菌模拟胃液3 h、肠液3 h存活率基本相同,为同一个总体。肠液6、12、24 h在地区因素上存在差异(P<0.05),具体存活率见表11,转换秩次后行方差分析,发现在肠液6、12、24 h存活率上玉树州与果洛州、黄南州与果洛州存在差异。
3 讨论
本次实验从青海果洛州、玉树州、黄南州及海西州四大牧区收集到传统牦牛发酵乳制品57份,分离得到乳酸菌52株,主要优势菌株是嗜热乳酸链球菌属(63.46%),其次为粪肠球菌属(11.54%),这与2013年双杰[2]的研究结果一致,额外还分离到了干酪乳杆菌(5株)、嗜酸乳杆菌(4株)、侧孢短芽孢杆菌属(4株)。
温度实验显示,青海牧区乳酸菌10 ℃低温有微弱生长,这可能与青海牧区高海拔低温环境有关,长势最好的是35 ℃,认为该温度是本次实验青海乳酸菌的最适生长温度,类同Betache等[3]的研究结果(牛乳中的优势微生物为中温性乳酸菌);熊素玉[4]、尚天翠[5]等研究发现,新疆伊犁乳酸菌最适生长温度在25 ℃~38 ℃之间,与本实验结果大致相同;由于实验中设定的相邻两个梯度跨度较大,未能准确探究到乳酸菌的最适生长温度的确切值。pH结果符合乳酸菌最适生长值为6.5~6.8;NaCl实验认为青海乳酸菌是低盐菌,非嗜盐菌。
有些乳酸菌编码相关酶及调节蛋白的基因大部分在质粒上,如嗜酸乳球菌(Lactococcus lactis)等,嗜热链球菌Sfi6(Stretococcus thermophilus Sfi6)的EPS 基因簇则位于染色体上,有15.25 kb,可编码16个开放阅读框,其中,一个14.52 kb 的区域可编码13个基因(从EPSA到EPSM),这些基因决定了胞外多糖的合成[6-8];Tian Z[9]等研究发现乳酸菌合成胞外多糖的能力不稳定,易受EPS 基因簇的影响。本实验结果支持该结论。EPS产量—地区无差异,认为青海牧区乳酸菌产EPS含量为(16.09±5.39)mg/L,菌株间有差异,嗜热链球菌产量最高,侧芽胞乳杆菌与干酪乳杆菌未检出。
抑菌实验发现52株均有抑菌圈,加NaOH溶液处理后,部分菌株无抑菌圈,认为菌株产生抑菌作用的物质可能是某些弱酸性抑菌物质如乙酸、有机酸和H2O2[10]。
乳酸菌可以影响动物的免疫功能,增强自身免疫力,增加肠道粘膜对外界的抵抗力。体外模拟胃肠道环境监测乳酸菌活菌数目,在一定程度上可以反映乳酸菌抵抗胃酸、肠液碱性及胃肠道酶类的消化程度,但由于缺乏肠道内的正常菌群的竞争性抑制作用或协同性增长作用,以及缺乏正常菌群的代谢产物的影响,该实验只能反映其抵抗胃肠道酸碱性环境和酶类的消化情况,后期参考国家标准和相应的参考文献,添加胃肠道正常菌群,可以更加实际地反映胃肠道环境,亦或者进行动物体内实验,可探究青海乳酸菌对肠道功能及免疫等益生功能的影响。
综上所述,青海传统牦牛乳制品中主要的优势乳酸菌为嗜热链球菌,其次为粪肠球菌和干酪乳杆菌;青海牧区传统牦牛发酵乳中乳酸菌产EPS产量相对较低;乳酸菌对四种肠道病原菌的抑制作用较弱,其中对大肠杆菌抑制作用最强;乳酸菌抵抗胃酸生长能力较强;在不同胃肠道生长环境(模拟)中乳酸菌存活率存在差异;不同菌株间存活率不完全相同。
[1]中国疾病预防控制中心营养与食品安全所.GB/T 4789.2-2010食品卫生微生物学检验菌落总数测定[S].北京:中国标准出版社,2010.
[2]双杰,永胜,唐超群,等.青海部分牧区牦牛传统乳制品中优势乳酸菌的鉴定[J].青海医学院学报,2013,34(4):262-265.
[3]Bettache,Guessas,MebroukKihal.Characterization of lactic acid bacteria isolated fromAlgerian arid zone raw goats’ milk[J].AfricanJournal of Biotechnology,2004,3:339-342.
[4]熊素玉,姚新奎,谭小海,等.不同温度及pH条件对乳酸菌生长影响的研究[J].新疆农业科学,2006,6:533-538.
[5]尚天翠.温度及pH条件对乳酸菌生长影响的研究[J].伊犁师范学院学报(自然科学版),2011,3:32-36.
[6]Seema P,Avishek M,Arum G.Potentials of exopolysaccharides from lactic acid bacteria[J].Indian Journal of Microbiology,2012,52(1):3-12.
[7]Stingle F,Neeser J R,Mollet B.Identification and characterization of the eps(exopolysacharride)gene cluster from Streptococcus thermopilus Sfi6[J].Journal of Bacteriology,1996,178(6):1680-1690.
[8]van Kranenburg R1,Marugg JD,van Swam II,et al.Molecular characterization ofthe plasmid-encoded eps gene cluster essential for exopolysaccharide biosynthesisin Lactococcus lactis[J].Mol Microbiol.1997,24(2):387-97.
[9]Tian Z,Wang J,Zheng Z,et al.Research advances on structure and function of exopolysaccharides produced by lactic acid bacteria[J].Journal of Food Safety&Quality,2013,4(3):783-788.
[10]李院,魏新元,王静,等.抑制青霉菌乳酸菌的分离、鉴定及抑菌物质分析[J].食品科学,2015,36(6):150-155.
The separation,identification and characteristics of Lactic acid bacteria which produce EPS in home-made yak dairy from part of the pastoral areas in Qinghai
Tang Chaoqun,Yong Sheng,Zhu Derui,Liu Jing, Shuang Jie*
(Qinghai UniversityMedical college)
Objective To separate Lactic acid bacteria which produce EPS in homemade yak milk(yogurt,pull)from the Qinghai pastoral herdsmen,get the phylogenetic tree of EPS Lactic acid bacteria in Qinghai region,identified high levels of produce EPS Lactic acid bacteria;To provide theoretical basis for development and application of EPS Lactic acid bacteria in dairy industry.Methods 57 samplesfor Lactic acid bacteria were separated using CaCO3 MRS culture medium with flat test and the form in combination with biochemical experiment,as well as molecular biology method like the sequence of 16s rDNA,compared with BLAST in the NCBI database,built the phylogenetic tree,and determined Lactic acid bacteria species in the end;The Phenol-Sulfuric acid method was used for all of the Lactic acid bacteria for Quantitatively analyzing the production of polysaccharide;Agardiffusion method was used to observe the bacteriagrowth inhibitionsituation;Simulated the stomach and intestinal environment to complete the growth experiments in vitro.Results 86 pure strainsisolatedfrom 57 samples,the biochemical tests combined with the analysis of the 16 s DNA to determine 52 strain of Lactic acid bacteria which belongs to five species.Including the Streptococcus thermophilus(33 strains),Enterococcus faecalis(6 strains),Brevibacillus laterosporus(4 strains),Lactobacillus casei(5 strains)and Lactobacillus acidophilus(4 strains).31 of 52 strains can produce EPS.The most EPS producing bacteria is the Streptococcus thermophilus isolated at Guoluo prefecture,the concentration of EPS is(16.09±5.39)mg/L,the maximum concentration is 28.83mg/L,Bacteriostatic test found that all of 52 strains of Lactic acid bacteria showed inhibition for four kinds of pathogenic bacteria.Some strains of bacteria without bacteriostatic ring after eliminated the interference of strong acid and H2O2.Allthe strains showed weaker growth inhibition ability for the pathogenic bacteria.There are differences between the different survival time in the simulated gastrointestinal survival experiment,χ2=247.87(Rank Value=chi-square test Value,P<0.01).The median(Quartiles,%)of survival rate grown in simulated gastric liquid for 3h was 92.70(91.75,93.54):grown in simulated intestine liquid for 3h was 88.54(87.99,89.18);grown in simulated intestine liquid for 6h was 84.36(83.21,86.28;grown in simulated intestine liquid for 12h was 76.02(74.42,77.21 and grown in simulated intestine liquid for 24h is 65.43(64.32,66.94).The survival rate decreased with the increase of time.Conclusion Main advantage of lactic acid bacteria in Qinghai yak traditional fermented milk is containedabundant streptococcus thermophilic,followed by Enterococcus faecalis and Lactobacillus casei;the EPS is relatively low in Lactic acid bacteria in traditional fermented yak milk from pastoral areas in Qinghai.The bacteria static effect of Lactic acid bacteria in thefour kinds of pathogenic bacteria is generallyweak but they show the strongest inhibitory effect on E.Coli.Lactic acid bacteria shows strong ability to resist acid during the growth and survival rate in the simulated intestinal liquid decreases with the increase of time.Survival rates between different strains are not exactly the same.
Qinghai Yak Dairy production EPS Lactic acid bacteria Feature
R378.2
A
10.13452/j.cnki.jqmc.2016.01.003
2015-06-12
唐超群(1990~),女,汉族,湖南籍,2013级科学班研究生.*:通讯作者,副教授,976537915@qq.com

