多房棘球蚴重组蛋白CTB-Emy162的原核表达及分离纯化#
周 虎,汤 锋, 庞明泉,万陈飞,樊海宁,4,阳丹才让,4*,邓 勇,4**
(1.青海大学附属医院肝胆胰外科,青海 西宁 810001;2.青海大学医学院高原医学研究中心,青海 西宁 810001;3.青海大学高原人畜共患病研究所,青海 西宁 810001;4.青海省包虫病研究重点实验室)
多房棘球蚴重组蛋白CTB-Emy162的原核表达及分离纯化#
周 虎1,3,汤 锋2,3,4, 庞明泉1,3,万陈飞1,3,樊海宁1,3,4,阳丹才让1,3,4*,邓 勇1,3,4**
(1.青海大学附属医院肝胆胰外科,青海 西宁 810001;2.青海大学医学院高原医学研究中心,青海 西宁 810001;3.青海大学高原人畜共患病研究所,青海 西宁 810001;4.青海省包虫病研究重点实验室)
目的 构建融合基因CTB-Emy162原核表达系统,纯化得到多房棘球蚴重组蛋白CTB-Emy162。方法 根据多房棘球蚴抗原Emy162在GenBank中的序列,用生物信息学软件OptimumTMCodon 优化密码子适应指数(CAI)、最优密码子频率(FOP)及GC含量从而获得适合大肠杆菌BL-21表达的Emy162基因序列。PCR扩增Emy162基因,定向在pET-28a-CTB的CTB基因5′端插入Emy162基因。构建CTB和Emy162双基因原核表达质粒pET28a-CTB-Emy162,将该质粒转化于E.coli BL-21(DE3)中,经IPTG诱导蛋白表达后,利用Ni-NTA 柱亲和层析及离子交换色谱纯化后获得目的蛋白。结果 OptimumTMCodon 获得优化后的Emy162序列,经生物公司测序及酶切鉴定结果证明重组质粒pET28a-CTB-Emy162构建成功,进一步实验结果表明CTB-Emy162在原核表达系统pET-28a中主要以包涵体形式存在,在可溶部位少量表达。继而经Ni-NTA柱亲和纯化及离子交换色谱纯化获得CTB-Emy162纯蛋白。结论 以大肠杆菌E.coli BL-21(DE3)及pET-28a构成的原核表达系统能够成功表达重组蛋白CTB-Emy162,Ni-NTA纯化柱能够纯化目的蛋白CTB-Emy162。
多房棘球蚴 Emy162 原核表达系统
包虫病(echinococcus)是一种人兽共患性寄生虫病。目前外科手术和药物治疗虽是包虫病治疗的主要方案,但存在术后复发率高、药物治疗效果不理想的弊端[1]。疫苗预防相对于手术和药物治疗,是一种简便、经济而有效的防控措施。但包虫病疫苗的研制极具挑战性,主要表现在棘球蚴在体内寄生和进化,发育各阶段产生的抗原不同,很难找到一个有效抗原,现有疫苗免疫效果不佳。
本研究选取的多房棘球蚴绦虫表面抗原Emy162,是表达于多房棘球蚴绦虫4个发育阶段(原头节,续绦期,幼虫和成虫)的基因序列[2]。Emy162抗原被证实具有抗多房棘球蚴感染作用且与细粒棘球蚴良好的免疫抗原Eg95具有类似的结构特征[3-6]。这一生物学特性可以为研制抗泡型和囊型包虫病的疫苗提供可能。本实验拟借助分子生物学技术优化Emy162的序列,并偶联分子内黏膜免疫佐剂霍乱毒素B亚单位(CTB)[7-12]。为获得重组蛋白CTB-Emy162,本研究构建适宜CTB-Emy162的表达的质粒载体,并在大肠杆菌E.coli BL-21(DE3)表达系统中表达,以获得目的重组蛋白CTB-Emy162。为研究其作为抗棘球蚴病疫苗的价值奠定基础。
1 材料与方法
1.1 材料
pET-CTB-UE由宁夏医科大学郭乐教授惠赠;原核表达载体pET-28a(E.coli)、BL21(DE3)株由北京康为世纪生物科技有限公司提供;限制性内切酶 KpnⅠ、XhoⅠ、Nco I、T4 DNA连接酶由Takara公司提供;质粒提取试剂盒、琼脂糖凝胶电泳DNA 纯化回收试剂盒由天根生化科技(北京)有限公司提供;Ni-NTA纯化介质、基因序列的合成优化由南京金斯瑞公司提供并合成;卡纳霉素(kana)由上海生物工程技术服务有限责任公司提供。
1.2 方法
1.2.1 Emy162序列的获得及优化
从GenBank中获得的目的基因Emy162氨基酸序列:1MVLRFCLILLATSVIAEEVGVDPELIAKLTKKLQTTLPEHFRWIHVGSRSLELGWNATGLANLHADHIKLTANLYTTYVSFRYRNVPIERQKLTLEGLKPSTFYEVVVQALKGDSEVYKYTGFIRTLAPGEDGADRAGGFALIFAMAGLLLLT153。在得到上述氨基酸序列的基础上,使用生物信息学软件OptimumTMCodon对目的序列进行优化设计,按照酶切位点对侧翼序列的具体要求设计出包含相应酶切位点和保护性碱基的序列:
5′-ATGGTGCTGCGCTTTTGTCTGATCCTGCTGGCGACGAGTGTTATTGCGGAAGAAGTGGGCGTGGACCCGGAACTGATTGCTAAACTGACCAAAAAACTGCAGACCACGCTGCCGGAACATTTTCGTTGGATTCACGTCGGCAGCCGCTCTCTGGAACTGGGCTGGAACGCGACCGGTCTGGCCAATCTGCATGCAGATCACATTAAACTGACGGCCAACCTGTATACCACGTACGTGAGCTTCCGTTATCGCAATGTTCCGATCGAACGTCAGAAACTGACCCTGGAAGGTCTGAAACCGAGTACGTTTTACGAAGTGGTTGTCCAAGCGCTGAAAGGCGACTCCGAAGTGTATAAATACACCGGTTTCATTCGTACGCTGGCTCCGGGTGAAGATGGTGCAGACCGTGCTGGTGGTTTTGCGCTGATCTTCGCGATGGCCGGCCTGCTGCTGCTGACC-3′。优化后的序列委托南京金斯瑞生物科技公司进行上述目的基因的合成,并按照大肠杆菌密码子偏爱性原则转化成相应的核苷酸序列。
1.2.2 多房棘球蚴表面抗原Emy162的基因合成与扩增
将前期获取的Emy162的氨基酸序列,委托南京金斯瑞生物科技公司将氨基酸序列转化成相应的核苷酸序列并进行基因合成。合成后的Emy162进行PCR:40 μL PCR总体系中包括Emy162模板2 μL,Master mix 20 μL,Emy162引物2 μL,ddH2O 16 μL。PCR反应条件为:95 ℃预变性5 min,95 ℃变性30 sec,72 ℃退火30 sec,72 ℃延伸40 sec,共30个循环;最后72 ℃延伸10 min。
1.2.3 pET28a-CTB-Emy162质粒载体的构建
通过质粒小量提取试剂盒(天根)提取质粒pET-CTB-UE,经Kpn I和Xho I在37 ℃下进行双酶切,琼脂糖凝胶电泳DNA纯化回收试剂盒回收pET-CTB表达载体。回收后的pET-CTB与Emy162经T4连接酶在冰箱(4℃)中过夜连接,构建表达载体pET28a-CTB-Emy162,并经Nco I和Xho I酶切鉴定。构建好的质粒转入大肠杆菌BL-21中,涂布在含有kana抗生素的LB固体培养基上,过夜培养(37℃)。次日晨挑取阳性菌株测序。
1.2.4 CTB-Emy162蛋白的表达及纯化
经酶切鉴定及测序100%比对成功菌株及阴性对照菌(pET-28a载体不含目的基因)在LB液体培养基中培养6 h,按1:100的比例接种于200 mL LB 液体培养基中,摇床(190r/min,37℃)培养;待LB液体培养基OD600值达到0.6~0.8时,加入异丙基-β-硫代半乳糖(Isopropyl-β-D-1-thiogalactopyranoside,IPTG),至IPTG终浓度为0.1 mmol /L,摇床(190r/min,28℃)诱导培养过夜后,让宿主菌体充分诱导表达蛋白,后经离心(10000r/min,20min)收集沉淀,用PBS混悬,冰上行细胞破碎(20min),离心(12000r/min,20min)后分别取上清和沉淀;收集离心后的上清,离心后的沉淀用8M尿素超声溶解,离心(12000r/min,10min),取上清为包涵体部位蛋白溶液,行SDS-PAGE电泳确定目的蛋白表达的部位。在确定了重组蛋白表达部位后,使用Ni-NTA镍柱亲和层析纯化目的蛋白,纯化目的蛋白时使用8 M尿素咪唑梯度(20、50、100、250mm/L咪唑)洗脱,收集各梯度洗脱液。将纯化后的蛋白(250mm/L咪唑洗脱溶液)溶液装入激活后的透析袋中,分别用含6、4、2、0 M尿素的PBS 梯度溶液放置于冰箱(4℃)中透析,每隔12 h更换1次梯度液(期间需轻轻摇晃以加快透析),共透析48 h;透析完成,将溶液离心(12000r/min,15min),收集上清。用聚乙二醇20000(PEG20000)浓缩已得到的纯化蛋白,-80 ℃保存。
2 结果
2.1 Emy162序列的优化
利用生物信息学软件OptimumTMCodon对Emy162序列进行优化,优化内容主要针对FOP、CAI及GC含量进行调整。如图1所示,CAI优化前为0.55(图1A),优化后为0.90(图1B);FOP优化见图1C、D,优化后FOP为74;继而对优化前后序列的GC含量进行考察,如图1E、F所示:优化前GC含量为46.51,优化后为53.35。优化后的Emy162序列达到大肠杆菌密码子偏爱性的最优状态序列:ATGGTGCTGCGCTTTTGTCTGATCCTGCTGGCGACGAGTGTTATTGCGGAAGAAGTGGGCGTGGACCCGGAACTGATTGCTAAACTGACCAAAAAACTGCAGACCACGCTGCCGGAACATTTTCGTTGGATTCACGTCGGCAGCCGCTCTCTGGAACTGGGCTGGAACGCGACCGGTCTGGCCAATCTGCATGCAGATCACATTAAACTGACGGCCAACCTGTATACCACGTACGTGAGCTTCCGTTATCGCAATGTTCCGATCGAACGTCAGAAACTGACCCTGGAAGGTCTGAAACCGAGTACGTTTTACGAAGTGGTTGTCCAAGCGCTGAAAGGCGACTCCGAAGTGTATAAATACACCGGTTTCATTCGTACGCTGGCTCCGGGTGAAGATGGTGCAGACCGTGCTGGTGGTTTTGCGCTGATCTTCGCGATGGCCGGCCTGCTGCTGCTGACC。
2.2 Emy162基因的cDNA序列的扩增
Emy162基因的PCR 扩增产物,经1%琼脂糖凝胶电泳(100V,30min)。经SYBR Green I染色,观察电泳结果,在约459 bp处出现特异性 DNA 扩增条带,其大小与理论推算一致,见图2。
2.3 表达载体pET28a-CTB-Emy162的鉴定
经T4连接酶体系连接将Emy162插入原核表达载体pET28a-CTB,并将重组质粒载体命名为pET28a-CTB-Emy162,其结构示意图(图3)可见其含有三个酶切位点,为目的DNA 的插入和酶切鉴定提供相应的酶切位点。表达载体pET28a-CTB-Emy162经限制性内切酶NcoI、XhoI双酶切后,经1%琼脂糖凝胶电泳分析发现,在790 bp大小左右有目的条带(图4)。表明原核表达载体pET28a-CTB中成功插入790 bp的基因序列。继而经测序验证发现该790 bp序列与CTB-Emy162完全吻合,无碱基错配及偏移等情况(图5)。
2.4 pET28a-CTB-Emy162的原核表达及蛋白表达部位的鉴定
pET-CTB-Emy162经IPTG诱导后,菌液上清即含分泌性蛋白,菌体经超声破碎离心后,收集可溶性及包涵体蛋白。收集液分别行SDS-PAGE电泳检测。电泳结果如下(图6A),可见在包涵体部位33 kD见明显扩增条带,而在可溶部位仅有微弱表达。上述实验结果证明,原核表达载体pET-28a能够成功表达重组蛋白CTB-Emy162,且重组蛋白CTB-Emy162在原核表达载体pET-28a中是以包涵体形式表达。
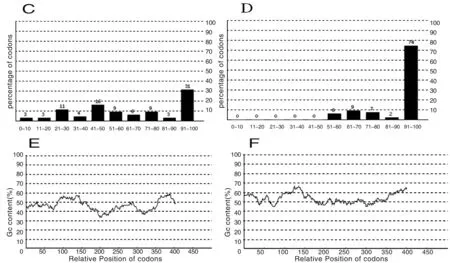
A:优化前密码子适应指数; B:优化后密码子适应指数; C:优化前最优密码子频率; D:优化后最优密码子频率;E:优化前GC含量; F:优化后GC含量

A1:D2000 Plus DNA Ladder; 2:PCR 扩增得到Emy162基因的cDNA序列(459bp)

图3 重组质粒pET-CTB-Emy162结构示意图
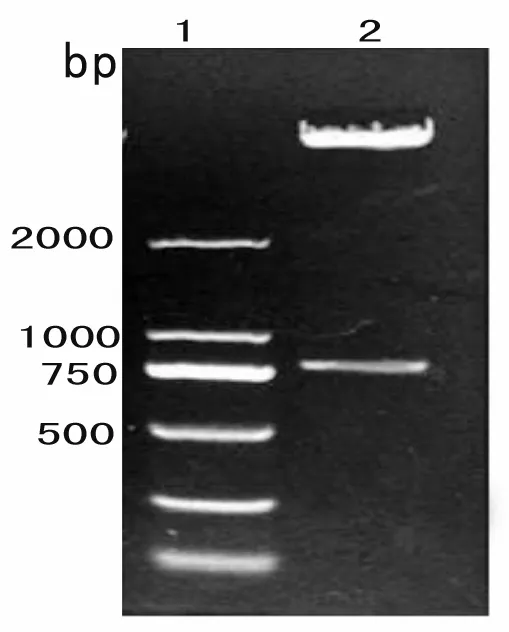
1:Maker; 2:pET-CTB-Emy162经Nco I /Xho I双酶切

图5 重组质粒pET-CTB- Emy162测序结果比对图

A1:pET-28a全菌蛋白(阴性对照); 2:pET28a-CTB-Emy162全菌蛋白; 3:pET28a- CTB-Emy162可溶蛋白;4:包涵体蛋白.B1:包涵体蛋白;2:纯化CTB-Emy162蛋白
2.5 pET-CTB-Emy162的纯化结果
本研究证实,目的蛋白CTB-Emy162在细菌的包涵体部位表达,将收集的pET-CTB-Emy162包涵体溶液经Ni-NTA离子层析纯化,经复性后获得纯化后的蛋白CTB-Emy162,行SDS-PAGE观察纯化后的效果见图6B,可见经纯化后的目的蛋白CTB-Emy162在33 kD有一条明显增粗的条带,实际大小与理论值相符。本实验表明,利用pET-28a原核表达载体表达的重组蛋白CTB-Emy162经纯化后基本能达到电泳纯的级别。
3 讨论
大肠杆菌表达系统应用历史悠久。1977年,利用大肠杆菌表达系统成功表达出人生长激素[13]。现如今,借助大肠杆菌作为工程菌表达生产的蛋白约占现有重组蛋白药物的三分之一[14]。大肠杆菌表达系统作为典型的原核表达系统之一,主要由表达载体、外源基因(目的基因)、表达宿主菌三部分组成[15,16]。由于其遗传背景清楚、培养简单、转化及转导效率高、实验成本较为低廉,并可快速量产目的蛋白等优点,现已成为应用最为广泛的原核表达系统[17,18]。此外,pET系列原核表达载体是美国Novagen公司设计推广的大肠杆菌高效表达系统,pET系列原核表达体系利用IPTG诱导启动子来过量表达T7 RNA聚合酶,继而使得宿主菌表达大量的目的蛋白[19]。
根据目的蛋白在宿主菌中表达的部位不同,可将目的蛋白的原核表达分为胞外、周质、胞质表达三种形式。其中,胞外表达目的蛋白主要被分泌到宿主菌的培养基中,故容易纯化且有活性。周质表达也称可溶性表达,蛋白主要存在周浆间隙中,目的蛋白是否有活性,主要受自身结构和诱导温度、渗透压、pH等外界环境影响[20]。胞质表达即以包涵体形式表达,其目的蛋白量虽较前两者而言最高,但由于目的蛋白易形成无活性的包涵体,需经变性复性才能得到有活性的目的蛋白[21,22]。
此外,以pET-28a为载体表达的蛋白多以包涵体形式存在,这可能是由于细胞内蛋白酶降解,宿主菌代谢负荷过大使得表达产物不能形成有活性的天然构象导致的[23]。实验结果中发现可溶部位少量表达,其原因可能是:(1)诱导表达的温度过低,宿主菌生长速度减慢,蛋白结构折叠正确,相应增加分泌性蛋白的表达;(2)诱导蛋白过度表达,可能改变了大肠杆菌还原性的胞质环境,从而形成较多的二硫键,促进可溶性表达;(3)连接体(Linker)有可能影响了蛋白序列,进而改善蛋白折叠,增加可溶蛋白的表达;(4)可溶部位蛋白超声时间过长,少量包涵体破碎,目的蛋白释放;(5)其他原因,包括IPTG浓度、培养液的pH影响等。
蛋白纯化的原理主要利用不同蛋白间存在的差异性,这种差异主要表现蛋白的大小上,蛋白的大小影响着该蛋白所带的电荷大小。此外,蛋白的疏水性、溶解度和生物学活性等也影响着蛋白的纯化。正是由于这种不同蛋白质之间存在差异,才可以将目的蛋白从其他蛋白中纯化出来[24]。本实验中,在构建重组蛋白CTB-Emy162表达载体时,选择的质粒载体为C末端带有6个组氨酸标签的pET-28a。这种质粒载体表达蛋白的产量高,但表达的蛋白因不能形成正确的空间结构,而以包涵体的形式存在。此外,pET-28a携带的组氨酸是具有杂环的氨基酸,每个组氨酸含有一个咪唑基团(带有很多额外电子),对于带正电的化学物质(蛋白)有静电引力。组氨酸标签在pH为8.0时不带电,且无免疫原性,对蛋白质的表达、结构折叠及功能的影响极小,且能高度亲和镍离子。镍柱亲和层析正是利用这一原理将带有组氨酸的蛋白吸附挂柱。因此选择带有组氨酸标签的pET-28a作为质粒载体,不仅可以提高蛋白产量,也可以为后期目的蛋白的纯化做好铺垫。
本研究是在获得多房棘球蚴表面抗原Emy162的基础上,利用生物信息学软件OptimumTMCodon对其CAI、FOP及GC含量及编码的序列进行合理优化,以获取适合大肠杆菌表达的基因,并插入免疫佐剂载体CTB基因,以增强蛋白的免疫效果。本实验将重组序列CTB-Emy162成功转入原核表达载体pET-28a,并经酶切、测序确证,后经蛋白表达、纯化、表达部位鉴定等,证实pET-28a能够作为CTB-Emy162的表达载体,且在包涵体部位高量表达。CTB-Emy162经纯化复性后获得可用于后续实验的电泳纯蛋白。
[1]Lorenzatto KR,Monteiro KM,Paredes R,et al.Fructose-bisphosphate aldolase and enolase from Echinococcus granulosus:genes,expression patterns and protein interactions of two potential moonlighting proteins[J].Gene,2012,506(1):76-84.
[2]Li Y,Liu X,Zhu Y,etal.Bioinformatic prediction of epitopes in the Emy162 antigen of Echinococcus multilocularis[J].Exp Ther Med,2013,6(2):335-340.
[3]Ito A,Schantz PM,Wilson JF.Em18,a new serodiagnostic marker for differentiation of active and inactive cases of alveolar hydatid disease[J].Am J Trop Med Hyg,1995,52(1):41-44.
[4]Ito A,Nakao M,Kutsumi H.Serodiagnosis of alveolar hydatid disease by Western blotting[J].Trans R Soc Trop Med Hyg,1993,87(2):170-172.
[5]Katoh Y,Kouguchi H,Matsumoto J,et al.Characterization of Emy162 encoding an immunogenic protein cloned from an adult worm-specific cDNA library of Echinococcus multilocularis[J].Biochim Biophys Acta,2007,1780(1):1-6.
[6]Kouguchi H,Matsumoto J,Katoh Y,et al.The vaccination potential of EMY162 antigen against Echinococcus multilocularis infection[J].Biochim Biophys Acta,2007,363(4):915-920.
[7]Schulze K,Medina E,Talay SR,et al.Characterization of the domain of fibronectin-binding protein I of Streptococcus pyogenes responsible for elicitation of a protective immune response[J].Infect Immun,2001,69(1): 622-625.
[8]PizzaM,G iulianiMM,Fontana MR,et al.Mucosal vaccines:nontoxic derivatives of LT and CT as mucosal adjuvants[J].Vaccine,2001,19:2534-2541.
[9]Sun JB,Raghavan S,Sjoling A,et al.Oral tolerance induction with antigen conjugated to cholera toxin B subunit generates both Foxp3+ CD25+ and Foxp3- CD25- CD4+ regulatory T cells[J].J Immunol,2006,177(11):7634-7644.
[10]Thomas Stratmann.Cholera Toxin Subunit B as Adjuvant—An Accelerator in Protective Immunity and a Break in Autoimmunity[J].Vaccines,3(3):579-596.
[11]Han Lei,Xiaojue Peng,et al.Broadly protective immunity against divergent influenza viruses by oral co-administration of Lactococcus lactis expressing nucleoprotein adjuvantedwith cholera toxin B subunit in mice[J].Microb Cell Fact,2015,14:111.
[12]Cynthia Maeto.Novel Mucosal DNA-MVA HIV Vaccination in Which DNAIL-12 Plus Cholera Toxin B Subunit(CTB)Cooperates to Enhance Cellular Systemic and Mucosal Genital Tract Immunity[J].PLOS ONE,2014,9(9):e107524.
[13]DV Goeddel,Kleid DG,Bolivar F,et al.Expression in Escherichia coli of chemically synthesized genes for human insulin[J].Proc Natl Acad SciUSA,1979,76(1):106-10.
[14]Ferrer-Miralles N,Domingo-Espín J,Corchero JL,et al.Microbial factories for recombinant pharmaceuticals[J].Microb Cell Fact,2009,8:17.
[15]解庭波.大肠杆菌表达系统的研究进展[J].长江大学学报(医学版),2008,03:77-82.
[16]许崇利,杨梅,许崇波. 大肠杆菌表达系统的影响因素[J].中国动物检疫,2010,08:66-68.
[17]NucP,Nuc K.Recombinan t protein production in Escherichia coli[J].Postepy Biochem,2006,52( 4):448-456.
[18]Dong X,Tang B,Li J,et al.Expression and Purification of In tact and Functional S oyb ean( Glycine max)Seed Ferritin Complex in Escherichia coli[J].J Microbiol Biotech nol,2008,18( 2):299-307.
[19]Novagen.pET System Manual[M].9th Edition.2000.
[20]卫红飞.重组表位蛋白在大肠杆菌中表达水平的影响因素[D].吉林大学,2014.
[21]刘爽,胡宝成.原核系统可溶性表达策略[J].生物技术通讯.2005,2:172-175.
[22]苏裕.大肠杆菌中重组蛋白可溶性表达的研究[D].华东师范大学,2007.
[23]Georgiou G,Segatori L.Preparative expression of secreted proteins in bacteria:status report and future prospects[J].Curr Opin Biotechnol,2005,16(5):538-545.
[24]Glenthoj A,Dahl S,Larsen MT,et al.Human alpha-Defensin Expression Is Not Dependent on CCAAT/Enhancer Binding Protein-epsilon in a Murine Model[J].PLoS One,2014,9:e92471.
Prokaryotic expression and purification of recombinant protein CTB-Emy162 inEchinococcusmultilocularis
Zhou Hu1,3,Tang Feng2,3,Pang Mingquan1,3,Wan Chenfei1,3,Fan Haining1,3,Yangdan Cairang1,3*,Deng Yong1,3**
(1.Department of Hepatopancreatobiliary Surgery,Affiliated Hospital of Qinghai University,Xining,Qinghai 810001;2.Research Center for High Altitude Medical Sciences,Qinghai University School of Medicine,Xining,Qinghai 810001 3.Research Institute for High Altitude Zoonosis of Qinghai University)
Objective Constructed a prokaryotic expression system for CTB-Emy162 and obtained Purified fusion proteinCTB-Emy162 inEchinococcusmultilocularis.Method According to the sequence ofEchinococcusmultilocularisEmy162 antigen in GenBank,Bioinformatics software OptimumTMCodon was used to obtain a suitable sequence of gene expressed in E.coli BL-21 by optimizing of codon adaptation index(CAI).The optimal codon fre-quency(FOP)and the content of GC.and the optimization sequence were cloned into prokaryotic expression vector and pET-28a.IPTG induction,Ni-NTA affinity chromatography and ion exchange chromatogra-phy were utilized to obtain CTB-Emy162 protein.Results Emy162 sequencewe procured was suitable for prokaryotic expression system by OptimumTMCodon software.Recombinant plasmids pET28a-CTB-Emy162 were constructed successfully and identified by double-enzyme digestion and sequencing.Further,our results were indicated that CTB-Emy162 was expressed in inclusion bodies part of pET28a-CTB-Emy162.Finally,we obtained highly purified recombinant protein CTB-Emy162 by Ni-chelating affinity chromatography.Conclusions In this study,we successfully establish the prokaryotic expression system of CTB-Emy162,and obtain highly purified CTB-Emy162.
EchinococcusmultilocularisEmy162 Prokaryotic expression system
R383.3
A
10.13452/j.cnki.jqmc.2016.01.002
2015-06-09
#:青海省科技厅项目(编号:2014-ZJ-716);青海大学中青年团队项目(编号:2014-QYT-1).*:第一通讯作者,副教授,硕士研究生导师,yangdancairang@163.com;**:第二通讯作者,教授,硕士研究生导师,dengyong@medmail.com.cn. 周虎(1989~),男,汉族,安徽籍,在读硕士,青海大学普通外科学专业

