沉积物中129I不同形态的逐级浸取分离
王博远 吴昊坤 张 力 潘 伟 李 杰 顾志杰
(1 中国辐射防护研究院,太原 030006;2洛阳船舶材料研究所纳米中心,河南 洛阳 471023)
沉积物中129I不同形态的逐级浸取分离
王博远1吴昊坤1张 力2潘 伟1李 杰1顾志杰1
(1 中国辐射防护研究院,太原 030006;2洛阳船舶材料研究所纳米中心,河南 洛阳 471023)
随着核技术的不断发展,核试验、乏燃料后处理及核电站事故等人类核活动向自然界释放了大量的129I。129I在沉积物中的含量与化学形态分布对揭示其迁移规律和沉降信息有着重要的意义。因此,对于研究沉积物中129I不同形态所需要的合理分离及制备流程就尤为重要。结合太湖湖泊沉积物的特点并通过比较众多沉积物中129I形态的分离流程,提出了改进的逐级浸取流程。在温度、时间不同的实验条件下,对沉积物样品分离出沉积物中129I可交换态、有机结合态、金属氧化物态、残余矿物态四种不同形态,并通过高温热解法及125I示踪计算回收率及损失率。改进后的逐级浸取法能达到90%的提取效率,离子可交换态、有机结合态、金属氧化物结合态的适宜浸取时间和温度分别为4.5 h、30 ℃,4.5 h、75 ℃,5.5 h、75 ℃。流程适用于同类湖底沉积物样品分析。
沉积物;逐级浸取;形态分析;129I
0 前言
碘在人和动物甲状腺中高度富集,其放射性同位素131I严重威胁人类健康,是核事故下急需监测的核素,但131I的短半衰期对监测工作带来很大困难。由于129I和131I具有相似的理化性质及运行途径,所以国际上已利用人工释放的129I作为长期环境示踪元素,研究人类核活动对环境的影响,评估核泄漏污染水平,对核扩散进行监督,以将危害减到最少[1]。自20世纪50年代进入核时代以来,人类频繁的核活动将大量的人造129I排入自然环境中,目前自然环境中可移动的129I超过99%以上都被认为是人为产生的,主要是由核电站的反应堆和核武器试验所产生的中子所诱发的235U与239Pu裂变产生的129I进入环境中[2]。
目前有多种129I测定方法[3],如γ-χ光谱法、液闪计数法(LSC)、中子活化法(NAA)、电感耦合等离子体质谱法(ICP-MS)和加速器质谱分析法(AMS)(表1)。
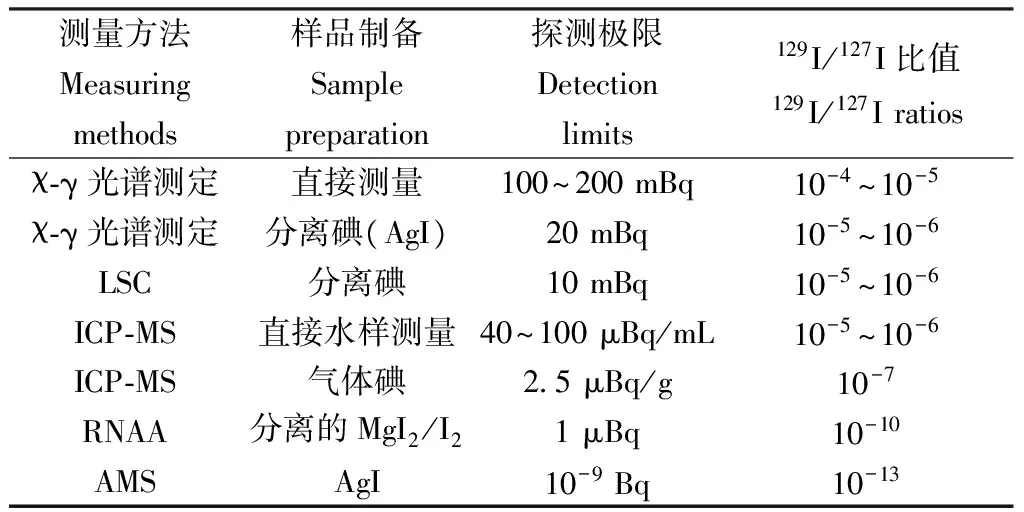
表1 测量129I的不同分析方法Table 1 Different analytical methods for measuring 129I
129I测定需要分离制备含I同位素的环境样品,以往人们对碘的研究基本上还都停留在元素总量水平上,缺少碘在自然界的形态分布的研究[4]。为了评估环境中放射性污染的短期及长期影响,仅靠核素浓度的信息是远远不够的,碘在特定样品中的形态分析能够帮助研究碘对生态体系影响和迁移机理[5]。
逐级浸取可分离元素的不同形态,操作及所需的仪器都比较简单。Tessier等人提出的沉积物逐级浸取流程目前已得到广泛的应用[6-8],但该方法是一个稳恒状态的浸取过程,具有耗时长,易造成交叉污染及重吸收等缺点。Englund等已经提出了一个动态的浸取方法来克服这些缺点。并使用此法分离了瑞典Nylandssjön湖底沉积物中碘的不同形态[9]。表2为碘的Englund所选用的逐级浸取实验流程。
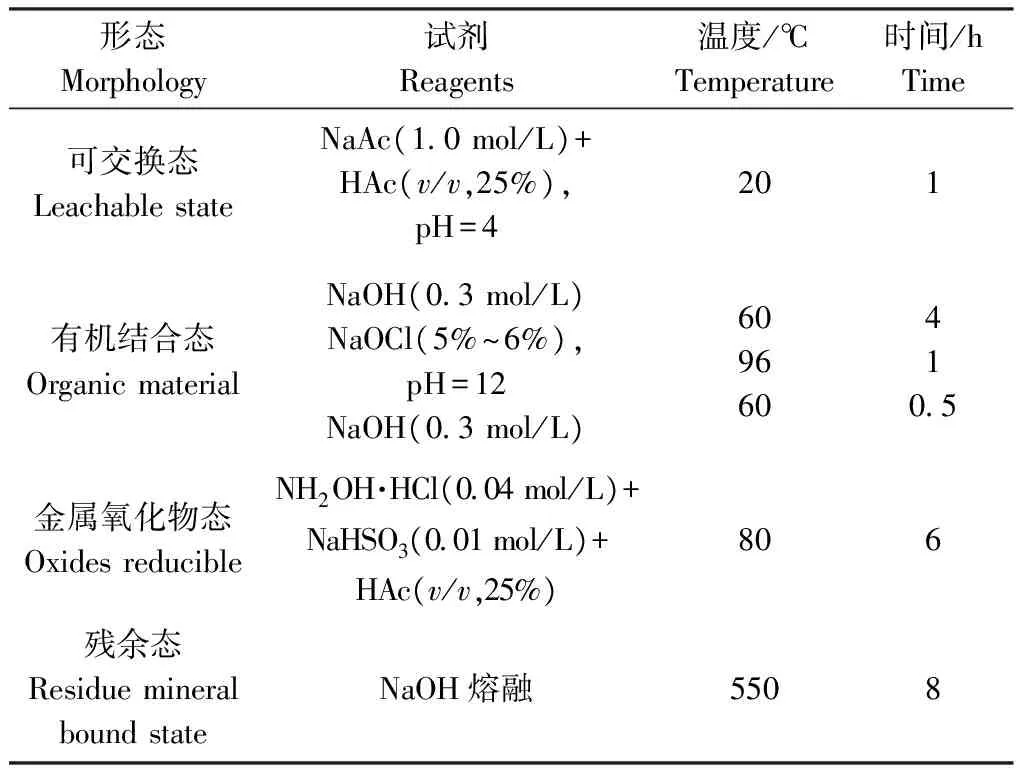
表2 碘的逐级浸取实验流程Table 2 Sequential leaching process for iodine
在考虑沉积物样品的特殊性和实验室现有设备条件的基础上,通过优化浸取时间、步骤、试剂,最终分析整理出一套简便有效的129I不同化学形态的分离制样流程。应用改进的流程对太湖沉积物样品分析,结果表明,改进的逐级浸取法合理可行,并给出了适宜的分离温度、时间。
1 实验部分
1.1 主要试剂
NaAC、HAC、硫酸羟胺(NH2OH·H2SO4)为分析纯,国药集团化学试剂有限公司生产。HNO3、NaHSO3、AgNO3、NaOH、CCl4、NaNO2、氨水均为优级纯,国药集团化学试剂有限公司生产。
1.2 主要仪器
Pipe/tip微量定量移液管(20~200 μL)、一次性移液管、高速离心机(≥2 000 r/min)、电热恒温鼓风干燥箱、加热板、超纯水机、分析天平、50 mL离心管、15 mL离心管和离心搅拌机等。FJ2021型γ放射免疫计数器(西安核仪器厂)。 Pyrolyser-4Trio TM高温热解炉(英国Raddee公司生产)。
1.3 实验方法
1.3.1 样品采集与前处理
所用的沉积物样品于太湖湖泊采集,将采集的样品放置在清洁塑料盆里充分混匀,接着去除其中石块等杂物,然后于冰箱中冷冻贮存。待要用时取出并用加热板以150 ℃加热24 h解冻,然后置于空气中3 d使其自然风干,然后放入研磨钵研磨,过75 μm筛子,封存于标号的塑料袋里并称重。
1.3.2 液体γ计数标准制作方法
利用1/100电子天平称量1.00 g捕集液于15 mL的离心管中,使用20~200 μL移液枪在该离心管溶液中精确加入1 000 μL125I示踪剂溶液,盖紧盖子摇晃使溶液均匀混合[10]。
1.3.3 逐级浸取分离
环境样品中129I的浓度通常比稳定碘127I浓度低9~12个数量级,由于这个原因,用于127I的形态分析方法和分析技术不能直接应用于129I的形态分析。土壤及沉积物的不同形态129I通常采用逐级浸取或选择性浸取的方法进行分离。图1为改进后的逐级浸取流程。
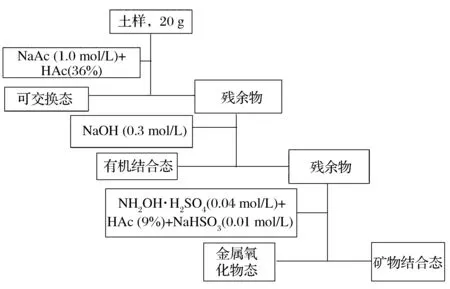
图1 改进后的逐级浸取流程图Figure 1 The diagram of the improved sequential leaching process.
1.3.4 高温热解
使用850 ℃的高温热解能使样品中的所有形态的碘从土壤中分离出来。用1/100感量的电子天平称取沉积物1.00 g,以1∶3的比率和3 g NaOH固体混合加入到干净的蒸发皿中,然后使用20~200 μL移液枪在该蒸发皿中精确加入1 000 μL I125示踪剂溶液,之后混匀再高温热解并配样,通过ICP-MS法测定其中的I浓度,比较效率[11]。
1.4 分离方法
1.4.1 可交换态
碘离子是酸性土壤中溶解态碘的主要存在形式,尤其是在淹水性的土壤中,酸性土壤碘离子为主,碱性土壤碘酸根离子为主,这说明了pH值是控制土壤中溶解性碘形态的决定因素,并且在溶液酸性条件下溶解性碘更易被分离。所以在分离可交换态时用NaAc和HAc的混合溶液控制溶液pH=4,以分离可交换态碘。
1.4.2 有机结合态
为了得到沉积物中有机结合态的碘,Englund等人使用以下三个步骤:沉积物先用NaOH(0.3 mol/L)在60 ℃浸取4 h;然后使用NaOCl(5%~6%)在pH=12、96 ℃的条件下浸取30 min;最后使用NaOH(0.3 mol/L)在60 ℃浸取1 h。NaOH能破坏有机相,NaOCl在此可以氧化分解有机质,但是该方法需要分别分成3步浸取沉积物中的有机质,即最后所得的有机结合态浸取液体积过大,不利于其后的共沉淀。针对以上问题,我们把浸取有机物的这步改为使用NaOH(0.3 mol/L)溶液在80 ℃浸取6 h。为了验证修改后的土壤有机态碘的浸取方法,设计验证实验。实验结果见表3。

表3 有机结合态各浸取步骤所得碘的浓度Table 3 Iodine concentrations obtained from each leaching step for organic material
从表3看出,第2步和第3步的占有率比率与第1步占总碘比率相除,分别为3.05%和0.22%,造成的影响很小,从实验成本、效率以及后续工作的角度考虑,可忽略后两步。对于腐殖质中的有机结合态碘,我们将有机结合态浸取液置于150 ℃的电热板上加热过夜,会发现颜色变浅,黑色悬浮物变少,表明溶液中有机质分解。
1.4.3 金属氧化物态
沉积物土壤中铁锰氧化物以铁锰结核、块状、颗粒胶体结构等形式存在,有的甚至包裹在颗粒外层。这些氧化物极易吸附痕量元素,在缺氧条件下热动力学性质很不稳定。为了提取铁锰氧化态,所用的试剂必须可以分别还原Fe3+和Mn3+(在酸性溶液中,+3价的锰较容易发生歧化反应),并使其能稳定存在于溶液中。Englund等人使用含NH2OH·HCl(0.04 mol/L)和 NaHSO3(0.01 mol/L)的HAc(25%,v/v)溶液提取沉积物中金属氧化物结合态的碘。NH2OH·HCl中含有大量的Cl-,不利于其后共沉淀实验的运行,因此我们用硫酸羟胺替代NH2OH·HCl试剂,避免了对金属氧化物结合态提取的影响。
1.5 各形态所得碘的比例
在之前的每一步中,Englund等人所用的沉积物与浸取液的混合比例为1∶15(v/v)。由于所取得的湖底沉积物总碘浓度较高且样品总量不大,采用加载体的方法浓缩各个形态的碘,所以较少的样品量就能满足该实验的要求。但是,试验采集的样品碘浓度较低,如果按样品比浸取液为1∶15的比例混合样品,则所需的浸取体积过大[12],不利于在浸取过程中磁力搅拌子的搅拌、以及浸取完成后的固液分离和127I浓度的测量和分离,会致使分离回收率变低。因此,对20 g的土壤使用250 mL的浸取液进行浸取。
2 结果与讨论
太湖沉积物样品分析利用改进后的浸取流程对样品进行浸取、分离,可交换态、有机结合态、金属氧化物态的浓度用电感耦合等离子体质谱(ICP-MS)法测定,矿物结合态(残余态)不溶于溶剂,用高温热解法测定。
为研究温度和时间因素对分离效率影响,设计正交实验,对磁力搅拌机上的加热温度和加热时间设置不同梯度,进行对照比较。例如A1-1表示样品1的可交换态。其中A代表温度参数组,B代表时间参数组;第一个数字表示样品编号,样品根据实验目的分为2组,每组4个编号,每个样品都进行一次分离,分离出4个形态;第二个数字表示形态,1可交换态,2有机结合态,3金属氧化物态,4矿物结合态(残余态),实验编号设置如表4。
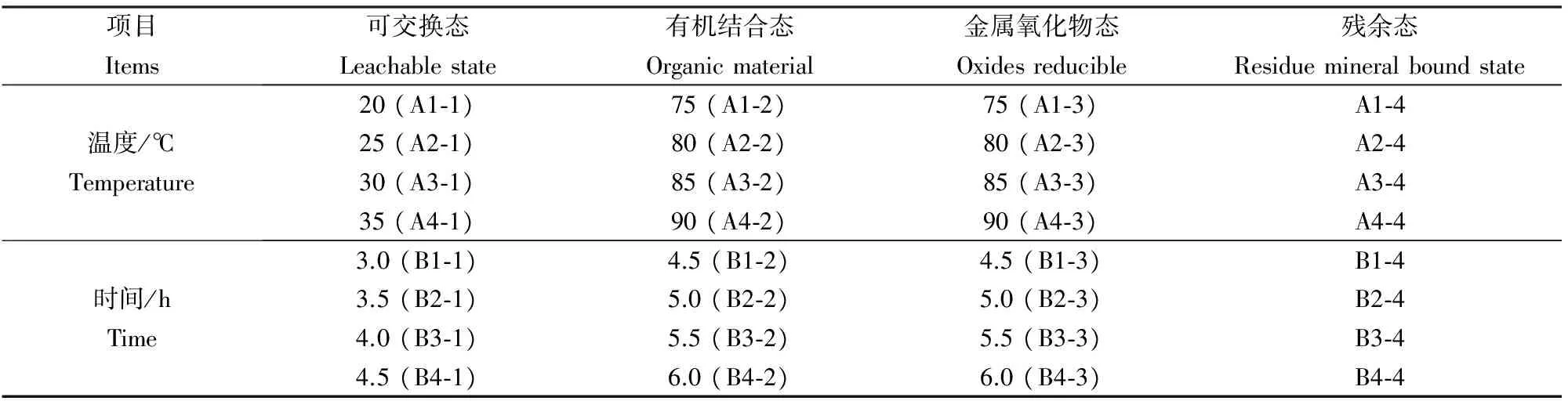
表4 实验编号Table 4 The serial number of the test
2.1 残余态示踪剂125I计数
逐级浸取后所剩下的残余态浸取液加入示踪剂125I后,通过马弗炉高温热解,然后配成特测样,取1 mL离心管中的浸取液用γ液闪计数器测定计数,测定3次并取平均值,结果见表5(本底的3次计数为42、34、40,取平均值39;示踪剂标准3次计数为52114、50818、50867,取平均值51266;土壤样品中总125I 3次计为数179.5、160、163,取平均值168)。
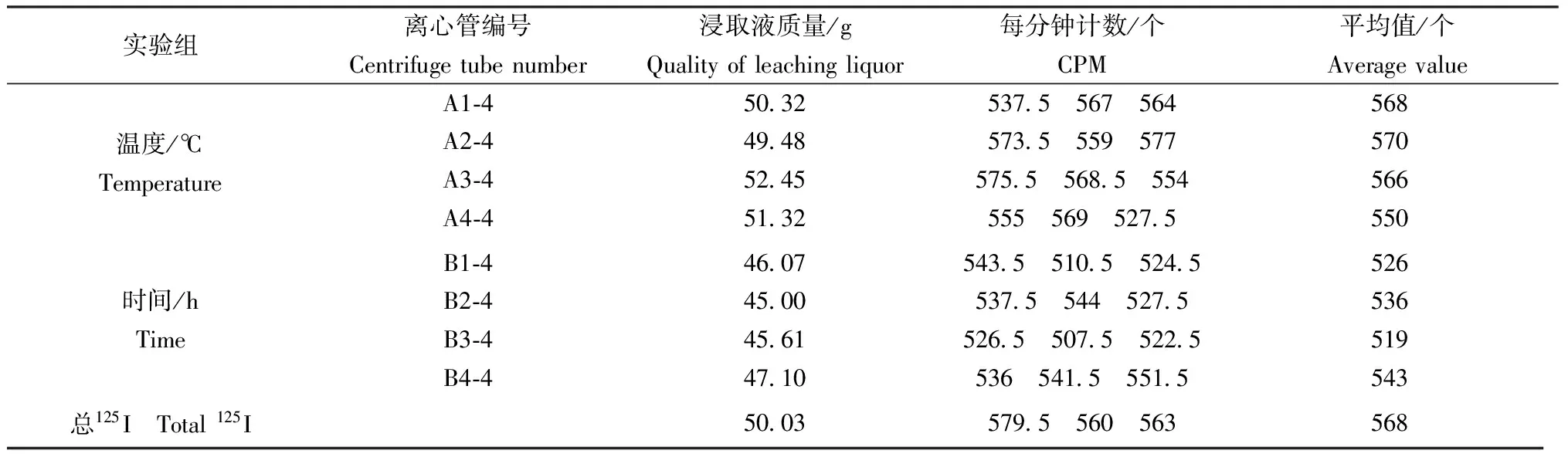
表5 高温热解法所得的残余态浸取液示踪剂125I计数Table 5 Counts of the 125I tracer in the residue mineral bound state obtained by pyrolysis at high temperature(n=3)
2.2 各形态待测液浓度的校正
为了对由ICP-MS法所测得浓度误差进行校正,专门绘制了浓度分别为50、20、10、1、0 μg/L的标准溶液ST1-5。通过拟合标准溶液浓度和所测浓度的曲线(如图2),得到一个测定值与实际值之间的校正拟合公式(1)。其中R为相关系数,R越接近于1,修正误差就越小,修正曲线见图2。
根据修正曲线,得到实际值的计算公式(1):
实际值=2.194 6×测量值-1.490 5
(1)
已知各形态实际值和稀释倍数,可以根据公式(2)计算出浸取液浓度。

(2)
再已知各形态浸取液浓度和质量,可以根据公式(3)计算出各形态碘质量。
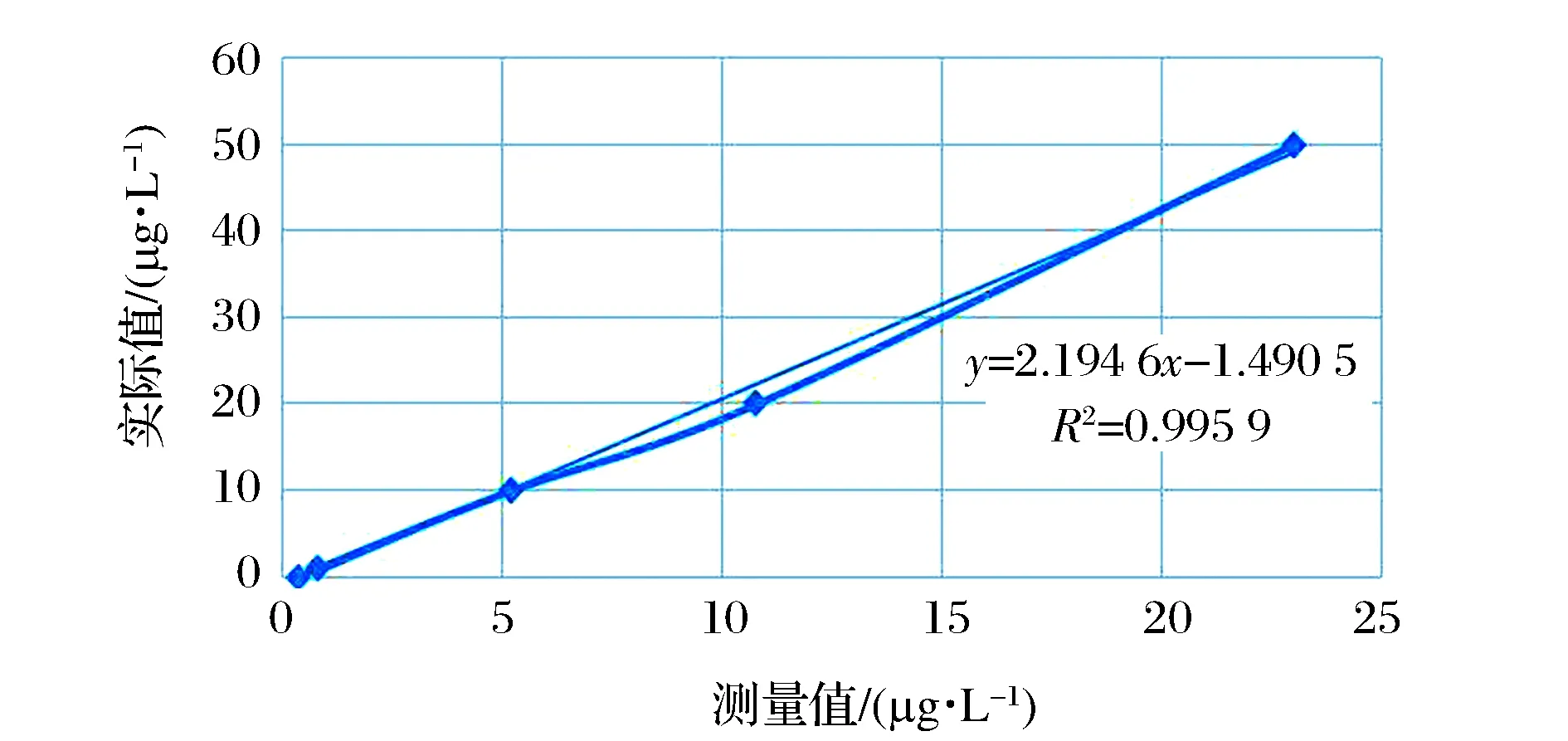
图2 数据修正曲线Figure 2 Data correction curve.

(3)
各形态碘质量如表6。
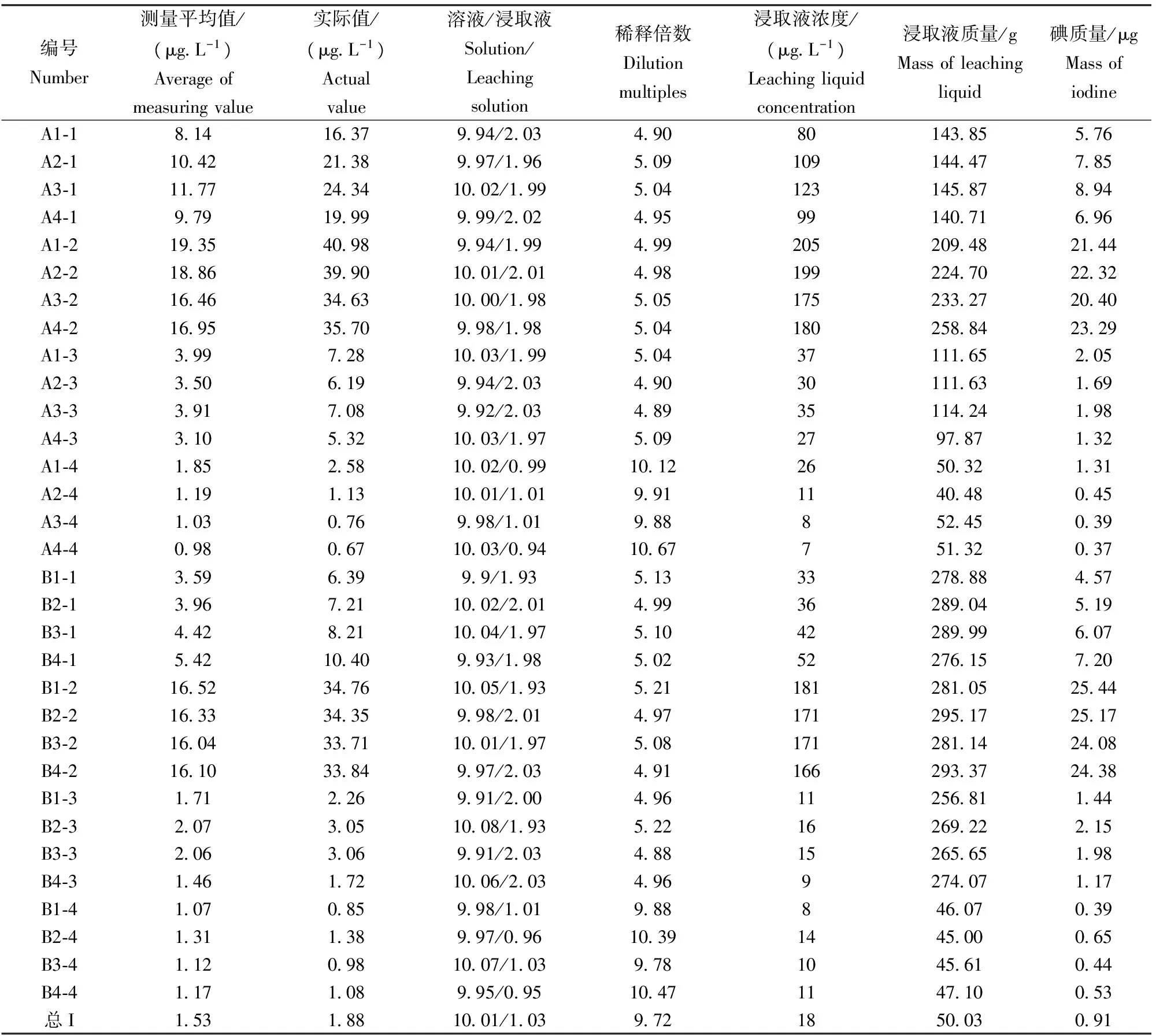
表6 各形态I真实质量Table 6 True weight of each iodine form
2.3 高温热解过程中碘回收率的计算
残余态中碘的分离用的是高温热解法并在其过程中添加了示踪剂125I,按照公式(4)计算高温热解法中示踪剂125I的回收率。
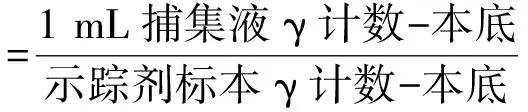
(4)
公式(4)中捕集液质量为1.00 g。
高温热解法回收率为50%左右,与其它文献一致(见表7)。
已知高温热解法的回收率和矿物结合态浸取液中碘的测定质量可以根据公式(5)计算出由高温热解法所得的浸取液中碘的真实质量(表8)。

(5) 表7 高温热解法回收率Table 7 Recovery rates for high temperature pyrolysis experiment

表8 1 mL溶液中高温热解法所得碘真实质量Table 8 Real mass of iodine obtained through pyrolysis of 1 mL solution at high temperature
每个编号样品为20 mL,故各编号样品总碘真实质量为34.92 g
2.4 碘不同形态的含量
已知I的4个形态的质量和样品中总碘质量,根据公式(6)可以算出损失率(表9)。
(6)
最终结果损失率为10%左右,这说明这个分离流程能有效提取90%的碘,是比较合理的。用各形态质量除以四个形态质量加和,可以得到各形态I含量比重,见表10。
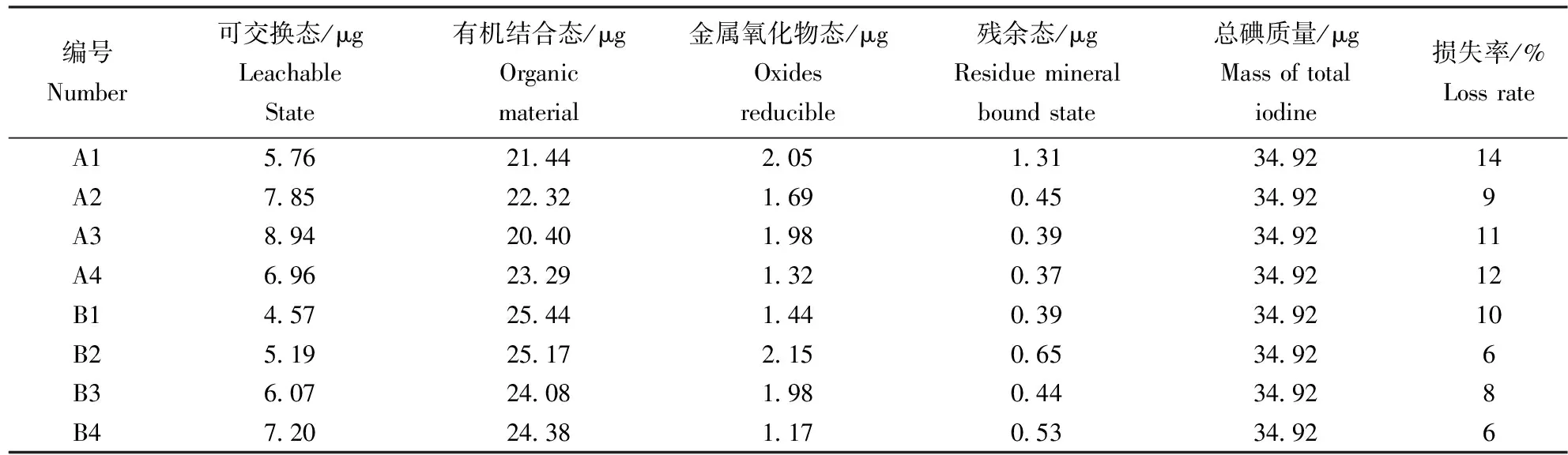
表9 总碘损失率Table 9 Loss rates of total iodine
有机结合态占总含量的比例为65%~80%,平均值为72.44%;可交换态占总含量的14%~28%,平均值为20.43%;碘在金属氧化物态和残余态的含量占总含量的比例最低,分别为4%~7%、1%~4%,平均值为5.36%、1.77%。可交换态和有机结合态总共所占比例平均值达到了92.87%,而金属氧化物态和残余态所占比例很低。这表明,在所取样品中129I主要以可交换态和有机结合态的形式存在。
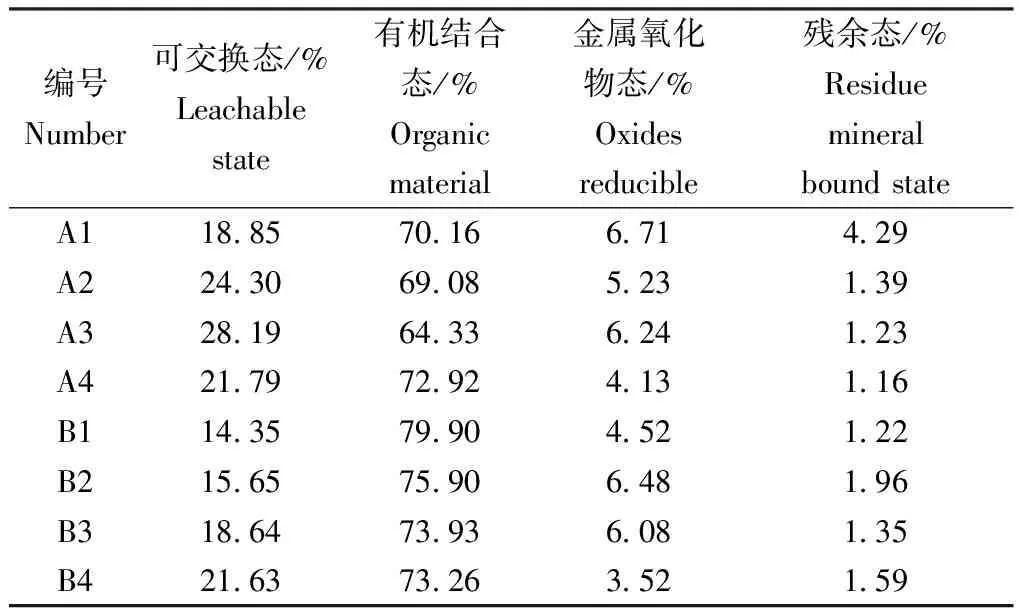
表10 样品不同形态I含量比例Table 10 Percentage of I in different states
2.5 实验条件对各形态分离效率的影响
根据表10中各个形态碘的百分含量以及相应编号所对应的温度和时间实验参数,用Excel处理可以得到磁力搅拌时的加热温度对可交换态、有机结合态、金属氧化物态分离效率的影响,如图3、4。考虑到残余态主要是矿物结合态,无法通过破坏其相来配制浸取液,只有用高温热解法测125I示踪剂在其中的回收率,不考虑实验参数对其分离效率的影响。

图3 温度对各形态分离效率的影响Figure 3 Effects of temperature on separation efficiency of different states.
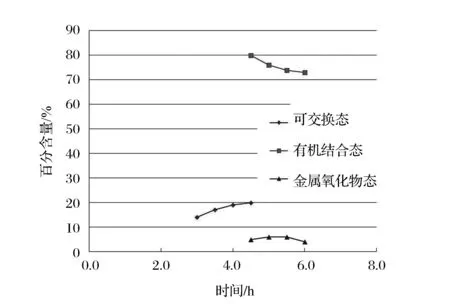
图4 时间对各形态分离效率的影响Figure 4 Effects of time on separation efficiency of different states.
从图3、4可以明显看出,磁力搅拌机加热温度和时间的改变对金属氧化物态的碘分离效率影响不大。对于金属氧化物态,提取其中的碘,主要是用羟胺对其中的Fe3+和Mn3+进行还原,使其稳定溶于溶液,从而用酸性环境来提取碘。加热温度可能没有对反应起到催化作用,抑或是Fe3+和Mn3+的氧化性很强,反应极快,而使得加热温度对其影响不大。
对于可交换态,加热温度的增加,会使溶液中离子的相互作用越剧烈,而使得溶液酸性环境中更多的含碘水溶性物质被溶解,从而使得可交换态占总碘的百分含量增大即分离效率变高,但溶液中水溶性含碘物质所占比例有限不可能一直增大,曲线会在达到一个极大值后保持水平。
而对于有机结合态,分离原理是用NaOH溶液破坏含碘物质的有机相,从而使其变成水溶态而溶于溶液被分离。一方面,可交换态中碘被分离的越多,在有机结合态分离时被碱破坏形成的水溶性碘会相应地变少,从而使有机结合态碘百分含量下降,另一方面由于总百分比的固定,以及可交换态的增加和金属氧化物态的平稳,代表有机结合态的曲线会出现相应的下滑。
总的来说,磁力搅拌过程中,加热时间和加热温度参数一定程度的增加会使可交换态的分离效率提高,但不是无限提高存在极值,有机结合态的分离效率会下降,但对金属氧化物态的影响不大。
3 结语
对沉积物中的129I建立了一套不同化学形态的逐级浸取分离流程。借鉴国际上已报道的沉积物样品中129I逐级浸取的实验流程,提出改进的逐级浸取分离流程,实验表明改进后的逐级浸取法所提取出来的总碘含量与通过高温热解法所提取出来的总碘含量相差只有10%。这表明了该流程合理可行。
研究了不同加热时间和温度对可交换态、有机结合态、金属氧化物态分离效率的影响。给出分离可交换态、有机结合态、金属氧化物结合态的适宜时间和温度分别为4.5 h、30℃,4.5 h、75℃,5.5 h、75 ℃。
[1] 谢运棉,班莹,蒋菘生,等.用串列加速器质谱计测定环境水中129I的浓度[J]. 辐射防护(RadiationProtection),1998(2):81-88.
[2] 李金英,姚继军.129I分析方法进展[M].北京:原子能出版社,2002.
[3] 崔安智,郭景儒,唐培家,等.放射化学中子活化分析法测定高放废液中的129I[J].原子能科学技术(AtomicEnergyScienceandTechnology),1992,26(2):48-51.
[4] TessierA , Campbell P G C, Bisson M. Sequential extraction procedure for the peciation of particulate trace metals[J]. Analytical Chemistry,1979,51(7):844-851.
[5] Hou X L ,Fogh C L ,Kucera J,et al. Iodine-129 and Caesium-137 in Chernobyl contaminated soil and their chemical fractionation[J]. The Science of the Total Environment, 2003,308(s 1-3):97-109.
[6] 程素敏,王娟,张岩,等.土壤样品中砷的形态分析方法研究[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry),2016,6(1):17-21.
[7] 朱延强,张媛媛.延安市污水处理厂污泥中6种重金属元素的形态分析[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry),2011,1(4):40-43.
[8] 彭刚华. 水稻土中重金属Cd的形态含量变化[J].福建环境(FujianEnvironment),2002,9(1): 349-351.
[9] 李杰,钟立峰,崔学军,等.Carius管溶样一标准加入电感耦合等离子体质谱法测定土壤中碘[J]. 岩矿测试(RockandMineralAnalysis),2006,25(1):19-21.
[10] 胡征兰,刘遗英,谢运棉,等.环境水样品中131I和125I的测定[J].辐射防护(RadiationProtection),1983(3):191-197.
[11] 何红寥,李冰,杨红霞,等.环境样品中痕量元素的化学形态分析L分析技术在化学形态分析中的应用[J].岩矿测试(RockandMineralAnalysis),2005,24(l):5l-58.
[12] Englund E, Aldahan A, Possnet G. Tracing anthropogenic nuclear activity with129I in lake sediment[J].Journal of Environmental Radioactivity, 2008,99(2):219-229.
Sequentially Leaching129I in Sediment with Different Morphologies
WANG Boyuan1,WU Haokun1,ZHANG Li2,PAN Wei1,LI Jie1,GU Zhijie1
(1.ChinaInstituteforRadiationProtection,Taiyuan,Shanxi030006,China; 2.LuoyangShipMaterialResearchInstitute,Luoyang,Henan471023,China)
Along with the development of nuclear technology,human nuclear activities including nuclear experiment, nuclear fuel reprocessing and accident of nuclear power plants, etc., lead to plenty of leakage of129I into nature. The content of129I in the sediment and its chemical form distribution is of great importance to reveal its migration patterns and settlement information。Therefore,it is very important to study the proper separation and preparation process for the129I in sediment with different morphologies. According to the characteristics of the sediment in Taihu Lake and through comparing many separation processes for separating different129I form in sediment, this paper proposed an improved sequential leaching process. By this process, under different temperature and with different times, four different forms of129I, including leachable state, organic material, oxides reducible and residue mineral bound states, were separated. Recovery rates and loss rates were calculated through high temperature pyrolysis experiment and125I tracer. The extraction efficiency of the improved sequential leaching process can reach 90%. The suitable time and temperature for separating leachable state, organic material and oxides reducible were 4.5 h, 30 ℃;4.5 h, 75 ℃;5.5 h, 75 ℃, respectively. The results indicates that the process can also be applied to the same kind of lake sediment sample analysis.
sediment; sequential leaching process; morphological analysis; iodine-129
2016-02-21
2016-04-25
王博远,男,在读研究生。E-mail:7739723630@qq.com
10.3969/j.issn.2095-1035.2016.03.001
O658
A
2095-1035(2016)03-0001-08

