蛋白质非酶糖基化终产物对足细胞自噬与凋亡的影响
陈结慧 祝胜郎 叶 玲 朱恒梅 蒋 莹 李就鸿
(深圳市第六人民医院肾内科,广东 深圳 5108052)
·论著·
蛋白质非酶糖基化终产物对足细胞自噬与凋亡的影响
陈结慧 祝胜郎*叶 玲 朱恒梅 蒋 莹 李就鸿
(深圳市第六人民医院肾内科,广东 深圳 5108052)
目的:探讨蛋白质非酶糖基化终产物(AGEs)作用下人足细胞自噬和凋亡发生情况及可能的信号转导通路。方法:体外培养永生化人足细胞,以AGEs 100 mg/L分别不同时间(0、4、8、12、24 h)刺激足细胞。Western blotting检测足细胞自噬标记性蛋白微管相关蛋白1B轻链3 -II/I(LC3- II/I)、自噬相关基因Atg5、哺乳动物雷帕霉素靶点受体(mTOR)信号通路相关蛋白p70 S6 激酶1(p-p70 S6 Kinase,p70 S6 Kinase)表达水平;荧光显微镜观察自噬溶酶体形成标志蛋白溶酶体膜蛋白(LAMP2a);AnnexinⅤ/7-AAD双染流式细胞术检测足细胞早期和晚期凋亡。结果: ①与0 h相比,100 mg/L AGEs刺激后足细胞LC3B- II/I表达水平在4、8、12、24 h均明显下降(P<0.05);Atg5蛋白表达水平在8、12、24 h均明显下降(P<0.05),在12 h下降达到最高峰;p-p70 S6 Kinase水平在4、8、12 h升高(P<0.05),在12 h达峰,在24 h再次下降;②免疫荧光染色结果显示,与0 h相比,100 mg/L AGEs刺激足细胞12 h LAMP2a表达明显减少;③与0 h相比,100 mg/L AGEs刺激后足细胞发生早期凋亡+晚期凋亡比例在4、8、12、24 h逐渐增加(P<0.05),在12 h达峰(14.07%)。结论: AGEs刺激下人足细胞自噬减少,凋亡增加,伴随着mTOR/p70 S6 Kinase信号通路激活。AGEs可能通过mTOR/p70 S6 Kinase信号通路途径调节足细胞自噬与凋亡,从而导致足细胞损伤。
足细胞;自噬;凋亡;糖尿病肾病
足细胞的损伤和丢失是糖尿病肾病(DN)的主要病理改变之一。自噬和凋亡是调节细胞存活和死亡的两种不同方式,在体内呈一个动态平衡的过程,共同决定细胞的命运。已有研究表明,自噬在肾脏损伤中起保护作用[1]。在糖尿病肾病动物模型中,观察到肾脏固有细胞自噬的减少,凋亡的增加,提示自噬异常参与了糖尿病肾病的发病机制[2-3]。然而,进一步的体外研究及相关信号通路的研究鲜有报道。蛋白质非酶糖基化形成的晚期糖基化终产物(AGEs)在介导慢性高血糖致DN 的发生发展中发挥着重要作用。本研究拟通过体外培养人肾脏足细胞,探讨AGEs刺激下人足细胞自噬和凋亡发生的情况及可能的作用通路,为进一步明确糖尿病肾病的发病机制提供依据。
1 材料与方法
1.1 材料
1.1.1 试剂 RPMI 1640培养基(Gibco公司,美国),γ-INF(PT公司,美国),AGEs-BSA(Biovision公司,美国),MTS(Promega公司,美国),LC3B抗体、Atg5抗体、p70 S6 kinase抗体(CST公司,美国),p-p70 S6 kinase抗体(Santa Cruz公司,美国),GAPDH(CST公司,美国),LAMP2a抗体(Abcam公司,英国),DAPI染核液(Invitrogen公司,美国),Annexin V和7-AAD(BD Biosciences公司,美国)。
1.1.2 细胞培养 条件永生性人足细胞由南方科技大学生物系惠赠,参照文献[4]方法培养。种植在含ITS(胰岛素5 mg/L、转铁蛋白5 mg/L和亚硒酸钠5 μg/L)、10%胎牛血清、100U/ml青霉素、100 U/mL链霉素的RPMI 1640培养液中,置于33 ℃、5%CO2培养箱培养。足细胞在33 ℃ CO2培养箱中处于增殖状态,培养液中加入50 U/mL γ-INF以促进其增殖,每传两代γ-INF减为20 U/mL,最后以10 U/mL维持。待细胞生长至20%~30%融合时,转入37 ℃培养箱,无需加入γ-INF,诱导分化1~2周成为已分化足细胞。1.1.3 细胞分组 足细胞给予AGEs 100 mg/L干预,分别刺激0,4,8,12,24 h。MTS法检测细胞增殖活性。Western blot ting法检测自噬标志蛋白(LC3B-Ⅱ/Ⅰ、Atg5) 和mTOR信号通路相关蛋白(p70 S6 kinase、p- p70 S6 kinase)表达。流式细胞术测细胞早期和晚期凋亡。选取最佳作用时间点,免疫荧光染色检测自噬溶酶体标志蛋白LAMP2a表达。
1.2 主要实验方法
1.2.1 Western Blotting检测蛋白表达 将每组足细胞彻底吸干培养基,每孔加入120 μL RIPA,用细胞刮刮取细胞。用Bradford法进行蛋白定量后,采用10%浓度的聚丙烯酰胺凝胶检测目的蛋白。经SDS-PAGE电泳后将蛋白转至PVDF膜上,5%脱脂牛奶封闭后,将相应的一抗 4 ℃孵育过夜,用TBST洗2次后,用相应的稀释好的二抗室温下孵育1~2 h,用TBST洗3次后,进行化学发光显影。用Image J分析目标条带的光密度值。以GAPDH作为内参照,比较不同处理后上述蛋白表达的差异。
1.2.2 免疫荧光检测自噬溶酶体标志蛋白LAMP2a表达 用预冷的4%PFA(in PBS),4 ℃放置固定40 min或常温10 min;室温吸去PFA,用破膜剂(0.1%Triton X-100 in PBS)洗2次;室温下用3%封闭血清封闭1 h;用PBS洗3遍;加入相应的一抗工作液(in 3%BSA in PBS),4 ℃孵育过夜(4℃过夜后室温复温45 min);PBS洗3次;滴加荧光标记的二抗,室温避光孵育1 h。PBS洗3次;用1 000×DAPI避光染色10 min;用PBS洗3次,2 min/次;Mounting Medium封片,待Mounting Medium凝固后采用全自动正立荧光显微镜(Imager Z1)拍照。
1.2.3 凋亡实验 将已分化2周且生长状态良好的细胞接种到6孔板中,待过夜贴壁后处理如下:加入100 mg/L的AGEs-BSA刺激足细胞0 h,4 h,8 h,12 h,24 h。无EDTA胰酶消化并收集细胞,PBS清洗细胞2次。用1倍的Binding Buffer重悬细胞为1×106个细胞/mL。取100 μL上述悬液至流式管中。分别加入5 μL Annexin V和5 μL 7-AAD。混匀,室温避光孵育15 min。加入400 μL的Binding Buffer混匀后1 h内上流式细胞仪检测。
1.2.4 MTS实验 取已分化2周且生长状态良好的人肾足细胞,每孔细胞3 000个,每组3个复孔,过夜贴壁。加入100 mg/L AGEs-BSA刺激足细胞0,4,8,12,24 h后,加入MTS试剂,比例为1∶10,即100 μL培养液加入10 μL。37℃孵育1 h后,酶标仪检测490 nm吸光值(A)。
1.3 统计学方法
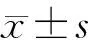
2 结 果
2.1 AGEs作用不同时间后足细胞增殖活性变化
与对照组0 h相比,AGEs 100 mg/L刺激足细胞4、8、12 h后,足细胞增殖活性无明显减低,刺激24 h后足细胞增殖活性下降,差异有统计学意义(P<0.05)。见图1。

*0.80.60.40.20ODvalue0481224t/h
注:与0 h相比,*P<0.05
图1 AGEs(100 mg/L)刺激下不同时间足细胞增殖活性(MTS)
2.2 AGEs作用不同时间后足细胞LC3B、Atg5、p70 S6 kinase和p-p70 S6 kinase蛋白表达变化
人足细胞存在基础水平LC3B-Ⅱ/Ⅰ和Atg5高表达;与对照组0 h相比, AGEs 100 mg/L刺激后足细胞LC3B-II/I蛋白表达水平在4、8、12、24 h均明显下降,差异有统计学意义(P<0.05);Atg5蛋白表达水平在8、12、24 h下降(P<0.05),在12 h达峰; p-p70 S6 Kinase水平在4、8、12 h升高(P<0.05),在12 h达峰,在24 h再次下降,而p70 S6 Kinase水平无明显变化。见图2~5。

LC3B-ⅠLC3B-ⅡGAPDH0481224****1.20.80.40RelatlveLC3B-Ⅱ/Ⅰexpresslon0481224t/h
注:与0 h相比,*P<0.05
图2 LC3BⅡ/Ⅰ表达水平
2.3 AGEs作用不同时间后足细胞凋亡情况
与0 h(早期凋亡+晚期凋亡比例为4.7%+4.17%)相比,AGEs 100 mg/L刺激足细胞4 h后细胞早期凋亡+晚期凋亡比例(6.6%+4.91%)无明显增加;刺激8 h、12 h及24 h后细胞早期凋亡+晚期凋亡比例明显增加,分别为5.5%+7.05%、8.22%+5.85%及6.72%+7.1%,差异有统计学意义(P<0.05)。见图6。

***0481224t/h04812241.20.80.40Atg5GAPDHRelatlveAtg5expresslon
注:与0 h相比,*P<0.05
图3 Atg5表达水平

Relatlvep-p7-S6Kliaseexpresslon0481224t/h4.03.02.01.00p-p7-S6KliaseGAPDH0481224
注:与0 h相比,*P<0.05
图4 p-p70 S6 Kinase表达水平

04812240481224t/h1.20.80.40Relatlvep70S6Kliaseexpresslon70S6KliaseGAPDH
注:与0 h相比,*P<0.05
图5 p 70 S6 Kinase 表达水平

图6 AGEs(100 mg/L)刺激下不同时间足细胞凋亡
2.4 AGEs作用12 h后足细胞溶酶体膜蛋白LAMP2a表达情况
人足细胞存在基础水平自噬溶酶体形成标志蛋白溶酶体膜蛋白(LAMP2a)高表达;与0 h组相比,AGEs 100 mg/L刺激足细胞12 h后LAMP2a表达明显减少。见图7。

0h12hLAMP2aDAPIMerge
图7 AGEs (100 mg/L)刺激足细胞12 h后LAMP2a表达水平(×200)
3 讨 论
糖尿病肾病(DN)是糖尿病的一种常见微血管并发症,严重影响糖尿病患者的存活率及生存质量。DN的发病机制非常复杂,至今尚未完全明确。足细胞是一种高度特异性的终末分化的脏层上皮细胞,附着于肾小球基底膜外侧,参与构成肾小球滤过屏障的最外层[5]。近年来的研究显示,作为肾小球滤过屏障重要组成成分的足细胞损伤,在糖尿病肾病的进展中发挥了重要作用。DN中足细胞可出现密度和数量减少、足突增宽、足细胞脱落等改变,且可从尿中丢失,导致早期蛋白尿和后续的肾脏硬化,而足细胞凋亡是造成足细胞丢失的主要原因。有关足细胞损伤的发病机制较为复杂,至今尚未完全阐明,目前认为与多种途径有关。其中,蛋白质非酶糖基化形成的AGEs,在介导高血糖致DN 的足细胞的损伤和丢失中发挥重要作用[6]。拮抗足细胞的损伤可能是DN的治疗新策略。
自噬是细胞内一个多步骤的降解过程,由膜包囊泡包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体,并与溶酶体融合形成自噬溶酶体,进行降解,以维持细胞结构、功能和代谢的稳态[7]。同时,自噬和凋亡是导致细胞存活和死亡的两种方式,细胞内自噬与凋亡的发生是一个动态平衡的过程,共同决定细胞的命运。其中,哺乳动物雷帕霉素靶蛋白(mTOR)是调节自噬和凋亡的共同枢纽。在正常生理状态下,自噬现象亦广泛存在于足细胞、近端肾小管上皮细胞、隨袢升支粗段等部位,起到维持肾脏结构、功能和代谢的稳态的作用[8]。目前已有较多研究证实了自噬的肾脏保护作用。在缺血-再灌注损伤的细胞和动物模型中观察到近端肾小管上皮细胞自噬增强,而抑制自噬可导致缺血-再灌注损伤引起的细胞凋亡增加[9]。在顺铂诱导的肾损伤模型中,观察到近端肾小管上皮细胞LC3- II的增高及电镜下自噬溶酶体的增加[10],提示自噬参与急性肾损伤的修复。在慢性环孢素肾病中,细胞通过激活自噬作用,来保护自身对抗死亡[11]。在自噬基因Atg5敲除小鼠中,近端肾小管缺乏自噬,出现严重蛋白尿并导致肾小管损伤,同时导致近端肾小管上皮细胞凋亡[12]。在体外培养的足细胞中,自噬呈基础水平高表达,抑制足细胞自噬可诱导足细胞凋亡,自噬可能通过调控内质网应激途径来调控细胞存亡[13]。本研究中,我们在体外培养的人足细胞中观察到基础水平的自噬标志性蛋白LC3B-II及自噬相关基因ATg5蛋白高表达,免疫荧光显示自噬溶酶体标志性蛋白LAMP2a存在基础水平的高表达,提示自噬现象存在于正常状态人足细胞,与文献报道相符,亦提示一定水平的自噬对维持人足细胞的结构、功能和代谢稳态可能起着重要作用。
研究表明,DN中存在自噬稳态水平降低[14]。Wu等[2]在链脲霉素糖尿病大鼠模型中发现造模成功后1周肾组织中Beclin-1开始升高,至第8周达峰,而LC3-II水平降低。Velagapudi等[3]发现,高糖诱导的糖尿病大鼠肾皮质凋亡细胞增加,同时有tuberin的磷酸化伴随着mTOR的激活(p70 S6 Kinase磷酸化)和Bcl-2失活、Caspase-3活化和PARP的降解,在体外高糖环境下培养近端肾小管上皮细胞(PTE)tuberin 和p70 S6 Kinase磷酸化增强,Caspase-3 活性增强,用mTOR抑制剂雷帕霉素预处理PTE减少了凋亡细胞数,提示tuberin/m TOR 通路可促进糖尿病肾小管近端上皮细胞凋亡。Tagawa和Lenoir等发现,自噬基因敲出的2型和1型糖尿病模型小鼠均可出现足细胞丢失和大量蛋白尿[15-17]。以上研究表明,自噬的异常参与了糖尿病肾病的发病机制。然而,目前对糖尿病足细胞自噬状态的改变的研究尚少,其可能的作用通路亦尚未明确。
为明确DN足细胞自噬与凋亡的关系及可能的作用通路,我们采用AGEs刺激体外培养的人足细胞,观察不同时间足细胞自噬和凋亡发生情况及mTOR信号通路蛋白表达情况。结果显示AGEs刺激能诱导人足细胞mTOR(p70 S6 Kinase磷酸化)活化,下调自噬标志性蛋白LC3B-II及自噬相关基因Atg5蛋白表达,免疫荧光亦显示自噬溶酶体形成减少,而同时,人足细胞早期凋亡及晚期凋亡增加。以上结果提示,AGEs刺激下足细胞自噬减少,凋亡增加,同时伴有被认为是自噬和凋亡的调节中枢的mTOR信号通路的激活。AGEs可能通过限制足细胞的保护性自噬,促进足细胞凋亡而参与DN的发生发展过程。
本研究中,AGEs刺激下人足细胞自噬相关基因Atg5蛋白表达水平的下调在12 h达到高峰,同时mTOR信号通路蛋白p-p70 S6 Kinase表达水平的上调也在12 h达到高峰,而在24 h再次下降。结合MTS结果足细胞在AGEs刺激24 h增殖活性已明显减低,考虑刺激24 h mTOR信号通路蛋白表达水平的再次下调可能与此时细胞活性已下降有关。
本研究亦存在一定的不足之处。在本研究中,我们并未使用mTOR抑制剂来观察AGEs刺激下足细胞自噬与凋亡的变化。因此,本研究仅可得出AGEs可刺激人足细胞自噬减低,凋亡增加,伴随着mTOR信号通路的激活的结论,提出AGEs通过mTOR信号通路抑制足细胞自噬,诱导足细胞凋亡可能性。进一步的证实有待更深入的信号通路方面研究。
综上所述,人足细胞存在基础水平自噬高表达。AGEs 刺激下足细胞自噬减少,凋亡增加,伴随着mTOR/p70-S6 Kinase信号通路激活。AGEs可能通过mTOR/p70-S6 Kinase信号通路途径调节足细胞自噬与凋亡,从而导致足细胞损伤。进一步的研究有待更深入地开展。
[1] Kimura T,Takabatake Y,Takahashi A,et al. Autophagy protects the proximal tubule from degeneration and acute ischemic injury[J].J Am Soc Nephrol,2011,22(5):902-913.
[2] Wu WH,Zhang MP,Zhang F,et al. The role of programmed cell death in streptozotocin-induced early diabetic nephropathy[J]. J Endocrinol Invest,2011,34(9):e296-e301.
[3] Velagapudi C,Bhandari BS,Abboud-Werner S,et al. The tuberin/mTOR pathway promotes apoptosis of tubular epithelial cells in diabetes[J]. J Am Soc Nephrol,2011,22(2):262-273.
[4] Qu H,Tu Y,Shi X,et al.Kindlin-2 regulates podocyte adhesion and fibronectin matrix deposition through interactions with phosphoinositides and integrins[J]. J Cell Sci,2011,124(6):879-891.
[5] Kawachi H,Miyauchi N,Suzuki K,et al. Role of podocyte slit diaphragm as a filtration barrier[J]. Nephrology (Carlton),2006,11(4):274-281.
[6] Tan KC,Chow WS,Ai VH,et al. Advanced glycation end products and endothelial dysfunction in Type 2 diabetes[J]. Diabetes Care,2002,25(6):1055-1059.
[7] Mizushima N,Komatsu M. Autophagy: renovation of cells and tissues[J]. Cell,2011,147(4):728-741.
[8] Mizushima N,Yamamoto A,Matsui M,et al. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker[J]. Mol Biol Cell,2004,15(3):1101-1111.
[9] Jiang M,Liu K,Luo J,et al. Autophagy is a renoprotective mechanism during in vitro hypoxia and in vivo ischemia-reperfusion injury[J]. Am J Pathol,2010,176(3):1181-1192.
[10] Inoue K,Kuwana H,Shimamura Y,et al. Cisplatin-induced macroautophagy occurs prior to apoptosis in proximal tubules in vivo[J]. Clin Exp Nephrol,2010,14(2):112-122.
[11] Pallet N,Bouvier N,Legendre C,et al. Autophagy protects renal tubular cells against cyclosporine toxicity[J].Autophagy,2008,4(6):783-791.
[12] Yamahara K,Kume S,Koya D,et al. Obesity-mediated autophagy insufficiency exacerbates proteinuria-induced tubulointerstitial lesions[J]. J Am Soc Nephrol,2013,24(11):1769-1781.
[13] Fang L,Li X,Luo Y,et al. Autophagy inhibition induces podocyte apoptosis by activating the pro-apoptotic pathway of endoplasmic reticulum stress[J]. Exp Cell Res,2014,322(2):290-301.
[14] Kume S,Thomas MC,Koya D. Nutrient sensing,autophagy,and diabetic nephropathy[J]. Diabetes,2012,61(1):23-29.
[15] Tagawa A,Yasuda M,Kume S,et al. Impaired podocyte autophagy exacerbates proteinuria in diabetic nephropathy[J]. Diabetes,2016,65(3):755-767.
[16] Lenoir O,Jasiek M,Henique C,et al. Endothelial cell and podocyte autophagy synergistically protect from diabetes-in-duced glomerulosclerosis[J]. Autophagy,2015,11(7):1130-1145.
[17] 曹 柳,刘 琼,刘宽芝,等.2型糖尿病大鼠骨骼肌Toll样受体4的表达及辛伐他汀的干预作用[J].中华生物医学工程杂志,2014,41(1):22-24.
(本文编辑:郑颖)
Effects of non-enzymatic advanced glycation end products of proteins on autophagy and apoptosis of podocytes
ChenJiehui,ZhuShenglang,YeLing,ZhuHengmei,JiangYing,LiJiuhong
(DepartmentofNephrology,ShenzhenSixthMunicipalPeople’sHospital,Shenzhen,Guangdong5108052,China)
*Correspondingauthor:Email:nszhushenglang@163.com
Objective:To investigate the autophagy and apoptosis of podocytes under the effects of non-enzymatic advanced glycation end products (AGEs) of proteins,and the potential signal transduction pathway. Methods: Immortalized human podocytes were culturedinvitro,and stimulated with 100 mg/L AGEs at different time points (0,4,8,12 and 24 h). The expression levels of protein microtubule associated protein 1B light chain 3-II/I (LC3B-II/I),autophagy-related gene 5 (Atg5) and mammalian target of rapamycin receptors (mTOR) signaling pathway related protein p70 S6 kinase 1 (p-p70 S6 Kinase,p70 S6 Kinase) were determined by Western blotting. The lysosomal membrane protein (LAMP2a) was determined by fluorescence microscope. The early and late apoptosis of podocytes were determined by annexin V/7-AAD double staining flow cytometry. Results: ① Compared with that at 0h,the protein expression level of LC3B- II/I in podocytes at 4,8,12,and 24 h after 100 mg/L AGEs stimulation was significantly decreased (P<0.05),respectively; the protein expression level of Atg5 was significantly decreased at 8,12 and 24 h,respectively (P<0.05),and peaked at 12 h after the decrease; the levels of p-p70 S6 Kinase increased at 4,8 and 12 h (P<0.05),and peaked at 12 h,and decreased again at 24 h; ② Immunofluorescence staining showed that the podocytes LAMP2a expression was significantly decreased at 12 h after 100 mg/L AGEs stimulation,compared with that at 0 h; ③ Compared with that at 0 h,the podocytes early+late apoptosis rate increased gradually at 4,8,12 and 24 h after 100 mg/L AGEs stimulation (P<0.05),and peaked at 12 h (14.07%). Conclusion: The autophagy of human podocytes is decreased and the apoptosis is increased with AGEs stimulation,which is accompanied by the activation of mTOR/p70 S6 Kinase signal pathway. AGEs may regulate autophagy and apoptosis of podocytes through the mTOR/p70 S6 Kinase pathway,leading to the injury podocytes.
podocytes; autophagy; apoptosis; diabetic nephropathy
10.3969/j.issn.2095-9664.2016.05.02
深圳市科技局基金(201302197)
*通讯作者:Email: nszhushenglang@163.com
R329.2
A
2095-9664(2016)05-0009-06
2016-01-26)

