重度肾功能不全患者经皮冠状动脉介入术后有关造影剂肾病的病例分析
杨玉琴,舒 冰,陈 斌,姜 玲(.芜湖市第二人民医院药剂科,安徽 芜湖 4000; .安徽医科大学附属省立医院药剂科,安徽 合肥 3000)
重度肾功能不全患者经皮冠状动脉介入术后有关造影剂肾病的病例分析
杨玉琴1*,舒冰2 #,陈斌1,姜玲2(1.芜湖市第二人民医院药剂科,安徽 芜湖241000; 2.安徽医科大学附属省立医院药剂科,安徽 合肥230001)
DOI10.14009/j.issn.1672-2124.2016.02.038
摘要目的:提高对造影剂肾病(contrast agent nephropathy,CAN)的进一步认识,做到早期预防和及时治疗。方法:对2例重度肾功能不全患者实施经皮冠状动脉介入术后有关CAN进行病例分析和相关文献分析。结果与结论:2例患者均属于CAN发生的高危人群,1例患者行冠状动脉造影术时给予积极预防CAN治疗,未发生CAN;而另1例患者未给予充分的预防CAN治疗,发生了CAN。CAN是一种医源性的肾损害,通过对患者进行危险分层,明确高危状况,选择合适的造影剂及控制其剂量,积极给予水化等预防性干预等措施,临床上可减少CAN的发生。
关键词肾功能不全; 造影剂肾病; 病例分析; 危险分层; 预防
Analysis on 2 Cases of Contrast-induced Nephropathy with Severe Renal Insufficiency after PCI
YANG Yuqin1, SHU Bing2, CHEN Bin1, JIANG Ling(1.Dept.of Pharmacy, the Second People’s Hospital of Wuhu, Anhui Wuhu 241000, China; 2.Dept.of Pharmacy, Anhui Provincial Hospital Affiliated to Anhui Mdeical University, Anhui Hefei 230001, China)
ABSTRACTOBJECTIVE:To enhance the further understanding of the contrast-induced nephropathy, and to achieve early prevention and timely treatment. METHEDS: Analysis of cases study and related literature were conducted on 2 cases of contrast-induced nephropathy with severe renal insufficiency after PCI. RESULTS & CONCLUSIONS: 2 patients were at high risk for the occurrence of contrast-induced nephropathy. One patient had no contrast-induced nephropathy because of the active prevention during coronary arteriography, while another patient got contrast-induced nephropathy without prevention. Contrast-induced nephropathy is a kind of iatrogenic renal damage. Through the risk stratification of patients, high-risk conditions can be conformed; suitable contrast agents with proper control of the dose and positive hydration of preventive intervention measures can reduce the occurrence of contrast-induced nephropathy in clinic.
KEYWORDSRenal insufficiency; Contrast-induced nephropathy; Case analysis; Risk stratification; Prevention
随着经皮冠状动脉介入术(percutaneous transluminal coronary intervention,PCI)的广泛开展,造影剂的使用日益广泛,造影剂肾病(contrast agent nephropathy,CAN)的发生率也明显增加,已成为继肾灌注不足和肾毒性药物引起的医源性肾损害的第3大原因[1]。CAN在普通人群中的发病率为1%~6%,但在高危人群中的的发病率可达30%~70%[2]。近期研究结果证实,发生CAN患者的病死率为34%,而年龄匹配、接受造影剂但未发生CAN的对照组患者的死亡率为7%,特别是行冠状动脉造影术(coronary arteiy angiography,CAG)后发生CAN而需紧急透析的患者预后更差,有报道称其死亡率高达62%[3]。目前,对CAN尚无特效治疗方法,因此重视CAN的早期预防对降低其发生率及改善预后具有重要的意义。现笔者通过对重度肾功能不全患者PCI术后有关CAN的2例病例分析和相关文献分析,旨在提高对CAN的进一步认识,做到早期预防和及时治疗。
1病例资料
病例1:患者周某某(以下简称“A患者”),男性,75岁,身高170 cm,体质量75 kg。因“胸痛心慌12 d”入院,心电图显示为急性心肌梗死演变期图形,查心肌酶及肌钙蛋白正常,生化示患者血尿素氮(BUN)20.35 mmol/L,肌酐(CREA)611.1 mmol/L,肌酐清除率(CCR)10.09 ml/min。诊断为:冠心病,急性心肌梗死演变期,心功能Ⅲ级;高血压病;慢性肾功能不全。入院后予以硫酸氢氯吡格雷1次75 mg、1日1次,抗血小板聚集;阿托伐他汀钙1次20 mg、1日1次,调脂稳定斑块;5%葡萄糖注射液300 ml+肾康注射液100 ml、1日1次;联合肾衰宁片1次4片、1日3次,护肾;呋塞米注射液20 mg、1日1次,利尿等处理。患者入院后,胸闷、胸痛症状未再发,且患者慢性肾脏病5期,故不急于行CAG术,应先改善患者肾功能。入院第4日,患者CREA 485 μmol/L;入院第9日,患者CREA 369 μmol/L,行CAG术示:三支病变,于回旋支植入2枚药物支架。患者术中选用等渗非离子型造影剂:碘克沙醇,且严格控制造影剂用量。术前12 h至术后24 h给予持续水化治疗[共水化0.9%氯化钠注射液2 500 ml、静脉滴注,滴速约为1.25 ml/min],患者术前术后24 h尿量都为3 200 ml,同时术后立即给予预防性血液透析1次;入院第11日,患者CREA 321 μmol/L;入院第14日,患者未诉有胸部不适症状,且肾功能未见恶化,予以带药出院。
病例2:患者王某某(以下简称“B患者”),男性,79岁,身高172 cm,体质量70 kg。因“反复胸痛3年余,加重1年”入院,查肌钙蛋白0.298 μg/L,心肌酶正常,血生化示患者CREA 599.30 μmol/L,CCR为9.04 ml/min。诊断为:冠心病,不稳定性心绞痛,心功能Ⅲ级;高血压病;慢性肾功能不全;腹股沟疝切除术后。入院后,予以硫酸氢氯吡格雷1次75 mg、1日1次,抗血小板聚集;阿托伐他汀钙1次20 mg、1日1次,调脂稳定斑块;5%葡萄糖注射液300 ml+肾康注射液100 ml、1日1次;联合肾衰宁片1次4片、1日3次,护肾;托拉塞米注射液20 mg、1日2次;螺内酯1次20 mg、1日1次,利尿等处理。入院第3日,上午10:00左右,患者突发胸痛,持续不能缓解,心电图提示前壁、下壁ST段压低,急诊行CAG术示:左前降支近段急性闭塞,无前向血流;急行PCI术于左主干开口至前降支远段靶病变处串联植入3枚药物支架。患者术前CREA 643.10 μmol/L,术中选用等渗非离子型造影剂:碘克沙醇,且严格控制造影剂用量。但患者术前未能给予水化治疗,且术后只给予0.9%氯化钠注射液500 ml、静脉滴注水化治疗,水化量偏少,同时患者术后未能及时给予血液透析治疗。入院第4日,患者CREA 724.20 μmol/L,且尿量减少,水钠潴留现象加重,诱发急性心力衰竭,同时患者血钾升高至5.52 mmol/L,凝血象也出现异常,国际标准化比值(international normalization ratio,INR)13.61。患者术后24 h之内CREA升高了81.1 μmol/L,可以诊断为CAN。治疗上立即停用具有保钾作用的药物螺内酯及可能加重肾功能损伤的药物,并强化利尿治疗。入院第5日,患者诉有胸闷及气促感,心率126次/min,呈奔马律,24 h尿量1 040 ml,CREA 714.60 μmol/L。患者心力衰竭加重,急给予无肝素血液透析治疗,脱水量800 ml;入院第6日,患者心率116次/min,律齐,血钾4.49 mmol/L,CREA 556 μmol/L。行无肝素透析治疗,脱水量900 ml;入院第8、10、12、14日,行规律血液透析治疗,肌酐维持在600 μmol/L左右;入院第16日,患者尿量较前稍增加,胃肠道症状较前改善,CREA有所降低(414 μmol/L),病情较稳定,转至肾内科继续治疗。
2位患者的CREA变化详见图1(注:●,A患者行CAG+PCI术,术后立即给予1次血液透析治疗;▲,B患者行CAG+PCI术)。
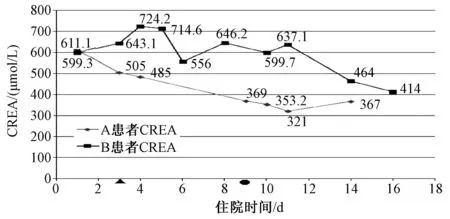
图1 2位患者的CREA变化图Fig 1 Changes of creatinine in 2 patients
2讨论
2.1CAN的危险因素评分
肾功能不全是发生CAN最重要的危险因素。徐红等[4]的研究结果显示,肾功能不全患者在行CAG术后肾功能进一步恶化:CREA>176.8μmol/L者,CAN的发生率为60%。CAN的基本病理基础是肾小管坏死,其发病机制主要是造影剂引起的肾脏髓质缺血性损伤,造影剂直接损伤肾小管,造成肾小管阻塞,故内皮细胞功能不良的患者,如糖尿病、动脉粥样硬化和高血压病患者更易发生CAN。另外,大剂量使用造影剂及造影前同时使用了某些药物亦是CAN的危险因素,如非甾体类抗炎药可抑制舒血管前列腺素的产生,引起急性肾衰竭,造影剂可加重其肾损害;环孢素和他克莫司可通过氧自由基损害肾脏;氨基糖苷类抗菌药物可引起肾小管间质损害;二甲双胍可引起乳酸酸中毒和急性肾衰竭等。
CAN的危险因素具有累加协同效应[5],故危险因素的数目与CAN的发生率密切相关。Rich MW等[6]研究结果发现,CAN的发病率与共存危险因素数目直接相关,0、1、2、3、4个危险因素CAN的发病率分别为1.2%、11.2%、21.4%、60.0%和100.0%。故冠心病患者行CAG术前需评估危险因素。《碘对比剂使用指南(2版)》[7]中制订了CAN危险因子积分预测评分表,根据累积评分估算患者发生CAN的风险。A患者与B患者同时具有以下多项CAN的危险因素:(1)肾功能不全(A患者CREA 611.1 μmol/L,CCR为10.09 ml/min;B患者CREA 599.30 μmol/L,CCR为9.04 ml/min);(2)充血性心力衰竭;(3)年龄>70岁;(4)贫血[A患者的血红蛋白(HGB)为60 g/L,红细胞压积(HCT)为17.3%;B患者的HGB为85 g/L,HCT为25.6%];(5)有蛋白尿;(6)高血压病。根据《碘对比剂使用指南(2版)》[7]中CAN危险因子积分预测评分方法,对上述2位患者的CAN危险因素进行评分,结果见表1(判定标准为,≤5分:CAN风险为7.5%,透析风险为0.04%;6~10分:CAN风险为14.0%,透析风险为0.12%;11~16分:CAN风险为26.1%,透析风险为1.09%;≥16分:CAN风险为57.3%,透析风险为12.6%)。由表1结果可见,A、B 2位患者均属于CAN发生的高危人群,为降低CAN的发生率,在行CAG时必须做好CAN的预防工作。
2.2预防CAN的方法
2.2.1水化:水化是目前公认的最有效的预防CAN的措施[6]。水化的目的是增加血容量,以产生足够的尿量,利于排出造影剂。目前的水化疗法主要包括碳酸氢钠水化、0.9%氯化钠注射液水化和碳酸氢钠联合0.9%氯化钠注射液水化3种不同的水化方案。部分研究结果提示,预防CAN碳酸氢钠优于0.9%氯化钠注射液[8];但也有研究指出,两者对于预防CAN没有差异[9]。杨满等[10]对不同水化疗法预防CAN的Meta分析显示,无论是碳酸氢钠还是碳酸氢钠联合0.9%氯化钠注射液,目前尚无证据表明二者优于0.9%氯化钠注射液对于CAN的预防。《中国经皮冠状动脉介入治疗指南(2012)》[11]中指出:对于有CAN危险因素的受检者,应在CAG前12 h并持续至术后24 h以1 ml/(kg·h)的速度静脉给予等渗盐水进行水化治疗;若左心室射血分数<35%或纽约心脏病协会心功能分级>2级,水化速度则减为0.5 ml/(kg·h)(Ⅰ,A)。本文所涉及到的2例患者中,A患者按要求给予充分的水化治疗,B患者则未给予充分的水化治疗。
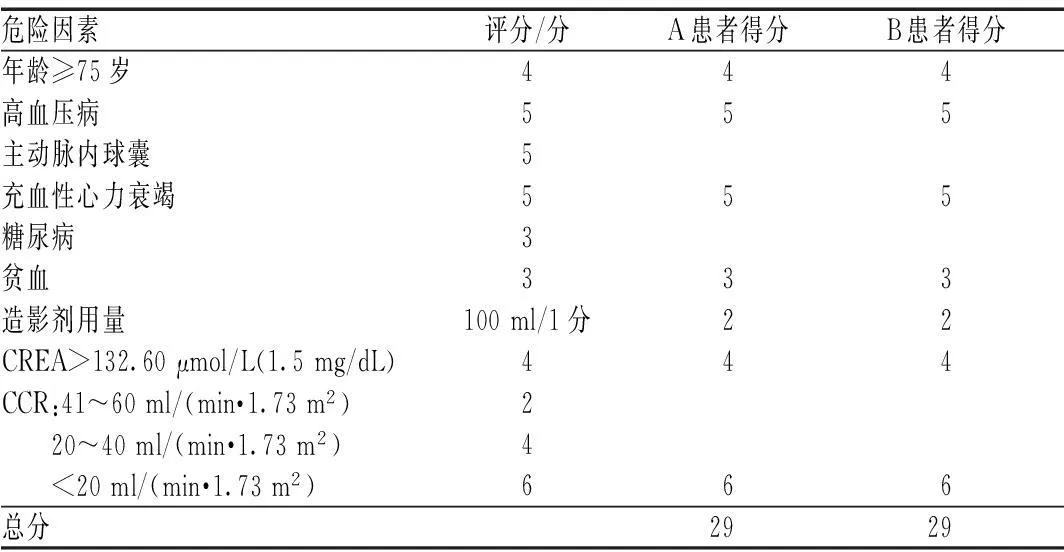
表1 2位患者的CAN危险因素评分
2.2.2造影剂种类及用量:用于血管造影的造影剂可分为离子型、低离子型和非离子型3大类,根据其渗透压高低又可分为高渗性、等渗性、低渗性造影剂。理论上,非离子型、低渗性及等渗性造影剂可提供更高质量的影像和更低的肾毒性。部分研究结果显示,等渗性造影剂优于低渗性造影剂[12],临床可根据患者的情况合理选择。造影剂的用量应在兼顾临床诊断、治疗需要的基础上尽可能少。《中国经皮冠状动脉介入治疗指南(2012)》[11]中推荐:合并轻、中度或严重慢性肾病的患者,推荐应用等渗性或低渗性造影剂,总量<350 ml或4 ml/kg(Ⅰ,A)。本文所介绍的A、B 2位患者,行CAG术时都选用了等渗性非离子型造影剂:碘克沙醇。碘克沙醇是一种非离子型、双体、六碘、水溶性的X线等渗造影剂,渗透压为290 mosm/(kg·H2O),和正常体液等渗,pH为6.8~7.6。碘克沙醇在继美国心脏病学会(ACC)/美国心脏协会(AHA)PCI指南中作为(I,A)类推荐造影剂应用于慢性肾病患者CAG或行PCI术治疗后,又被作为(I,A类)推荐给高风险慢性肾病患者行CAG或行PCI术治疗。碘克沙醇是至今唯一得到这一最高级别推荐的造影剂[13]。
2.2.3预防性药物治疗:目前尚无循证医学证明某种药物对CAN有确切的预防作用,但有研究结果证实某些药物已经显示出在降低CAN发生率中的作用[14]。(1)N-乙酰半胱氨酸:由于氧化应激参与了CAN的发生,很多研究者对氧化抑制剂N-乙酰半胱氨酸在预防CAN中的作用进行了评估。Briguori C等[14]研究结果发现,在发生CAN的高危人群中,相对于单独水化,N-乙酰半胱氨酸加水化可减少CAN的发生,且2倍剂量的N-乙酰半胱氨酸相对于单倍剂量更加有效。(2)他汀类药:该类药可通过其抗氧化、抗炎、抗血栓、保护内皮细胞、诱导血管紧张素受体下调、减少内皮素合成等独立于降脂之外的作用,而对患者肾功能起到一定的保护作用,从而具有预防CAN的作用。其他药物如多巴胺、钙离子通道阻滞剂、前列腺素、茶碱[15]等,也可能对预防CAN有效,但尚缺乏大规模的研究证实。本文所报道的2例患者,均未给予预防性药物治疗。
2.2.4血液透析:目前,关于肾功能不全患者行CAG后立即给予预防性血液透析滤过能否预防CAN的发生还存在争论。血液透析可有效清除患者体内残留的造影剂及炎性介质,纠正电解质紊乱,减轻肾损伤,同时还能维持血流动力学的稳定,保证肾脏血液灌注,促进肾功能的恢复。Marenzi G等[16]研究结果证明,慢性肾功能不全患者使用造影剂后及时进行血液透析治疗,可清除造影剂,从而有效预防CAN。何朝生等[17]的研究结果显示,对已有慢性肾功能不全患者,在行CAG术后立即给予血液透析可显著降低CAN 的发病率,并明显改善其预后;但肾功能不全患者一旦发生CAN,需要维持性血液透析的几率将大大增加。因此,在严重肾功能不全患者行CAG时应充分做好预防CAN的工作,必要时行预防性血液透析治疗。本文所报道的2例患者中,A患者造影结束后立即给予预防性血液透析1次,B患者术后未能及时行血液透析治疗。
2.3A、B 2位患者的对比分析
经对A、B 2位患者发生CAN的风险评估,二者均属于CAN发生的高危人群。在行CAG时必须做好CAN的预防工作。2位患者行CAG术时都选用了等渗性非离子型造影剂碘克沙醇,且严格控制造影剂用量。不同的是,A患者是择期行CAG术,术前12 h至术后24 h给予持续水化治疗(共水化0.9%氯化钠注射液2 500 ml、静脉滴注,滴速约为1.25 ml/min),A患者术前、术后24 h尿量都约为3 200 ml;另外,A患者造影结束后立即给予预防性血液透析1次。而B患者因住院期间突发胸痛,持续不能缓解,心电图提示前壁、下壁ST段压低,急诊行CAG术。B患者术前未能给予水化治疗,且术后只给予0.9%氯化钠注射液500 ml、静脉滴注,水化治疗的量也偏小;同时,B患者术后未能及时行血液透析治疗,使造影剂不能尽快排出体外。结果显示,A患者CAG术后未发生CAN,且CREA水平较入院时有较大幅度的下降;B患者CAG术后发生了CAN,具体CREA变化见图1。B 患者术后同时发生了急性心力衰竭、高钾血症(血钾5.52 mmol/L),同时患者凝血象也出现了异常[凝血酶原时间(PT)160.80 s,INR为13.61,活化部分凝血酶时间(APTT)为135.60 s],分析原因都与肾功能恶化有关。肾功能的进一步损伤会导致患者尿量减少,导致体液潴留引发急性心力衰竭,同时患者肾排钾量减少,导致患者出现高钾血症。患者凝血象出现异常的原因,也可能是由于肾功能损伤导致抗凝药物在体内蓄积而引发了凝血象异常。B患者术后第2日紧急给予血液透析治疗,之后一直未能脱离血液透析治疗。由此可见,CAN的预防很重要,一旦发生CAN,将加重患者的病情,延长患者的住院时间,同时还会影响患者的生存率,目前对CAN还没有有效的治疗方法。
3结论
CAN是一种医源性肾损害,通过对患者进行危险分层、明确高危状况、选择合适的造影剂及控制其剂量、积极给予水化等预防性干预等措施,临床上可减少CAN的发生。本文通过对A、B 2位患者治疗的对比分析,告诫临床医师和临床药师应高度重视CAN。到目前为止,对已发生的CAN尚无有效的治疗方法,临床主要以预防为主。预防CAN的原则为:分层、水化、限量、等渗。对于重度肾功能不全患者,必要时应行预防性血液透析,对预防CAN可能有效。
参考文献
[1]董江川,李大主,林静,等.静脉水化联合前列地尔对冠状动脉介入术后对比剂肾病的预防作用[J].中国药房,2013,24(20):1870-1872.
[2]Charytan DM,Wallentin L,Lagerqvist B,et al.Early angiography in patients with chronic kidney disease:a collaborative systematic review[J].Clin J Am Soc Nephrol,2009,4(6):1032-1043.
[3]Gruberg L,Mehran R,Dangas G,et al.Acute renal failure requiring dialysis after percutaneous coronary interventions[J].Catheter Cardiovasc Interv,2001(52):409-416.
[4]徐红,陈丽萌,李学旺.肾功能不全患者发生造影剂肾病的危险因素和预后[J].中国医学科学院学报,2005,27(2):232-236.
[5]王柳,陆士娟.对比剂肾病的研究进展[J].中国医院药学杂志,2010,30(14):1223-1225.
[6]Rich MW,Crecelius CA.Incidence,risk factors,and clinical course of acute renal insufficiency after cardiac catheterization in patients 70 years of age or older.A prospective study[J].Arch Intern Med,1990,150(6):1237-1242.
[7]中华医学会放射学分会对比剂安全使用工作组.碘对比剂使用指南:2版[J].中华放射学杂志,2013,47(10):869-872.
[8]Merten GJ,Burgess WP,Gray LV,et al.Prevention of contrast induced nephropathy with sodium bicarbonate[J].JAMA,2004,291(19):2328-2334.
[9]Adolph E,Holdt-Lehmann B,Chatterjee T,et al.Renal insufficiency following radiocontrast exposure trial(REINFORCE):a randomized comparison of sodium bicarbonate versus sodium chloride hydration for the prevention of contrast induced nephropathy,coronary artery disease[J].Coron Artery Dis,2008,19(6):413-419.
[10]杨满,刘进,侯静,等.不同水化疗法预防造影剂肾病的Meta分析[J].海南医学,2013,24(3):446-451.
[11]中华医学会心血管病学会分会介入心脏病学组,中华心血管病杂志编辑委员会.中国经皮冠状动脉介入治疗指南:2012[J].中华危重症医学杂志,2012,5(3):169-180.
[12]李艳华,张丽莉,赵春雁.等渗及低渗造影剂对高危患者发生造影剂肾病的比较[J].中国组织工程研究与临床康复,2008,12(4):683-686.
[13]邓增潮,陈华栋,梁增杰.碘克沙醇在高危患者造影中的安全性[J].中国医院用药评价与分析,2013,13(4):368-370.
[14]Briguori C,Manganelli F,Scarpato P,et al.Acetylcysteine and contrast agent-associated nephrotoxicity[J].J Am Coll Cardiol,2002,40(2):298-303.
[15]伟忠民,屈宝泽.大剂量辛伐他汀预防造影剂所致早期肾功能损害的临床观察[J].中国药房,2011,22(48):4575-4578.
[16]Marenzi G,Larri G,Campodonico J,et al.Comparison of two hemofiltration protocols for prevention of contrast-induced nephropathy in high-risk patients[J].Am J Med,2006,119(2):155-162.
[17]何朝生,梁馨苓,史伟,等.血液透析滤过预防造影剂肾病的临床观察[J].中国血液净化,2004,3(1):21-23.
(收稿日期:2015-07-13)
中图分类号R969.3
文献标志码A
文章编号1672-2124(2016)02-0250-04
#通信作者:主管药师。研究方向:临床药学。E-mail:ahslyysb@163.com
*药师,硕士研究生。研究方向:临床药学。E-mail:308890266@qq.com

