我国西部汉族人IL-10基因多态性与肺结核易感性的相关性研究
谭国超 徐春娟 马纪龙
721006 宝鸡,解放军第三医院石坝河分院1
边 静1 温 煜1 来力伟1
张方琪2 成家军2
·论著·
我国西部汉族人IL-10基因多态性与肺结核易感性的相关性研究
谭国超1徐春娟1马纪龙1
721006 宝鸡,解放军第三医院石坝河分院1
边静1温煜1来力伟1
张方琪2成家军2
【摘要】目的探讨白介素-10(IL-10)基因单核苷酸多态性与肺结核易感性的相关性,为肺结核的早期预警提供新的候选分子标志物。方法检测147例肺结核患者(病例组)及206例健康个体(对照组)中IL-10基因-819(C>T)、-1 082(A>G)多态位点基因型,进行关联分析。结果样本均衡性检验显示病例组与对照组个体之间在性别(P=0.575)、年龄(P=0.840)分布无统计学差异;基因分型检出率为99.7%;哈德温伯格平衡检测显示对照组个体符合遗传学规律(P值分别为0.137与0.311);-819位点CC、CT、TT基因型分布在病例组与对照组间无统计学差异(P=0.901);-1 082多态位点AA、AG、GG基因型在病例组中的分布频率分别为48.6%、43.2%和8.2%,而在对照组中分别为60.5%、36.1%和3.4%,二者之间存在统计学差异(P=0.032),G为风险等位基因(OR=1.55, 95%CI 1.10~2.19)。结论IL-10基因-1 802(A>G)位点单核苷酸多态性与我国西部汉族人群肺结核易感性显著相关,可作为该地区肺结核早期预警筛查的候选分子标志物。
【关键词】肺结核;白介素-10;单核苷酸多态性
结核病(tuberculosis, TB)是一类由结核分枝杆菌引起的、多发的、在许多情况下能够致死的传染性疾病,大多发生在肺部。我国是肺结核的高发地区,每年发病人数占全球发病总人数的11%,居世界第二位,尤以西部地区和农村地区疫情最为严重。结核病的易感性与严重程度与多种因素相关[1-2]。有研究报道细胞因子基因如白介素-10(IL-10)多态性与肺结核易感性之间存在相关性,但这种关联存在地域和人种的差异。本研究采用病例对照方法,对我国西部汉族人群肺结核易感性与IL-10基因单核苷酸多态性的相关性进行了关联分析,旨在为该地区提供肺结核早期预警筛查的候选分子标志物。
资料与方法
一、研究对象
选取2013年2月至2015年2月宝鸡市解放军第三医院石坝河分院结核科收治的肺结核患者147例为病例组,206例同期来院体检的健康个体为对照组。病例组年龄分布为26~75岁,平均(55.4±12.4)岁,其中男性87例,女例60例。对照组年龄分布为23~72岁,平均(55.7±12.1)岁,其中男性128例,女性78例。考虑到环境与遗传因素对肺结核易感性的影响,所有研究对象均为宝鸡市及陕西省常住汉族人口(居住5年以上),标本采集严格遵守知情同意原则。
二、研究方法
采用病例对照方法分析IL-10基因-819(C>T)、-1 082(A>G)位点单核苷酸多态性与研究对象肺结核易感性的相关性。采用北京天根生物技术公司全血基因组DNA提取试剂盒对研究对象外周血样本进行基因组DNA提取,所得标本于-20 ℃保存备用。使用聚合酶链反应序列特异性引物(PCR-SSP)对IL-10基因-819(C>T)、-1 082(A>G)两位点进行基因分型。
三、统计学方法
采用χ2检验、t检验对病例组与对照组样本均衡性进行检验;采用哈德温伯格平衡检验分析对照组个体是否符合遗传学定律;比较病例组与对照组之间基因型、等位基因分布是否存在差异,P<0.05为差异有统计学意义。
结果
一、 样本均衡性检验
表1所示为病例组和对照组的一般情况。共纳入肺结核患者147例(病例组),健康个体206例(对照组)。病例组平均年龄55.4岁,对照组平均年龄55.7岁,两组无统计学差异(P=0.840);病例组中男性87例(59.2%)、女性60例(40.8%),对照组中男性128例(62.1%)、女性78例(37.9%),两组无统计学差异(P=0.575)。
二、基因分型
对提取的DNA样本进行基因分型,819(C>T)位点在病例组与对照组中分别检出147例与206例,1 802(A>G)位点分别检出146例与205例,总检出率达99.7%。哈德温伯格平衡检测两位点在对照组中的基因型分布,P值分别为0.137与0.311,显示对照样本符合遗传学规律, 见表2。
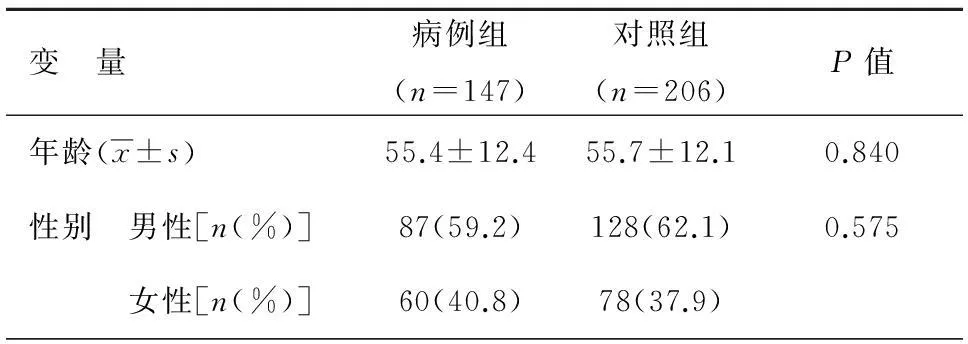
表1 病例组和对照组一般情况

表2 IL-10基因-819(C>T)、-1 082(A>G)两位点基因
三、候选位点多态性与肺结核易感性之间的相关性分析
比较病例组与对照组之间-819(C>T)、-1 082(A>G)两位点在基因型、等位基因分布频率之间的差异。发现-819(C>T)的CC、CT、TT三种基因型在病例组中所占比例分别为34.0%、51.7%和14.3%,在对照组中所占比例分别为35%、52.4%和12.6%,在两组间无显著差异(表3,P=0.901)。-1 082(A>G)AA、AG、GG三种基因型在病例组中所占比例分别为48.6%、43.2%和8.2%,而在对照组中分别为60.5%、36.1%和3.4%,两组在基因型与等位基因分布均有显著差异(表3,P值分别为0.032和0.012),其中G为风险等位基因(OR=1.55, 95%CI1.10~2.19)。
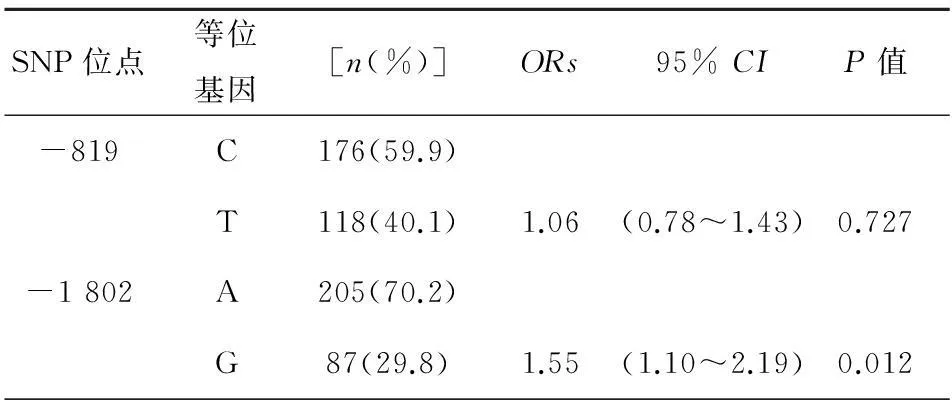
表3 IL-10基因-819(C>T)、 -1 082(A>G)两位点等
讨论
本研究旨在探索以IL-10为代表的细胞因子单核苷酸多态性与我国西部汉族人群肺结核易感性的相关性,通过采用病例对照研究方法,入组了147例肺结核患者(病例组)和206例健康个体(对照组),对其外周血样本进行核酸提取、基因分型与关联分析。结果显示,IL-10基因-1 082(A>G)位点单核苷酸多态性与我国西部汉族人群肺结核易感性显著相关,为该地区肺结核的预警与早期诊断提供了新的候选分子标志物。
肺结核是一类由结核分枝杆菌引起的多发性的慢性呼吸系统疾病,是全世界致死率最高的传染性疾病之一。2010年我国新增肺结核病例数约100万,占全球发病总人数的11%,居世界第二位。已知肺结核易感性与多种因素相关。其中最受关注的是HIV病毒,约13%的肺结核患者是HIV感染者。肺结核还是贫困相关的主要疾病之一,受地区经济状况影响明显,人群的拥挤程度和营养状况与肺结核发病率显著相关[3]。慢性肺部疾病也是肺结核感染的另一高危因素,矽肺能够使肺结核发病风险提高近30倍[4]。而吸烟者患肺结核的风险是非吸烟者的近2倍。2012年进行的一项meta分析则表明,在同一人群中年轻人比老年人更易患肺结核[5]。
而随着研究的不断深入,人们发现在结核分枝杆菌感染者中只有约10%的人群会发展为活动性肺结核[6]。因此,环境——病原微生物——宿主遗传易感性之间相互作用引发肺结核的模式越来越被人们所认可。近年来,多项研究表明个体遗传因素与肺结核易感性之间存在着显著关联,包括领养研究、双胞胎研究、全基因组连锁研究、病例—对照关联研究等。由于目前仍没有关于肺结核病开展的全基因组关联研究数据可供解读,所以候选基因策略由于其低成本、尤其在探索低等位基因频率易感基因的作用中仍然具有很好的应用前景。我国西部地区是肺结核高发区,针对我国西部地区开展肺结核易感性与候选基因多态性的关联研究,以鉴定出特异、高效的分子标志物是目前亟待解决的问题。
大量关联研究结果显示,结核患者的病理状态与某些促炎、细胞因子的上调或下调相关联[7],而位于细胞因子基因启动子和编码区的单核苷酸多态性位点能够通过改变所在基因的转录活性而影响分泌[8]。在发病部位中由于T淋巴细胞与被感染的巨噬细胞的相互作用而产生的细胞因子对于肺结核的发病机制起到了重要作用[9]。结核分枝杆菌感染宿主细胞的过程受到2种T细胞辅助因子的调节。其中,T细胞辅助因子1(IL-2和IFN-γ)与抗感染相关,而T细胞辅助因子2(IL-4和IL-13)被认为与疾病的发展相关[10]。
IL-10是一种具有多重功能的细胞因子,最初发现能够抑制小鼠Th1细胞IFN-γ的0合成,而被认为具有抑制细胞因子合成的作用[11]。IL-10能够在炎症发生过程中通过下调促炎细胞因子IL-12和TNF-α的表达,从而起到抑制单核/巨噬细胞的作用,并能抑制主要组织相容性复合体Ⅱ在细胞表面的表达[12]。IL-10还可以抑制CD4+的T细胞对IL-8的趋化作用[11],并通过上调Bcl-2的表达抑制T细胞的凋亡[13]。近期研究表明,IL-10对T细胞的抑制作用能够通过阻断CD28分子的信号通路以及随后的磷脂酰肌醇3-激酶的活化来完成[14]。作为T细胞调节因子之一,IL-10被认为可能在慢性/潜伏期肺结核的发展过程中发挥重要作用。研究表明,在小鼠体内,上调其表达能够促进慢性肺结核的激活并抑制细胞免疫对胞内感染的抵抗[15]。
据文献报道,IL-10基因单核苷酸多态性-1 082(A>G)位点与非洲西部的冈比亚[16]、马拉维[17]人群肺结核易感性之间并无显著关联。另一方面,有研究发现IL-10-1 082(A>G)位点A基因型与意大利西西里岛人肺结核易感性显著相关[18];在柬埔寨人群中进行的另一项关联研究发现其GA杂合型携带者患肺结核风险较野生纯合型个体显著升高[19];而IL-10-592(C>A)位点的C基因型与韩国人群肺结核患病风险降低相关[20]。此外,基于单体型的分析显示,IL-10基因1 082(A>G)、819(C>T)、592(C>A)三位点能够形成GCC、ACC、ATA三种主要单体型,在与加纳人群结核菌素皮肤试验反应的相关性研究中关联显著,但与肺结核易感性的关联并无统计学意义[21];在我国香港进行的一项研究则表明单体型-GCC与肺结核患者复发呈轻度相关[22]。
然而,细胞因子基因多态位点的等位基因频率随着地域、人种的不同呈现出显著的差异,这在一定程度上决定了其与肺结核易感性相关性的不同。本研究结果表明,IL-10基因-819(C>T)CC、CT、TT三种基因型在病例组中所占比例分别为34.0%、51.7%和14.3%,在对照组中所占比例分别为35%、52.4%和12.6%,在两组间无显著差异(P=0.901)。-1 082(A>G)AA、AG、GG三种基因型在病例组中所占比例分别为48.6%、43.2%和8.2%,而在对照组中分别为60.5%、36.1%和3.4%,病例组中的突变率显著高于对照组,基因型分布频率显示两组之间存在显著差异(P=0.032)。按等位基因比较发现,A到G的突变能够使个体肺结核的发病风险上调55%(P=0.012,OR=1.55,95%CI1.10~2.19)。
综上,本研究发现IL-10基因-1 082(A>G)位点单核苷酸多态性与我国西部汉族人群患肺结核的风险升高显著相关,表明其多态性有望作为该地区肺结核早期预警和诊断的候选分子标志物,为建立和完善我国西部地区肺结核易感因素的资料具有很重要的理论和临床意义。
参考文献
1高振秋, 王东方, 任成山. 耐多药结核病临床研究的回顾与展望[J/CD]. 中华肺部疾病杂志: 电子版, 2010, 3(5): 353-363.
2王细文, 胡明冬. 耐多药结核病—预防和控制的关键步骤[J/CD]. 中华肺部疾病杂志: 电子版, 2010, 3(6): 443-450.
3Floe A, Hilberg O, Wejse C, et al. The economic burden of Tuberculosis in Denmark 1998-2010. Cost analysis in patients and their spouses[J]. Int J Infect Dis, 2015, 32: 183-190.
4Byrne AL, Marais BJ, Mitnick CD, et al. Tuberculosis and chronic respiratory disease: a systematic review[J]. Int J Infect Dis, 2015, 32: 138-146.
5Mahasirimongkol S, Yanai H, Mushiroda T, et al. Genome-wide association studies of tuberculosis in Asians identify distinct at-risk locus for young tuberculosis[J]. J Hum Genet, 2012, 57(6): 363-367.
6Moller M, Hoal EG. Current findings, challenges and novel approaches in human genetic susceptibility to tuberculosis[J]. Tuberculosis (Edinb), 2010, 90(2): 71-83.
7Ferraz JC, Melo FB, Albuquerque MF, et al. Immune factors and immunoregulation in tuberculosis[J]. Braz J Med Biol Res, 2006, 39(11): 1387-1397.
8Ansari A, Talat N, Jamil B, et al. Cytokine gene polymorphisms across tuberculosis clinical spectrum in Pakistani patients[J]. PLoS One, 2009, 4(3): e4778.
9Sher A, Coffman RL. Regulation of immunity to parasites by T cells and T cell-derived cytokines[J]. Annu Rev Immunol, 1992, 10: 385-409.
10Wallis RS, Ellner JJ. Cytokines and tuberculosis[J]. J Leukoc Biol,
1994, 55(5): 676-681.
11Gesser B, Leffers H, Jinquan T, et al. Identification of functional domains on human interleukin 10[J]. Proc Natl Acad Sci U S A 1997, 94(26): 14620-14625.
12de Waal Malefyt R, Abrams J, Bennett B, et al. Interleukin 10(IL-10) inhibits cytokine synthesis by human monocytes: an autoregulatory role of IL-10 produced by monocytes[J]. J Exp Med, 1991, 174(5): 1209-1220.
13Cohen SB, Crawley JB, Kahan MC, et al. Interleukin-10 rescues T cells from apoptotic cell death: association with an upregulation of Bcl-2[J]. Immunology, 1997, 92(1): 1-5.
14Akdis CA, Joss A, Akdis M, et al. A molecular basis for T cell suppression by IL-10: CD28-associated IL-10 receptor inhibits CD28 tyrosine phosphorylation and phosphatidylinositol 3-kinase binding[J]. Faseb J, 2000, 14(12): 1666-1668.
15Turner J, Gonzalez-Juarrero M, Ellis DL, et al. In vivo IL-10 production reactivates chronic pulmonary tuberculosis in C57BL/6 mice[J]. J Immunol, 2002, 169(11): 6343-6351.
16Bellamy R. Susceptibility to mycobacterial infections: the importance of host genetics[J]. Genes Immun, 2003, 4(1): 4-11.
17Fitness J, Floyd S, Warndorff DK, et al. Large-scale candidate gene study of tuberculosis susceptibility in the Karonga district of northern Malawi[J]. Am J Trop Med Hyg, 2004, 71(3): 341-349.
18Scola L, Crivello A, Marino V, et al. IL-10 and TNF-alpha polymorphisms in a sample of Sicilian patients affected by tuberculosis: implication for ageing and life span expectancy[J]. Mech Ageing Dev, 2003, 124(4): 569-572.
19Delgado JC, Baena A, Thim S, et al. Ethnic-specific genetic associations with pulmonary tuberculosis[J]. J Infect Dis, 2002, 186(10): 1463-1468.
20Shin HD, Park BL, Kim YH, et al. Common interleukin 10 polymorphism associated with decreased risk of tuberculosis[J]. Exp Mol Med, 2005, 37(2): 128-132.
21Thye T, Browne EN, Chinbuah MA, et al. IL10 haplotype associated with tuberculin skin test response but not with pulmonary TB[J]. PLoS One, 2009, 4(5): e5420.
22Tso HW, Ip WK, Chong WP, et al. Association of interferon gamma and interleukin 10 genes with tuberculosis in Hong Kong Chinese[J]. Genes Immun, 2005, 6(4): 358-363.
(本文编辑:王亚南)
谭国超,徐春娟,马纪龙,等. 我国西部汉族人IL-10基因多态性与肺结核易感性的相关性研究[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 9(1): 56-59.
Association Analysis of IL-10 Gene Polymorphisms with Tuberculosis SusceptibilityTanGuochao1,XuChunjuan1,MaJilong1,BianJing1,WenYu1,LaiLiwei1,ZhangFangqi2,ChengJiajun2(1TheThirdHospitalofPLAShibaheBranch,Baoji721006,China,2DepartmentofRespiratoryandCriticalCareMedicine,XijingHospitaloftheFourthMilitaryMedicalUniversity,Xi′an710032,China)
【Abstract】ObjectiveTo explore the association of tuberculosis susceptibility with IL-10 gene polymorphisms and to provide reference for early warning of tuberculosis. Methods147 tuberculosis patients and 209 healthy individuals were enrolled. χ2 test, T test and HWE test were conducted to examine the study populations, then the association between gene polymorphisms and tuberculosis susceptibility was analyzed. ResultsSample balance test showed all of the cases in two groups were no statistical difference in sex(P=0.575) and age(P=0.840). Genotyping detection rate was 99.7%. Hardy Weinberg equilibrium detection showed the individual in control was conformed to the laws of genetics(P=0.137, 0.311). The genotype frequencies of IL-10_2 849 polymorphism between case and control were not statistically significant (P=0.901). While the difference of IL-10_1 082 polymorphism between case and control was identified (P=0.032). G is a risk alleles (OR=1.55, 95%CI 1.10-2.19). Conclusions-1 082 polymorphism of IL-10 gene is associated with tuberculosis susceptibility of northwest Han Chinese, which may be helpful for the early warning of tuberculosis.
【Key words】Tuberculosis;Interleukin-10;Single Nucleotide Polymorphism
(收稿日期:2015-04-08)
Corresponding author:Tan Guochao, Email: tgcbj147@163.com
中图法分类号:R562
文献标识码:A
通讯作者:谭国超,Email: tgcbj147@163.com
DOI:10.3877/cma.j.issn.1674-6902.2016.01.013
710032 西安,第四军医大学西京医院呼吸与危重症医学科2

