红细胞生成素对肠缺血再灌注损伤的保护作用及其机制研究*
红细胞生成素对肠缺血再灌注损伤的保护作用及其机制研究*
刘启胜程正位熊建光程思李湘楚#
湖北省咸宁市中心医院消化内科(437000)
背景:炎症反应是肠缺血再灌注损伤(IRI)的重要发病机制之一,而红细胞生成素(EPO)具有抗炎活性。目的:探讨EPO对肠IRI的保护作用及其可能机制。方法:32只健康雄性Sprague-Dawley大鼠随机分为假手术组(sham组)、IRI组、EPO组和740Y-P组。IRI组、EPO组和740Y-P组以夹闭(45 min)-开放肠系膜上动脉建立肠IRI模型,术前1 h分别腹腔注射0.9% NaCl溶液、EPO和EPO+740Y-P。再灌注1 h后处死大鼠,观察小肠组织病理学改变,以蛋白质印迹法检测PI3K/Akt、NF-κB信号通路相关蛋白表达,以real-time PCR和ELISA法检测炎症因子白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)表达和分泌。结果:与sham组相比,IRI组小肠组织损伤评分、PI3K、p-Akt、p-NF-κB p65蛋白表达、IL-8、TNF-α、MCP-1 mRNA表达和血清水平显著升高(P<0.05)。EPO预处理能明显改善IRI模型大鼠的小肠组织病理学改变,抑制PI3K/Akt、NF-κB信号通路激活,下调炎症因子表达、分泌,PI3K激动剂740Y-P则能减弱EPO的上述作用。结论:EPO预处理可通过抑制PI3K/Akt/NF-κB信号通路激活而抑制炎症反应,从而对肠IRI发挥保护作用。
关键词肠;再灌注损伤;炎症;红细胞生成素;PI3K/Akt;NF-κB
Protective Effect and Potential Mechanism of Erythropoietin on Intestinal Ischemia-reperfusion Injury
LIUQisheng,CHENGZhengwei,XIONGJianguang,CHENGSi,LIXiangchu.
DepartmentofGastroenterology,XianningCentralHospital,Xianning,HubeiProvince(437000)
Correspondence to: LI Xiangchu, Email: 23843212@qq.com
Background: Inflammation plays an important role in intestinal ischemia-reperfusion injury (IRI), and erythropoietin (EPO) has been reported to have anti-inflammatory activity. Aims: To explore the protective effect of EPO on intestinal IRI and its potential mechanism. Methods: Thirty-two healthy male Sprague-Dawley rats were randomly divided into four groups: sham operation group (sham group), IRI group, EPO group and 740Y-P group. Rats in IRI, EPO and 740Y-P groups were injected intraperitoneally with 0.9% NaCl, EPO and EPO+740Y-P, respectively, one hour before the establishment of intestinal IRI model by superior mesenteric artery clamping (45 min)-reperfusion. All rats were sacrificed one hour after reperfusion. Histopathological changes of small intestine were observed; expression of proteins in PI3K/Akt and NF-κB signaling pathways was measured by Western blotting; expression and secretion of inflammatory cytokines, including interleukin-8 (IL-8), tumor necrosis factor-α (TNF-α) and monocyte chemoattractant protein-1 (MCP-1) were examined by real-time PCR and ELISA. Results: Compared with sham group, the damage score of small intestine, protein expressions of PI3K, p-Akt and p-NF-κB p65, as well as mRNA expressions and serum levels of IL-8, TNF-α and MCP-1 in IRI group were significantly increased (P<0.05). EPO pretreatment could ameliorate the histopathological changes of small intestine in IRI model rats, inhibit PI3K/Akt and NF-κB signaling activation and down-regulate expression and secretion of inflammatory cytokines. When 740Y-P, a PI3K agonist, was used combinedly, the effect exerted by EPO was diminished. Conclusions: EPO pretreatment can protect against intestinal IRI by inhibiting the activation of PI3K/Akt/NF-κB signaling and the subsequent inflammatory response.
Key wordsIntestines;Reperfusion Injury;Inflammation;Erythropoietin;PI3K/Akt;NF-kappa B
肠缺血再灌注损伤(ischemia-reperfusion injury, IRI)好发于心肺体外大循环手术、严重创伤、肠移植等临床危重症患者[1],可导致肠道功能严重受损,肠屏障功能急剧降低,肠内大量细菌和毒素易位进入体循环,激活单核-巨噬细胞系统,引起大量促炎细胞因子释放,诱发全身性炎症反应综合征(SIRS)甚至多器官功能衰竭[1-2]。因此,减少促炎细胞因子释放、抑制炎症反应是减轻肠IRI的有效途径。红细胞生成素(erythropoietin, EPO)是一种由肾脏产生的具有多种生物学效应的糖蛋白[3],既往研究发现其可通过抑制氧化应激和细胞凋亡等途径对肠IRI发挥保护作用[4],但EPO是否能通过其抗炎活性减轻肠IRI,目前尚不十分清楚。本研究建立大鼠肠IRI模型并予EPO预处理或EPO预处理联合PI3K激动剂740Y-P干预,通过组织病理学检查以及PI3K/Akt、NF-κB信号通路相关蛋白表达的检测,进一步探讨EPO对肠IRI的保护作用及其可能机制。
材料与方法
一、实验动物分组和处理
健康雄性Sprague-Dawley大鼠32只,体质量200~250 g,SPF级,购自北京华阜康生物科技股份有限公司,质量合格证号:610037867,饲养于咸宁医学院实验动物中心。大鼠适应性喂养1周后,随机分为假手术组(sham operation组,简称sham组)、IRI组、EPO组和740Y-P组,每组8只。EPO组术前1 h腹腔注射EPO(纯度99%,Sigma-Aldrich Co.) 5 000 U/kg[4];740Y-P组术前1 h腹腔注射EPO 5 000 U/kg+740Y-P(纯度99%,Sigma-Aldrich Co.) 3.5 mg/kg[5];Sham组和IRI组术前腹腔注射等体积0.9% NaCl溶液。IRI组、EPO组和740Y-P组接受肠IRI造模处理:戊巴比妥钠麻醉,开腹腔,游离组织,分离暴露肠系膜上动脉,以血管夹夹闭,纱布覆盖切口,置于32 ℃温箱45 min,松开血管夹,恢复肠道血流灌注,缝合腹部,术毕回动物房,正常饮食、饮水。Sham组仅开腹,不夹闭肠系膜上动脉。造模过程顺利,各组均无动物死亡。再灌注1 h后眼内眦静脉取血,处死大鼠,收集肠道标本,用于后续实验。
二、方法
1. 小肠组织病理学检查:小肠组织标本4%甲醛溶液固定,石蜡包埋、切片,HE染色,光学显微镜下观察组织病理学改变。组织学损伤程度的评估采用Chiu肠黏膜损伤评分标准[6]:0分,正常绒毛和腺体;1分,部分绒毛顶端上皮轻度受损;2分,上皮下腺体轻度受损;3分,上皮下间隙扩大,毛细血管充血;4分,上皮与固有层中度分离,腺体受损;5分,部分绒毛顶端脱落;6分,绒毛顶端脱落明显,毛细血管扩张;7分,绒毛固有层部分脱落,腺体受损明显;8分,固有层开始消化分解;9分,出血和溃疡。
2. 蛋白质印迹法:免抗大鼠PI3K、Akt、p-Akt、NF-κB p65、p-NF-κB p65抗体购自Cell Signaling Technology, Inc.。取小肠组织称重,每50 mg组织加入1 mL RIPA裂解液,冰上匀浆,裂解30 min,4 ℃ 12 000×g离心30 min,取上清,BCA法测定蛋白浓度。50 μg蛋白质上样,SDS-PAGE电泳(5%浓缩胶,10%分离胶,恒压80~100 V),转膜(PVDF膜,恒流300 mA),洗膜,5%脱脂奶粉(TBST配制)封闭1 h,分别加入PI3K(1∶500)、Akt(1∶1 000)、p-Akt(1∶500)、NF-κB p65(1∶1 000)、p-NF-κB p65(1∶500)和β-actin(1∶3 000)抗体孵育过夜,振洗后加入二抗羊抗兔IgG-HRP 37 ℃孵育1 h,洗膜后加入ECL试剂,曝光、显影、定影、拍照。以Quantity One软件分析目的蛋白相对表达量,以目的蛋白条带与内参β-actin条带积分光密度值的比值表示。
3. Real-time PCR:称取适量小肠组织,于液氮中研磨成粉末状,由上海拜力生物科技有限公司完成总RNA提取,紫外分光光度法测定总RNA样品浓度和纯度。逆转录试剂盒和real-time PCR试剂盒购自Roche Diagnostics,按相应试剂盒说明书进行操作,行逆转录和real-time PCR,白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)引物信息见表1。以β-actin为内参基因,采用2-ΔΔCt法计算目的基因mRNA相对表达量。
4. ELISA:大鼠IL-8、TNF-α、MCP-1 ELISA试剂盒购自上海拜力生物科技有限公司,按相应试剂盒说明书进行操作,检测血清IL-8、TNF-α、MCP-1水平(单位:pg/mL)。
三、统计学分析

表1 Real-time PCR引物信息
结果
一、小肠组织病理学改变
IRI组小肠绒毛大量脱落,肠黏膜大量炎性细胞浸润,大量毛细血管出血,坏死,溃疡形成,肠黏膜损伤评分较sham组显著升高(7.0±1.5对0.5±0.5,P<0.05);与IRI组相比,EPO组小肠绒毛脱落、炎性细胞浸润、毛细血管出血、坏死、溃疡形成均明显减轻,肠黏膜损伤评分显著降低(2.0±0.5对7.0±1.5,P<0.05);740Y-P组小肠损伤程度与IRI组类似,肠黏膜损伤评分显著高于EPO组 (6.0±1.0对2.0±0.5,P<0.05)(图1)。上述发现提示EPO预处理可减轻肠IRI的组织病理学改变,而740Y-P可减弱EPO对肠IRI的保护作用。
二、EPO和740Y-P对PI3K/Akt、NF-κB信号通路的影响
蛋白质印迹法检测结果显示,IRI组小肠组织PI3K、 p-Akt、 p-NF-κB p65蛋白表达较sham组显著升高(P<0.05),EPO组上述蛋白表达均较IRI组显著降低(P<0.05),740Y-P组p-Akt、p-NF-κB p65蛋白表达较EPO组显著升高(P<0.05),四组间Akt、NF-κB p65蛋白表达差异无统计学意义(P>0.05)(图2~4)。上述发现提示IRI时PI3K/Akt、NF-κB信号通路激活,EPO预处理可抑制其激活,而740Y-P可减弱EPO的此种抑制作用。
三、EPO和740Y-P对炎症因子表达和分泌的影响
Real-time PCR检测结果显示,IRI组小肠组织IL-8、TNF-α、MCP-1 mRNA相对表达量较sham组显著升高(P<0.05),EPO组上述mRNA表达均较IRI组显著降低(P<0.05),740Y-P组则较EPO组显著升高(P<0.05),相对表达量与IRI组相近。对四组血清IL-8、TNF-α、MCP-1水平的检测结果与其小肠组织mRNA表达变化相一致(表2)。上述发现提示IRI时促炎细胞因子和趋化因子的表达、分泌显著上调,EPO预处理可下调这些炎症因子的表达、分泌,而740Y-P可减弱EPO的此种抑制作用。

图1 各组小肠组织病理学改变(HE染色,×400)

**与sham组比较,P<0.01;#与IRI组比较,P<0.05
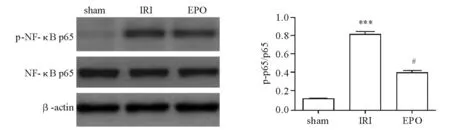
***与sham组比较,P<0.001;#与IRI组比较,P<0.05

###与IRI组比较,P<0.001;*与EPO组比较,P<0.05

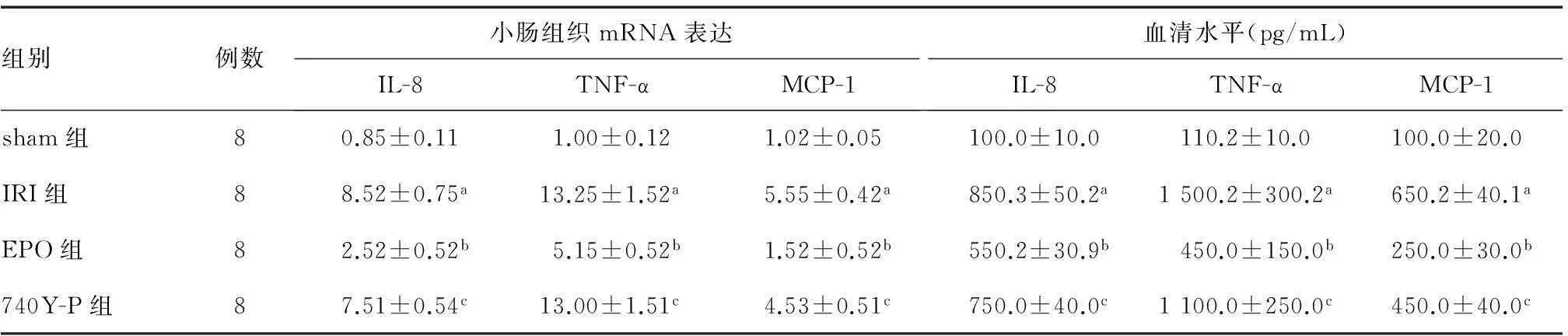
组别例数小肠组织mRNA表达IL-8TNF-αMCP-1血清水平(pg/mL)IL-8TNF-αMCP-1sham组80.85±0.111.00±0.121.02±0.05100.0±10.0110.2±10.0100.0±20.0IRI组88.52±0.75a13.25±1.52a5.55±0.42a850.3±50.2a1500.2±300.2a650.2±40.1aEPO组82.52±0.52b5.15±0.52b1.52±0.52b550.2±30.9b450.0±150.0b250.0±30.0b740Y-P组87.51±0.54c13.00±1.51c4.53±0.51c750.0±40.0c1100.0±250.0c450.0±40.0c
a与sham组比较,P<0.05;b与IRI组比较,P<0.05;c与EPO组比较,P<0.05
讨论
肠IRI是肠道供血中断后重新恢复血流灌注所致的临床危象,可于严重创伤、移植、心脏旁路手术、休克等情况下发生[1],发病率高、预后差,如何减轻肠IRI是亟待解决的重要临床问题。肠道缺血可导致机体细胞缺氧、ATP合成减少、炎症反应激活,血流灌注恢复后,炎症反应进一步加重,导致大量肠上皮细胞凋亡、坏死,使肠道损伤加剧[1-2]。EPO是调控血红蛋白合成的糖蛋白类激素,具有抗炎、抗凋亡、抗肿瘤等广泛的生物学活性[3]。鉴于炎症反应是IRI的重要发病机制之一,本研究通过建立大鼠肠IRI模型,对EPO对肠IRI的保护作用进行了探讨。研究结果显示,EPO预处理可明显减轻IRI引起的小肠损伤和炎症反应,如小肠绒毛脱落、炎性细胞浸润、毛细血管出血、坏死、溃疡等,肠黏膜损伤评分较未予EPO预处理的IRI模型大鼠显著降低。
NF-κB是调节炎症反应的重要核转录因子,其活性取决于p65亚基的激活[7]。本研究结果显示,IRI和EPO预处理对NF-κB p65表达均无明显影响,但IRI可上调其激活形式p-NF-κB p65表达,EPO预处理则可抑制IRI引起的NF-κB激活,进而抑制其下游炎症因子基因转录、表达。本研究同时检测了各组大鼠的小肠组织IL-8、TNF-α、MCP-1 mRNA表达以及三者的血清水平,证实IRI模型大鼠上述促炎细胞因子和趋化因子的表达、分泌显著上调,而EPO预处理可下调这些炎症因子的表达、分泌。EPO抑制NF-κB p65亚基磷酸化的机制尚不清楚,有待进一步研究。
PI3K/Akt为一经典信号通路,其激活可导致NF-κB 抑制蛋白(IκB)激酶(IKK)激活和IκB降解,进而激活NF-κB,调节其下游炎症反应[8]。研究[9]发现一些药物可通过抑制PI3K/Akt信号通路激活而抑制炎症反应,进而对IRI发挥保护作用。本研究进一步对EPO是否通过抑制PI3K/Akt/NF-κB信号通路激活而减轻肠IRI进行了探讨。各组大鼠小肠组织PI3K/Akt信号通路相关蛋白表达检测结果显示,IRI可激活PI3K/Akt信号通路,表现为PI3K和p-Akt表达上调,而予EPO预处理的IRI模型大鼠两者表达均显著下调,在EPO预处理的同时予PI3K激动剂740Y-P干预则可减弱EPO的作用,740Y-P组PI3K/Akt、NF-κB信号通路激活,小肠组织IL-8、TNF-α、MCP-1 mRNA表达、三者血清水平以及小肠损伤程度均与IRI组类似,提示EPO系通过抑制PI3K/Akt信号通路,进而抑制NF-κB激活及其下游促炎细胞因子、趋化因子的表达、分泌而削弱炎症反应,从而减轻肠IRI。除通过抑制PI3K/Akt信号通路激活而抑制炎症反应外,EPO是否尚可通过其他途径参与减轻IRI,相关机制有待进一步研究。
综上所述,本实验结果提示EPO预处理可通过抑制PI3K/Akt/NF-κB信号通路激活而抑制炎症反应,从而对肠IRI发挥保护作用,这一发现为临床上缺血性肠病的治疗提供了新的途径。后续拟进一步探索EPO用于缺血性肠病临床治疗的剂量和给药方式。
参考文献
1 Vollmar B, Menger MD. Intestinal ischemia/reperfusion: microcirculatory pathology and functional consequences[J]. Langenbecks Arch Surg, 2011, 396 (1): 13-29.
2 Arumugam TV, Okun E, Tang SC, et al. Toll-like receptors in ischemia-reperfusion injury[J]. Shock, 2009, 32 (1): 4-16.
3 Bartnicki P, Kowalczyk M, Rysz J. The influence of the pleiotropic action of erythropoietin and its derivatives on nephroprotection[J]. Med Sci Monit, 2013, 19: 599-605.
4 Guneli E, Cavdar Z, Islekel H, et al. Erythropoietin protects the intestine against ischemia/ reperfusion injury in rats[J]. Mol Med, 2007, 13 (9-10): 509-517.
5 Aedo JE, Reyes AE, Avendao-Herrera R, et al. Bacterial lipopolysaccharide induces rainbow trout myotube atrophy via Akt/FoxO1/Atrogin-1 signaling pathway[J]. Acta Biochim Biophys Sin (Shanghai), 2015, 47 (11): 932-937.
6 Boybeyi Ö, Gunal YD, Atasoy P, et al. The effect of colchicine and low-dose methotrexate on intestinal ischemia/reperfusion injury in an experimental model[J]. J Pediatr Surg, 2014, 49 (10): 1471-1474.
7 McKenna S, Gossling M, Bugarini A, et al. Endotoxemia Induces IκBβ/NF-κB-Dependent Endothelin-1 Expression in Hepatic Macrophages[J]. J Immunol, 2015, 195 (8): 3866-3879.
8 Wang L, Xu Y, Yu Q, et al. H-RN, a novel antiangiogenic peptide derived from hepatocyte growth factor inhibits inflammationinvitroandinvivothrough PI3K/AKT/IKK/NF-κB signal pathway[J]. Biochem Pharmacol, 2014, 89 (2): 255-265.
9 Zhang J, Yao Y, Xiao F, et al. Administration of dexamethasone protects mice against ischemia/reperfusion induced renal injury by suppressing PI3K/AKT signaling[J]. Int J Clin Exp Pathol, 2013, 6 (11): 2366-2375.
(2015-05-23收稿;2015-07-21修回)
*基金项目:湖北省卫生计生委科研项目(WJ2015MB299);咸宁市科技局一般项目(201510)
DOI:10.3969/j.issn.1008-7125.2016.01.004
#本文通信作者, Email: 23843212@qq.com

