姜黄素对肠上皮细胞屏障损伤保护作用的研究
姜黄素对肠上皮细胞屏障损伤保护作用的研究
王改1*王娜2郝京霞3
保定市儿童医院PICU1(071000)河北医科大学第二医院消化内科2河北省儿童医院PICU3
背景:肠上皮紧密连接的破坏及其所致的肠黏膜屏障功能受损在肠道疾病的发病中起重要作用,姜黄素对受损的肠黏膜屏障具有保护作用。目的:探讨姜黄素对乙醇诱导的肠黏膜屏障损伤的保护作用。方法:培养Caco-2细胞以制备体外肠上皮细胞屏障模型,将其分为空白对照组、乙醇组和不同浓度姜黄素治疗组(5、20、80 μmol/L)。以单层上皮的跨上皮细胞电阻(TEER)和荧光素钠透过率评估肠上皮屏障功能;蛋白质印迹法和免疫荧光法分别检测Occludin蛋白表达和定位;透射电镜观察细胞结构。结果:与空白对照组相比,乙醇组TEER降低,荧光素钠透过率显著升高(P<0.05),Occludin蛋白表达显著降低(P<0.05);免疫荧光法示Occludin蛋白表达不连续,荧光强度减弱;透射电镜示刷状缘排列紊乱,细胞间连接模糊。经姜黄素治疗后,上述指标均显著改善,其中20 μmol/L姜黄素治疗组的疗效最为明显(P<0.05)。结论:姜黄素对乙醇诱导的肠上皮细胞屏障损伤具有保护作用。
关键词姜黄素;肠黏膜屏障;紧密连接;乙醇;治疗
Protective Effect of Curcumin on Intestinal Epithelial Cell Barrier DisruptionWANGGai1,WANGNa2,HAOJingxia3.1PICU,BaodingChildren’sHospital,Baoding,HebeiProvince(071000);2DepartmentofGastroenterology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang;3PICU,Children’sHospitalofHebeiProvince,Shijiazhuang
Background: Disruption of intestinal epithelial tight junction and the followed barrier function play important roles in the pathogenesis of intestinal disorders. Curcumin could provide protection for the impaired barrier function. Aims: To investigate the protective effect of curcumin on ethanol-induced intestinal mucosal barrier disruption. Methods: Caco-2 cells were cultured to establish intestinal epithelial cell barrier modelinvitro, and then were divided into control group, ethanol group and different concentrations of curcumin groups (5, 20, 80 μmol/L curcumin). Trans-epithelial electrical resistance (TEER) and flux of sodium fluorescein for Caco-2 cell monolayers were measured to examine intestinal epithelial barrier function. Expression and localization of Occludin protein were measured by Western blotting and immunofluorescence, respectively. Cell structure was observed by transmission electron microscopy (TEM). Results: Compared with control group, TEER was significantly decreased and flux of sodium fluorescein was significantly increased (P<0.05), expression of Occludin protein was significantly decreased (P<0.05) in ethanol group. Immunofluorescence showed that Occludin protein expression was discontinuous and fluorescence intensity was low. TEM showed that brusher border was disorganized, and cell-cell junction was vague. When pretreated with curcumin, the above-mentioned indices were significantly improved, especially in 20 μmol/L curcumin group (P<0.05). Conclusions: Curcumin protects ethanol-induced intestinal epithelial cell barrier disruption.
Key wordsCurcumin;Intestinal Mucosal Barrier;Tight Junctions;Ethanol;Therapy
肠上皮屏障由肠上皮细胞和细胞间紧密连接(tight junction, TJ)构成。Occludin蛋白是肠黏膜TJ蛋白成员之一,其通过胞膜外部分与相邻细胞结合而产生细胞旁封闭,对肠黏膜屏障功能的维持至关重要。各种病理情况均能造成肠黏膜屏障损伤,导致内毒素、细菌入血进而引发全身炎症反应综合征、严重脓毒症、败血症,最终导致多脏器功能衰竭[1]。儿童肠壁薄,通透性高,肠黏膜屏障功能差,故肠黏膜屏障在儿科疾病的发生、发展中意义重大。本研究通过给予乙醇诱导的肠上皮屏障损伤模型不同浓度的姜黄素治疗,旨在探讨姜黄素对肠黏膜屏障的保护作用。
材料与方法
一、主要材料
Caco-2细胞株购于中科院上海细胞所;乙醇、荧光素钠购自Sigma公司;兔抗Occludin多克隆抗体购自Invitrogen公司;HRP标记的山羊抗兔IgG购自北京赛驰生物科技有限公司;Occludin单克隆抗体、Cy3标记的山羊抗小鼠IgG(H+L)购自Santa Cruz公司;Millicell电阻仪购自Millipore公司;BX51荧光显微镜购自Olympus公司;6.5 mm Transwell购自Corning/Costar公司。
二、方法
1. 细胞培养:Caco-2细胞置于DMEM培养液中,37℃、5% CO2条件下培养。隔日换液,监测跨上皮细胞电阻(TEER)。细胞培养约21~30 d后TEER明显升高,说明体外肠上皮屏障模型形成。
2. 细胞分组:Caco-2细胞的肠上皮屏障模型形成后,分为:①空白对照组:不予特殊处理;②乙醇组:予终浓度为10%的乙醇共同孵育[2];③姜黄素治疗组:给予终浓度为10%的乙醇30 min前予不同浓度姜黄素(5、20、80 μmol/L),共同孵育6 h[3]。每项实验均选取至少3组非同代细胞进行。
3. TEER测定:37 ℃恒温条件下,将Millicell电阻仪的两电极分别插入小室顶侧和基底侧,干预0 h、0.5 h、1 h、3 h、6 h后测量单层电阻,每个Transwell取不同方向的三个点,重复测定3次。电阻值用Ω/cm2表示。因Transwell膜本身具有电阻,故标准TEER=(实测值-空白对照值)/0.33 cm2。
4. 荧光素钠透过率测定:Hank平衡盐溶液(HBSS)冲洗细胞,于Transwell小室顶端加入终浓度为67 mg/mL的荧光素钠,基底侧加入0.6 mL空白HBSS,37 ℃分别孵育1 h、6 h后收集基底侧液体,应用荧光分光光度计测定荧光强度(激发波长490 nm,发射波长520 nm),根据标准曲线计算荧光素钠浓度。荧光素钠透过率[%·(h·cm2)-1]=(基底侧荧光素钠荧光量/最初加入顶侧的荧光素钠荧光量)/(1 h×0.33 cm2)×100%[3]。
5. 蛋白质印迹法:提取细胞全蛋白并测定蛋白含量。取80 μg蛋白行SDS-PAGE电泳,转膜,与兔抗Occludin多克隆抗体(工作浓度1∶300)4 ℃孵育过夜,加入HRP标记的山羊抗兔IgG(1∶3 000)室温孵育2 h后发光显色,密度扫描分析,显影条带经凝胶成像分析仪采集后,用美国NIH ImageJ 1.38软件进行定量分析。
6. 免疫荧光法:细胞单层应用4%多聚甲醛固定20 min,加入浓度为1∶100的鼠抗Occludin单克隆抗体,4 ℃过夜,然后加入浓度为1∶50的Cy3标记的山羊抗小鼠lgG(H+L)抗体,室温孵育1 h,防淬灭封片剂封片,荧光显微镜下观察,照相。
7. 透射电镜:将生长在Transwell上的Caco-2细胞单层经4%戊二醛前固定2 h、1%四氧化锇后固定2 h,脱水,包埋,切片,乙酸双氧铀和枸橼酸铅双重染色,电镜下照相。
三、统计学分析
结果
一、肠上皮细胞屏障通透性
1. TEER:Caco-2细胞培养至28 d左右时,单层上皮TEER达(293.52±21.89) Ω·cm2。空白对照组不同干预时间点TEER变化不明显,乙醇组和姜黄素治疗组TEER随时间延长均呈下降趋势(P<0.05),但姜黄素治疗下降幅度低于乙醇组,且20 μmol/L 姜黄素治疗组TEER下降幅度低于5、80 μmol/L 姜黄素治疗组(表1)。
2. 荧光素钠透过率:Caco-2细胞培养至28 d左右时,空白对照组荧光素钠透过率约(6.46±1.81) %·(h·cm2)-1。干预细胞单层6 h后,乙醇组荧光素钠透过率显著高于空白对照组(P<0.001)。不同浓度姜黄素治疗组荧光素钠透过率显著低于乙醇组(P<0.05),20 μmol/L姜黄素治疗组又显著低于5、80 μmol/L姜黄素治疗组(P<0.05),而后两组无明显差异(表2)。

组 别0h0.5h1h3h6h空白对照组295.73±32.68293.63±23.10288.13±14.71289.06±16.77285.70±16.01乙醇组297.50±28.63181.73±20.45166.23±17.41130.40±26.6090.23±15.495μmol/L姜黄素治疗组288.76±22.08224.60±24.15188.46±10.52157.06±20.06118.40±19.1620μmol/L姜黄素治疗组293.76±17.62235.20±29.69205.03±17.10177.63±8.44140.30±14.6980μmol/L姜黄素治疗组291.83±24.51223.43±22.11196.96±15.30159.80±11.13120.26±10.45
二、Occludin表达和定位
乙醇组Occludin蛋白表达显著低于空白对照组(P<0.001),不同浓度姜黄素可改善乙醇诱导的Occludin低表达(P<0.05),且20 μmol/L 姜黄素治疗组又显著高于5、80 μmol/L 姜黄素治疗组(P<0.05),而后两组无明显差异(表2、图1)。
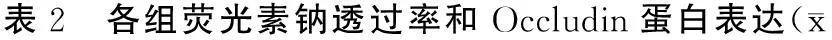
±s)
1 Da=0.992 1 u
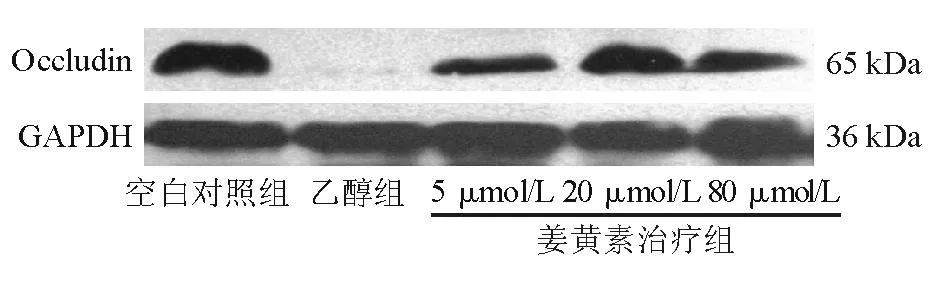
免疫荧光显示空白对照组Occludin蛋白沿细胞膜表达,发出绿色荧光,荧光连续完整,强度高,细胞呈铺路石状;乙醇组Occludin蛋白表达断续不完整,荧光强度弱;20 μmol/L姜黄素治疗组可明显改善荧光强度,但较空白对照组减弱(图2)。透射电镜显示空白对照组Caco-2细胞刷状缘完整,排列整齐,细胞间连接清晰,密度高。乙醇组细胞刷状缘排列紊乱,细胞间连接模糊,密度减低(图3)。
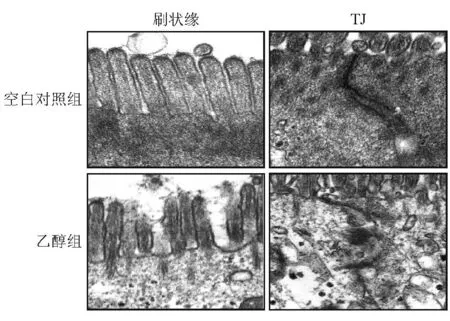
图3 空白对照组和乙醇组透射电镜图(×30 000)
肠黏膜屏障是机体重要的防御屏障,正常情况下可阻止肠道内细菌及其毒素穿过肠壁侵入机体,为人体与外界环境相互接触的首道防线,其中肠上皮细胞间完整的TJ由于封闭了细胞与细胞之间的间隙,对肠黏膜屏障功能的发挥起至关重要的作用[4-6]。各种病理状态如严重脓毒症、败血症、梗阻性黄疸、急性胰腺炎、急性坏死性小肠炎、轮状病毒肠炎等均可导致TJ破坏和肠黏膜屏障功能受损,使细菌、毒素等有害物质透过肠黏膜进入组织器官和血液循环,形成恶性循环[4]。
Caco-2细胞培养后可融合形成肠单层上皮细胞,与人小肠上皮细胞具有相似的形态,并具有相同的TJ和细胞极性,为公认的研究TJ的体外模型。TEER和荧光素钠透过率为反映细胞旁通透性的常用指标,而细胞旁转运主要受TJ的限制。Occludin蛋白是最早发现、研究最多的TJ功能蛋白。有研究报道Occludin的羧基可直接与肌动蛋白丝相连[5],且能与肌动蛋白骨架系统连接, 对维持屏障功能和TJ结构完整尤为重要[6]。因此本实验选取Occludin蛋白作为研究指标。
图2 各组紧密连接Occludin蛋白表达和分布结果(免疫荧光法,×400)
目前许多研究已证实乙醇可破坏肠上皮屏障功能,导致通透性增加[7],终体积浓度为1%的乙醇即能引起屏障功能受损[2]。有研究表明乙醇可通过RhoA/ROCK信号通路使TJ蛋白Occludin、ZO-1重新分布[8]。TJ破坏能直接导致肠黏膜通透性增加[9],加速疾病进程。本研究应用终浓度为10%的乙醇与Caco-2细胞单层孵育6 h,结果显示TEER明显降低,荧光素钠透过率升高。提示乙醇能造成Caco-2细胞单层屏障功能破坏,形成高通透性,与多项研究[9-10]结果相似。本研究结果显示乙醇导致Occludin蛋白表达减少和重新分布,影响TJ的完整性,推测肠黏膜屏障通透性增加可能与Occludin蛋白表达减少和重新分布有关。
姜黄素是从姜科植物姜黄、莪术中提取的有效成份,具有抗氧化、抗肿瘤、抗病毒、降血脂等多种作用[11-13]。有研究证实姜黄素对肠黏膜屏障功能具有保护作用,可诱导内源性抗氧化剂的产生[3],且对大鼠结肠炎具有一定的保护作用[14]。但关于姜黄素对肠上皮TJ保护作用的报道较少见。本研究结果显示不同浓度的姜黄素均可增加受损肠黏膜屏障的TEER,降低荧光素钠透过率,同时能改善Occludin蛋白低表达,维护TJ的完整性,提示姜黄素对肠黏膜屏障具有一定的保护作用,且20 μmol/L姜黄素治疗组的疗效最佳。Wang等[3]的研究表明姜黄素可改善H2O2诱导的肠黏膜屏障损害,虽干预因素不一样,但均能改善受损肠黏膜屏障功能。
综上所述,姜黄素能有效改善乙醇诱导的肠黏膜屏障功能破坏,其保护作用与TJ蛋白Occludin表达和分布有关,为临床用药提供理论依据。
参考文献
1 Anderson JM, Van Itallie CM. Tight junctions and the molecular basis for regulation of paracellular permeability[J]. Am J Physiol, 1995, 269 (4 Pt 1): G467-G475.
2 Ma TY, Nguyen D, Bui V, et al. Ethanol modulation of intestinal epithelial tight junction barrier[J]. Am J Physiol, 1999, 276 (4 Pt 1): G965-G974.
3 Wang N, Wang G, Hao J, et al. Curcumin ameliorates hydrogen peroxide-induced epithelial barrier disruption by upregulating heme oxygenase-1 expression in human intestinal epithelial cells[J]. Dig Dis Sci, 2012, 57 (7): 1792-1801.
4 闫勇, 尹致良, 田伏洲, 等. 肠黏膜屏障损害致肠源性内毒素血症[J]. 中华胃肠外科杂志, 1999, 2 (4): 246-247.
5 Wittchen ES, Haskins J, Stevenson BR. Protein interactions at the tight junction. Actin has multiple binding partners, and ZO-1 forms independent complexes with ZO-2 and ZO-3[J]. J Biol Chem, 1999, 274 (49): 35179-35185.
6 Saitou M, Fujimoto K, Doi Y, et al. Occludin-deficient embryonic stem cells can differentiate into polarized epithelial cells bearing tight junctions[J]. J Cell Biol, 1998, 141 (2): 397-408.
7 李艺锋, 周素芳, 徐思娅. 乙醇与肠屏障功能改变[J]. 中国中西医结合消化杂志, 2013, 21 (9): 493-495.
8 Tong J, Wang Y, Chang B, et al. Evidence for the involvement of RhoA signaling in the ethanol-induced increase in intestinal epithelial barrier permeability[J]. Int J Mol Sci, 2013, 14 (2): 3946-3960.
9 Mitzscherling K, Volynets V, Parlesak A. Phosphatidylcholine reverses ethanol-induced increase in transepithelial endotoxin permeability and abolishes transepithelial leukocyte activation[J]. Alcohol Clin Exp Res, 2009, 33 (3): 557-562.
10Elamin EE, Masclee AA, Dekker J, et al. Short-chain fatty acids activate AMP-activated protein kinase and ameliorate ethanol-induced intestinal barrier dysfunction in Caco-2 cell monolayers[J]. J Nutr, 2013, 143 (12): 1872-1881.
11Fu Y, Gao R, Cao Y, et al. Curcumin attenuates inflammatory responses by suppressing TLR4-mediated NF-κB signaling pathway in lipopolysaccharide-induced mastitis in mice[J]. Int Immunopharmacol, 2014, 20 (1): 54-58.
12Ilieva Y, Kaloyanov K, Yosifov D, et al. Antineoplastic potential of curcumin (cooperative study in Bulgaria and Germany)[J]. Phytochemistry Reviews, 2014, 13 (2): 459-469.
13厉红元, 车艺, 汤为学. 姜黄素对人肝癌细胞增殖和凋亡的影响[J]. 中华肝脏病杂志, 2002, 10 (6): 449-451.
14Zhang M, Deng CS, Zheng JJ, et al. Curcumin regulated shift from Th1 to Th2 in trinitrobenzene sulphonic acid-induced chronic colitis[J]. Acta Pharmacol Sin, 2006, 27 (8): 1071-1077.
(2015-07-16收稿;2015-09-06修回)
DOI:10.3969/j.issn.1008-7125.2016.01.006
*Email: woshiwanggai@163.com

