纳米火焰探针检测肿瘤耐药性相关mRNA
蔡俣林,周云,龚亮
(1.湖南省益阳市箴言中学,湖南益阳 413058)
(2.湖南工业大学生命科学与化学学院,湖南株洲 412000)
纳米火焰探针检测肿瘤耐药性相关mRNA
蔡俣林1,周云1,龚亮2*
(1.湖南省益阳市箴言中学,湖南益阳 413058)
(2.湖南工业大学生命科学与化学学院,湖南株洲 412000)
信使RNA(mRNA)是由DNA经由转录而来,带着相应的遗传讯息,为下一步转译成蛋白质提供所需的讯息。检测mRNA的表达,了解其功能在肿瘤研究中具有重要意义。纳米火焰探针,作为一种具有良好稳定性和特异性的金纳米粒子-DNA纳米复合物,能有效对肿瘤mRNA进行检测成像。该文构建的纳米火焰探针能很好地实现对耐药性基因的检测。
信使RNA;耐药性基因;纳米火焰探针
0 引言
信使RNA(mRNA)是由DNA经转录而来,与DNA序列互补的核糖核苷酸序列。细胞核的DNA将遗传信息传递给mRNA,经由mRNA传递到细胞质,再通过细胞质中的各种细胞器识别mRNA中的信息,同时合成蛋白质。
癌细胞耐药性的产生是导致肿瘤化疗失败的重要因素之一,耐药性基因MRP1过度表达与肿瘤细胞产生耐药性密切相关。检测MRP1 mRNA的表达量有助于临床预测及指导用药,进一步了解并探讨肿瘤细胞的耐药机制[1]。
纳米火焰探针是一种金纳米粒子-DNA的纳米复合物,文献报道此类探针可以有效实现肿瘤mRNA的检测成像[2-3],且具有良好的特异性和稳定性。因此,该实验设计用纳米火焰探针检测MRP1 mRNA,为检测耐药性相关mRNA提供一种简单、快速、准确的方法。
1 实验原理
1.1 胶体金溶液的合成
化学合成的金纳米粒子尺寸不一,直径从几个纳米到几百个纳米都可以合成。在典型的合成过程中,金的化合物首先被还原剂还原成金原子,并进一步聚集形成金纳米粒子,同时稳定剂会吸附或者化学结合到金纳米粒子表面。由于稳定剂通常是带电荷的,当修饰到纳米粒子表面之后,带电荷的纳米粒子会相互排斥,从而形成稳定的胶体。
1.2 胶体金修饰DNA
硫醇、硫醚或二硫醚衍生物中的S原子与Au表面的强烈相互作用遵循软硬酸碱作用原理,Au-S键极易自发形成并释放热量。通过在DNA末端修饰巯基,利用Au-S键,可以直接将DNA组装与金表面。
1.3 对mRNA的检测
通过将两条互补配对的DNA链组装在金纳米颗粒表面,一条为特异性识别mRNA的序列,另一条为互补的短链DNA并修饰荧光染料,在没有靶分子存在时,染料的荧光可以被金纳米粒子淬灭,当遇到DNA或RNA的靶分子时,识别序列与靶分子通过竞争杂交,短链DNA被释放,荧光恢复。因此可以用于检测mRNA(图1)。
2 实验准备
2.1 仪器
三颈烧瓶;油浴锅;岛津UV-2450型紫外分光光度计;FluoroMax-4荧光分光光度计。
2.2 试剂
柠檬酸三钠(>99.0%);四氯金酸(99.99%); 0.1 mol/L NaCl缓冲溶液(0.01 mol/L Tris-Acetate, pH=7.0);其中氯化钠为分子生物级纯度;所有溶液均采用三次蒸馏的去离子水配制。经HPLC纯化后的巯基修饰寡核苷酸:(DNA序列)(生工生物工程(上海)股份有限公司)
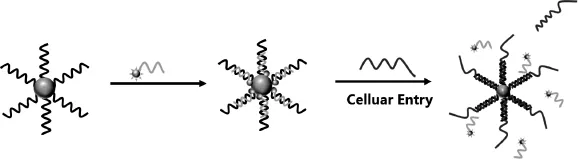
图1 纳米火焰探针检测肿瘤耐药性相关mRNAFig.1Schematic illustration of multidrug resistance associated mRNA detection using nano-flares
纳米金标记长链:5’-SH-AAAAA TGC TGT TCG TGC CCC CGC CG-FAM-3’
纳米金标记短链DNA:5’-GCA CGA ACA GCAT–Cy3-3’
MDR1 mRNA:5'-CGG CGG GGG CAC GAA CAG CA-3'
3 实验步骤
3.1 金纳米颗粒的合成
金溶胶由HAuCl4经柠檬酸三钠溶液还原而成[4-5]。具体步骤如下。将合成过程中所有玻璃器皿用王水浸泡3 h,再用超纯水涮洗3遍,放入70℃烘箱烘干备用。取2.2×10-2mol/L氯金酸与25 mL超纯水至三颈烧瓶中100℃油浴加热至沸腾,加入0.8 mL 2.5×10-2mol/L柠檬酸三钠溶液,反应30 min后自然冷却至室温,扫描紫外可见光谱表征后置于4℃冰箱保存。
3.2 金颗粒表面修饰DNA
将巯基修饰的环状寡核苷酸序列用100 mmol/L TCEP活化,使DNA末端巯基形成的分子间二硫键切断,然后与金纳米粒进行连接反应,二者加入的量为100∶1(摩尔比)。避光反应12 h后,将200 μL 2 mol/L NaCl分多次加入上述溶液内进行盐老化。最后通过13000 r/min,10 min离心作用收集沉淀,沉淀复溶后得到稳定的DNA修饰的金纳米颗粒溶液。用紫外分光光度计对其进行表征。
3.3 计算金纳米颗粒表面标记DNA的数量
因为纳米金具有荧光猝灭的效果,因此可以通过荧光的变化来计算金纳米颗粒表面标记的DNA的数量。为了计算金纳米颗粒上标记DNA的数量,首先将未与金纳米颗粒孵育的两条DNA链根据不同的浓度进行荧光测定,绘制出标准曲线。同时,收集DNA与金纳米颗粒反应离心后的上清液,测定其荧光强度,通过计算上清液的荧光值与未与金颗粒反应对应DNA的荧光值之间的差值,计算出每个纳米金表面修饰DNA的数量。
3.4 检测荧光恢复测定MRP1 mRNA浓度
当溶液中的MRP1 mRNA与纳米金上标记的长链杂交后,释放出一端标记荧光团的短链DNA,该游离短链DNA的荧光得以恢复。基于此理论基础,通过荧光分光光度计定量测定杂交后的荧光信号强度值。
实验在缓冲溶液DPBS中进行。首先将标记长链的纳米金与标记荧光团的短链DNA在75℃下杂交反应10 min,待温度缓慢降至室温后,离心除去未杂交的短链。随后加入不同浓度的MRP1 mRNA,室温下反应1 h后,测定溶液的荧光光谱。
4 结果与讨论
如图2所示,黑色的线为未标记DNA的金纳米颗粒,其在518 nm处有其紫外的特征吸收峰,并且根据吸收峰的峰值可以计算出金纳米颗粒的浓度。红色的线为标记DNA的金纳米颗粒,在522 nm处有其紫外的特征吸收峰,相对于未标记DNA的颗粒,有4 nm左右的红移,并且在260 nm处有个DNA的特征吸收峰,表明DNA已经成功修饰在金纳米颗粒表面。
根据测定不同浓度的DNA样品的荧光值(图3A),并将其浓度与荧光之间的关系进行线性拟合,得到了线性方程:y=56359+634405x(图3B),其中x代表浓度,y为荧光强度。通过测定上清液中DNA的荧光值可以得到上清液中DNA的浓度,根据加入的DNA浓度之间的差值以及金纳米颗粒的浓度,就可以计算出每个颗粒上标记的DNA的数量。在这个实验中,根据计算,每个金纳米颗粒上标记了约70条DNA。
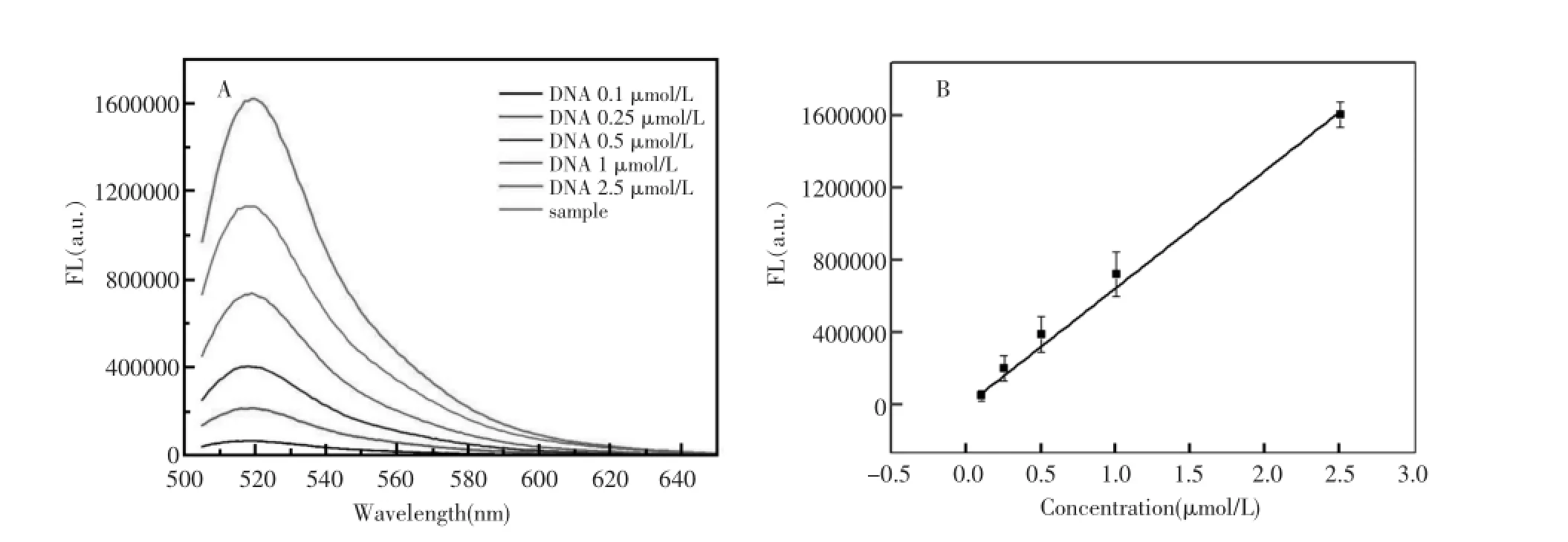
图3 (A)不同浓度的DNA以及上清液样品的荧光值测定;(B)DNA浓度与其对应荧光值的校正曲线Fig.3(A)Fluorescence spectra of different concentration DNA and supernatant(brown);(B)Calibration curve of fluorescence value and corresponding DNA concentration
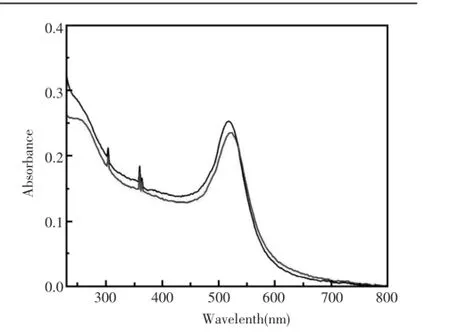
图2 金纳米颗粒与修饰了DNA的金纳米颗粒的紫外表征图Fig.2UV absorbance spectrum of gold nanoparticle and DNA modified gold nanoparticle
在缓冲溶液中对不同浓度的MRP1 mRNA进行了测定,如图4A为在加入不同浓度的MRP1 mRNA得到的荧光发射光谱。由图可以看出,随着加入的MRP1 mRNA浓度增加,荧光强度也随之升高。图4B为探针的校正曲线,其动力学响应范围为200 nmol/L~2 μmol/L,检测下限为70 nmol/L。
5 结论
该文成功将DNA修饰在金纳米颗粒上,成功构建了纳米火焰探针,并且利用荧光的方法实现了对癌细胞内耐药性基因MRP1 mRMA的检测。通过对各方面的分析,都表明在金纳米颗粒表面修饰上了足够多的DNA序列。而且修饰后的纳米火焰探针能够很好地实现对一定范围内的耐药性基因MRP1 mRNA的线性响应。因此该方法具有癌症相关基因的mRNA检测具有潜在的应用价值。
[1]Leslie E M,Deeley R G,Cole S P C.Multidrug resistance proteins:role of P-glycoprotein,MRP1,MRP2,and BCRP(ABCG2)in tissue defense[J].Toxicology and applied pharmacology,2005,204(3):216-237.
[2]Zheng D,Seferos D S,Giljohann D A,et al.Aptamer nano-flares for molecular detection in living cells[J]. Nano letters,2009,9(9):3258-3261.
[3]Seferos D S,Giljohann D A,Hill H D,et al.Nano-flares: probes for transfection and mRNA detection in living cells[J].Journal of the American Chemical Society, 2007,129(50):15477-15479.
[4]Frens G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nature,1973,241(105):20-22.
[5]Schmitt J,M?chtle P,Eck D,et al.Preparation and optical properties of colloidal gold monolayers[J].Langmuir, 1999,15(9):3256-3266.
Nano-flares for detection of multidrug resistance associated mRNA
Cai Yu-lin1,Zhou Yun1,Gong Liang2*
(1.Yiyang Zhenyan School,Yiyang 413058,China)(2.College of Life Sciences and Chemistry,Hunan University of Technology,Zhuzhou 412000,China)
Messenger RNA(mRNA)is a large family of RNA molecules that convey genetic information from DNA to the ribosome.Detection of mRNA expression and investigation of their function have great impact on cancer research.Nano-flares,a novel gold nanoparticle-DNA complex exhibits great stability and specificity in detection and imaging cancer related mRNA.In this paper,we utilize nano-flares to detect mRNA associated with multidrug resistance.
mRNA;multidrug resistance gene;nano-flares
生化分析与生物传感;国家自然科学基金(21325520)
*通信联系人,E-mail:gl569940808@126.com

