基于纳米空心Pt-Au 复合物共修饰癌胚抗原免疫传感器的研究
朱宇萍,刘丹丹
(内江师范学院化学化工学院,四川内江 641112)
基于纳米空心Pt-Au 复合物共修饰癌胚抗原免疫传感器的研究
朱宇萍*,刘丹丹
(内江师范学院化学化工学院,四川内江 641112)
利用牺牲模板法制备纳米空心Pt-Au复合物。将萘酚/硫堇通过键合作用修饰在玻碳电极表面,并利用硫堇的氨基将表面吸附有亚硒酸根负离子的空心纳米Pt-Au复合物修饰在萘酚/硫堇膜表面,以此固载癌胚抗体,从而构建新型癌胚抗原免疫传感器。以循环伏安法对电极构建过程及性能进行测试,结果表明,此免疫传感器对癌胚抗原有良好的电流响应。在优化实验条件下,癌胚抗原(CEA)的浓度在0.1~80 ng/mL内有良好的线性关系,检测限为0.03 ng/mL。该免疫传感器有望应用于临床上CEA的检测。
癌胚抗原;免疫传感器;空心纳米材料;硫堇;Pt-Au
0 引言
癌胚抗原(CEA)是一种具有黏附性、可溶性的异性糖蛋白分子。研究发现肿瘤患者血清中CEA浓度较之正常人有所上升,临床上CEA可作为肺癌、乳腺癌、肠癌等多种癌症的肿癌标志物之一,通过患者血清中CEA浓度可检测肿癌变[1]。
当前已有酶联免疫吸附法(ELISA)、时段辨别荧光免疫法(TRFIA)、放射性免疫法(RIA)、化学发光免疫法(CLIA)[2]等检测CEA。但CLIA检测仪器价格昂贵、RIA自身的放射污染及使用条件的限制。电化学免疫传感器拥有制作简单、高灵敏度、检测快速便捷、稳定性好等优点,电化学免疫传感器对CEA的定量测定有着更高的利用前景。
纳米材料是近年来应用较多的新型材料。纳米材料拥有比表面效应、量子尺寸效应、小尺寸效应和宏观量子隧道效应[3-4],许多文献报道用纳米材料构建免疫传感器。以纳米复合物作为基底,固载生物分子能够加大固载量、提高反应活性;另外纳米材料生物相容性可保持吸附的抗体生物活性、无毒性和生物可降解性[5]。将Fe304@Au磁性纳米材料[6]、碳纳米管[7]、石墨烯纳米复合物[8]等引入免疫传感器的制作已屡见不鲜,空心结构的纳米材料具有较大的内腔,在药物缓释、输送等领域有明显的载带能力[9]。而金(Au)、铂(Pt)纳米材料就具有比表面大、良好稳定性、生物相容等性质。另外空心纳米Pt-Au复合物具有微球的构型,较大的内部空腔可以包裹更多的生物大分子及纳米颗粒,从而提高其固载量。同时空心纳米微球比实心纳米微球具有更高的催化活性[10],也能有效提高抗体的生物活性。实验利用亚硒酸(H2SeO3)还原硒核铂-金壳结构(Se@Pt-Au)实心纳米粒子而得到空心纳米Pt-Au,其表面吸附的亚硒酸根负离子(SeO32)可加快电子的传递。另外Au与硫堇(Thi)上的氨基(-NH2) π-π共轭效应可加大对纳米空心Pt-Au的固载。
含有两个-NH2的Thi染料分子是一种固载纳米Pt-Au的良好电子媒介材料[11]。通过萘酚(Nafion)上磺酸基与Thi离子交换将Thi组装在电极表面[12]。表面吸附有SeO32-的空心纳米Pt-Au微球与电极上Thi中的-NH2结合,并用牛血清白蛋白(Bovine serum albumin,BSA)封闭非特异性吸附点,从而制得一种新型的CEA免疫传感器。
1 实验部分
1.1 仪器与试剂
CH1660D电化学工作站(上海辰华仪器公司);AB204-S电子天平(瑞士Mettler-toledo公司);MP230酸度计(瑞士Mettler-toledo公司);BRAN-SONIC 200超声清洗仪(德国BRASON ULTRASCHALL公司);DF-101S型集热式恒温加热磁力搅拌器(上海瑞兹仪器设备有限公司);回流装置(冷凝管、蒸馏烧瓶、铁架台等);K2Cr2O7-H2SO4浸泡、清洗所有的玻璃仪器,晾干。
氯铂酸(H2PtCl6)(上海化学试剂公司)、氯金酸(HAuCl4)(上海化学试剂公司)、萘酚(Nafion)(美国sigma公司)、硫堇(Thi)、亚硒酸(H2SeO3)、癌胚抗原(CEA)和抗体(anti-CEA)(郑州博赛生物技术股份有限公司)、牛血清白蛋白(BSA)(美国sigma公司)、抗坏血酸(Vitamin C,VC)、氯化钾(KCl)、醋酸(HAc)、醋酸钠(NaAc),以上试剂未加说明,均为分析纯,实验用水为二次蒸馏水。
1.2 空心纳米铂-金(Pt-Au)的制备
按文献[13-14],将0.1 mol/L的VC溶液1 mL迅速加入至60 mL 1.5×10-3mol/L的H2SeO3溶液中,室温下搅拌30 min,制备得到砖红色的硒溶胶(Se)。在搅拌条件下将0.0193 mol/L H2PtCI6与0.02428 mol/L HAuCl4按1∶1(V∶V)混合均匀滴加到25 mL的Se溶胶中,同时加入0.1 mol/L VC溶液1 mL。室温下搅拌反应约0.5 h,即制得硒核铂-金壳结构的实心纳米粒子(Se@Pt-Au)。在100℃下,将Se@Pt-Au实心纳米粒子与过量的1.0×10-3mol/L亚硫酸钠(Na2SO3)在碱性条件下一起回流冷凝反应2 h,经离心清洗,可得到不含Se的Pt-Au纳米空心微球。
1.3 免疫传感器的制备
将玻碳电极(GCE)(φ=4 mm)依次用0.3、0.05 μm的氧化铝糊(Al2O3)抛光至镜面。用二次蒸馏水冲洗以除去抛光粉。并依次用二次蒸馏水、无水乙醇、二次蒸馏水在超声仪中分别超声清洗5 min,室温下晾干,备用。
用微量注射器取1.25%(ω%)Nafion溶液5 μL滴凃在已处理过的GCE表面,自然晾干后置于0.05 mol/L Thi中浸泡30 min,取出、干燥,制得表面为深蓝色的硫堇膜电极。再将修饰有Thi的电极浸泡在空心纳米Pt-Au溶胶中,1 h后取出自然晾干。接着将上述修饰电极浸泡在anti-CEA与二次蒸馏水的混合溶液(V∶V=1∶1)中置于4℃的冰箱中,孵育8 h。最后用0.25%(ω%)的BSA溶液浸泡修饰电极30 min,取出,存放在4℃的冰箱中,备用。制备过程见图1。
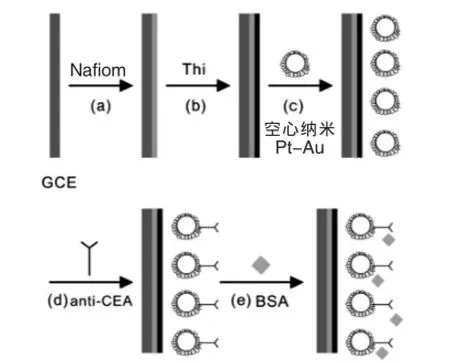
图1 免疫传感器的制备过程Fig.1Schematic diagram of the stempwise immunosensor construction process
1.4 检测方法
实验选用循环伏安法(Cyclic Voltammentry,CV)表征不同修饰阶段下电极的电化学行为。电极测量采用三电极系统:Ag-AgCl电极为参比电极,铂电极(Pt)为对电极,被修饰的GCE电极为工作电极。0.1 mol/L HAc-NaAc(pH=5.5)溶液为测试底液。-0.6~0.2 V范围为循环伏安法的测试电位。扫描速率为50 mV/s。无特别说明,实验均在25℃的温度下进行。
2 结果与讨论
2.1 免疫传感器的电化学特性
运用CV法研究电极在制备过程的电化学特性。图2中曲线a为GCE在0.1 mol/L KCl+HAc-NaAc(pH5.5)溶液中的扫描曲线。由图可见,无氧化还原峰。这是由于测试底液中没有氧化还原探针存在。曲线b为电极修饰了Nafion的循环伏安曲线。因为Nafion是大分子有机物会阻碍电子传输能力,其电化学过程是非可逆,所以电极上修饰Nafion后仍无氧化还原锋[15]。当电极表面修饰上Thi后出现一对准可逆的氧化还原峰,这是由于Thi分子的-NH2与质子(H+)结合促进Thi的氧化还原。表明Thi有利于电子的传递(曲线c)[16]。纳米空心Pt-Au微球通过静电吸附到修饰电极上后,其氧化峰值进一步上升(曲线d)。这是因为Pt-Au良好导电性、大的比表面能加快电子的传递[17]。另外Pt-Au之间存在协同作用也会使电流值增加[18]。当anti-CEA通过自身的-NH2与Pt-Au形成π-π共轭固载到空心纳米Pt-Au的表面[19],其氧化锋的电流值明显降低(曲线e),这是因为抗体是大分子蛋白质,且具有疏水性阻碍了电子的传递[20]。曲线f是用BSA封闭电极表面的非特异性吸附位点,氧化峰值进一步下降。当被修饰的电极在20 ng/mL CEA抗原中孵育15 min后,氧化峰电流值再次下降(曲线g),表明结合形成的免疫复合物阻止了电子的传输[21]。
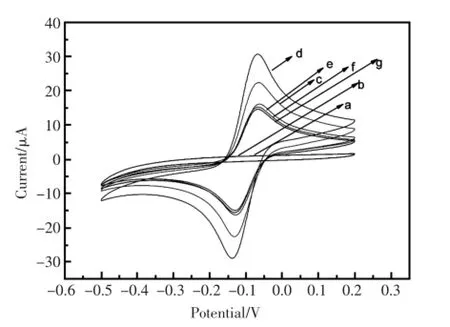
图2 电极在修饰过程中的循环伏安图Fig.2Cyclic voltammograms of different electrodes (a)bare GCE electrode;(b)Nafion/GCE;(c)Thi/Nafion/GCE (d)空心纳米Pt-Au微球/Thi/Nafion/GCE; (e)anti-CEA/空心纳米Pt-Au微球/Thi/Nafion/GCE (f)BSA/anti-CEA/空心纳米Pt-Au微球/Thi/Nafion/GCE (g)CEA/BSA/anti-CEA/空心Pt-Au微球/Thi/Nafion/GCE
图3是在HAc-NaAc(pH5.5)的溶液中,免疫传感器以不同扫描速率的CV的表征图。由内至外的扫描速度分别是:25、50、100、150、200、300、400、500、600、700 mV/s。随着扫描速率的增加,氧化峰的电流值逐渐增长,还原峰的电流值逐渐减小,且氧化峰、还原峰的电流值分别与扫描速度的平方根呈线性关系(见插图)。其氧化峰的线性方程为Current=3.0997v1/2+0.8659,相关系数为0.9996;还原峰的线性方程为Current=-2.8730 v1/2-3.4925,相关系数为-0.9974。表明该免疫传感器的氧化还原反应受扩散过程的影响[20]。
2.2 实验条件的优化
2.2.1 缓冲溶液pH的优化
pH对免疫电极的检测的影响有两个方面:一方面对抗体、抗原活性的影响;另一方面,蛋白质生物兼容性[10]。实验探究缓冲溶液的pH值在3.5~7.0范围内,免疫传感器的电化学响应特性。由图4可知,氧化峰电流值随着缓冲液pH值增大而逐渐减小。H+过大有利于电子媒介Thi发生氧化还原反应,但H+过高引起蛋白质变性及缩短免疫传感器使用寿命[22],同时H+过低易引起蛋白质失活。因此,实验选择缓冲液的最佳pH值为5.5。
2.2.2 孵育时间的优化
抗体与抗原的反应是一种动态平衡,不同的抗原与抗体反应的平衡常数不同[21]。抗原与抗体免疫结合的复合物会随着结合时间延长而增加直至达到平衡态。实验检测了免疫传感器在不同孵育时段的氧化峰电流值。图5可见,在初始20 min内,氧化峰电流值随着时间增大而减小,说明抗原、抗体在不断进行特异性结合。20 min后峰电流值基本不变。表明20 min时免疫电极上复合物量达到基本恒定。因此选择20 min为免疫孵育时间。
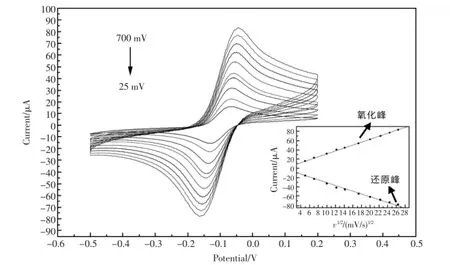
图3 免疫电极在不同的扫描速率下的循环伏安图(插图:扫面速度的平方根与电流的关系图)Fig.3Cyclic voltammograms of immunoelectrode at different scan rates. inset;plots of peak currents vs.v1/2
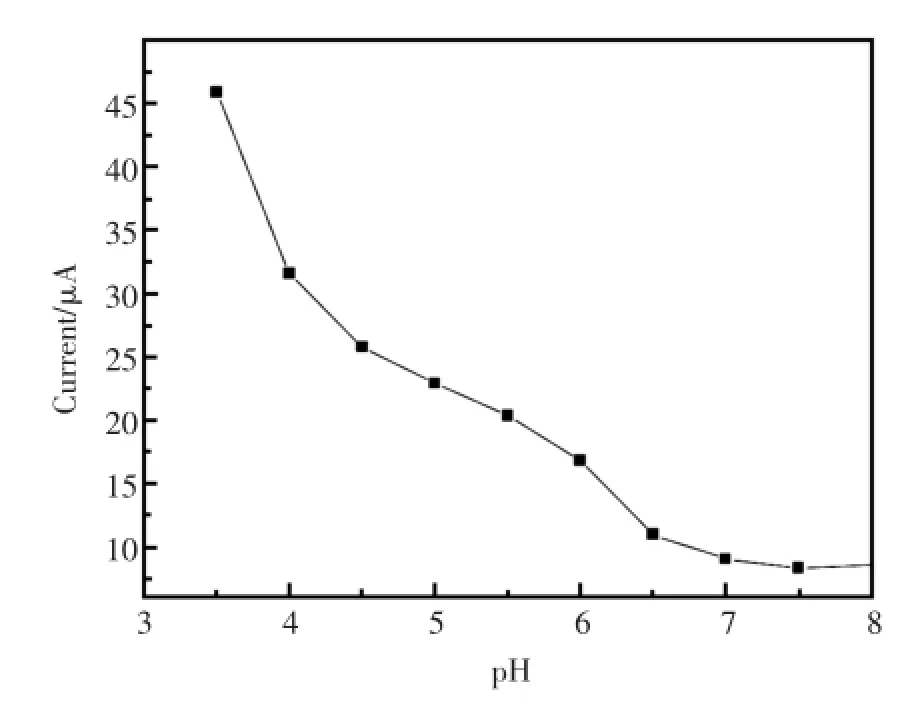
图4 免疫传感器在不同pH缓冲液下的循环伏安图Fig.4Cyclic roltammograms of the immunosensor in buffer solution at various pH
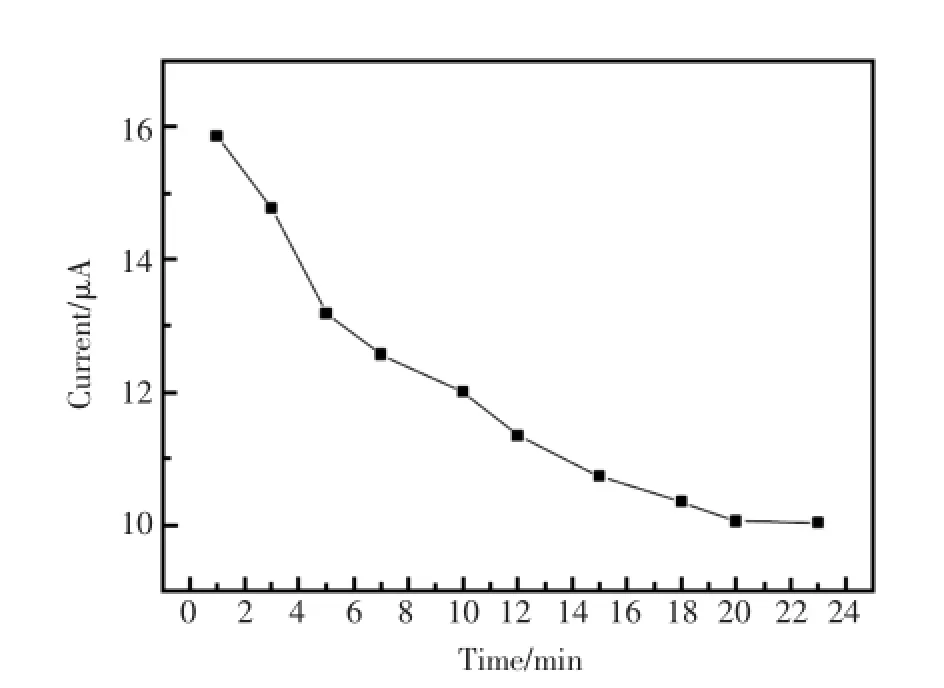
图5 孵育时间对免疫传感器的影响Fig.5Effect of incubating time on immunoreaction
2.2.3 孵育温度的优化
温度太低,蛋白质分子的活性下降,从而抗原与抗体结合的速率慢,反应时间长;温度较高时,蛋白质分子活性高,抗原抗体结合的速率快,反应时间短[5]。然而,高温会导致抗原和抗体蛋白失活或损失。实验研究在5~45℃范围内免疫传感器的响应电流。由图6结果表明,免疫传感器的氧化峰电流值随测试温度的升高而降低,在接近人体体温(37℃)时,免疫反应最充分,电流值最小。当再次升高温度,免疫传感器响应电流值升高,但过高温度使部分复合物失活或变性。免疫传感器长时间高温下,不利于其本身的性能和寿命,因而选择25℃为最佳孵育温度。
2.3 免疫传感器的性能
2.3.1 免疫传感器对CEA抗原的响应标准曲线
在优化实验条件下,将免疫传感器依次置于不同浓度的CEA抗原中孵育20 min后,进行CV表征。其氧化峰电流值随着CEA抗原浓度的增加不断减小(见图7)。实验结果表明,CEA浓度在0.1~80 ng/mL范围内,免疫传感器的氧化电流值与CEA浓度呈良好的线性关系。线性方程为Current=-0.0523c+14.69,相关系数为0.9932,该电极的检出限为0.03 ng/mL。
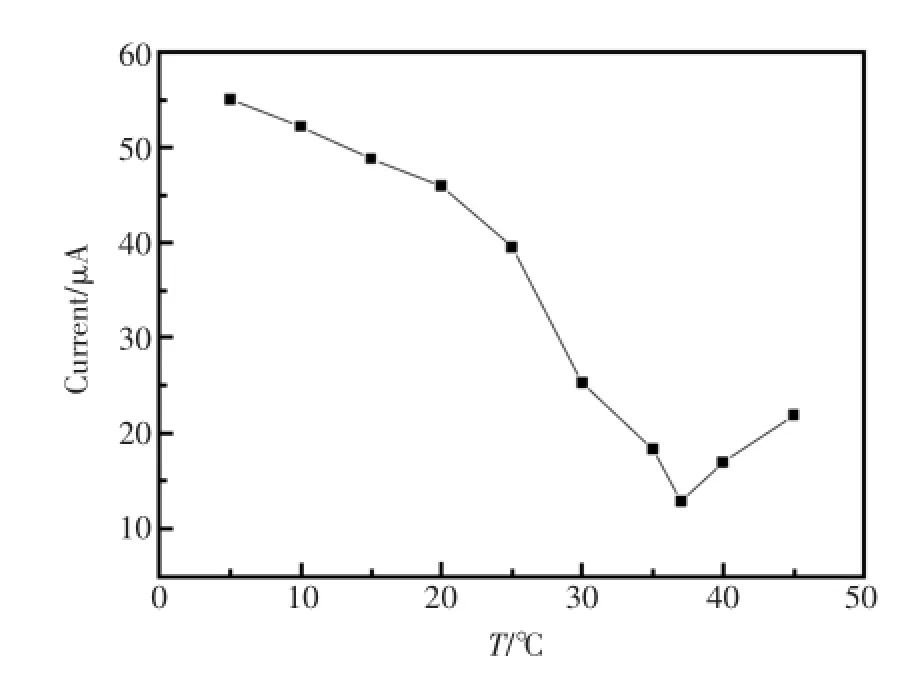
图6 孵育温度对免疫传感器的影响Fig.6Effect of incubating temperature on immunoreactions
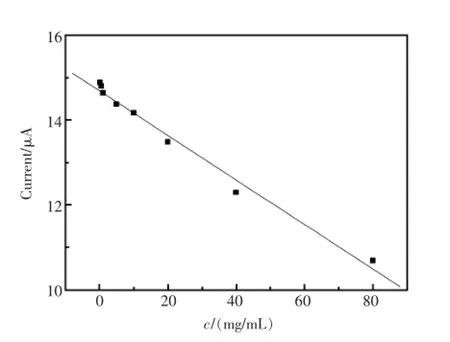
图7 峰电流与CEA抗原浓度的关系Fig.7Linear relationship between anodic peak current response
2.3.2 免疫传感器的选择性
考察了免疫传感器在有干扰物的混合溶液中的选择性。将免疫传感器分别置于含80 ng/mL CEA抗原纯溶液与含80 ng/mL CEA抗原及干扰物(AFP抗原、L-半胱氨酸、牛血清蛋白、抗坏血酸、葡萄糖)[19]的混合溶液中各孵育20 min,进行对比实验。结果显示,免疫传感器在混合溶液中的电流值与仅含有80 ng/mL CEA抗原溶液中的电流值相差2.8%,表明该免疫传感器的选择性良好。
3 结论
实验向预处理的GCE电极上滴涂Nafion,利用Nafion的磺酸基结合Thi,将Thi修饰在GCE电极上。利用Thi的-NH2将表面吸附有SeO32-的空心纳米Pt-Au微球修饰在萘酚/硫堇膜表面,从而构建了一种新型的CEA免疫传感器。该传感器特点在于利用加大比表面的空心纳米Pt-Au微球的空心结构及Pt-Au生物相容性,对抗原固定量方面有所提高。实验表明,该CEA传感器制备简单,抗干扰能力强,为CEA的检测提供了一个较好的方法,有望应用于临床CEA检测。
[1]安海珍,袁若,柴雅琴,等.基于聚硫堇、DNA纳米银复合物共修饰癌胚抗原免疫传感器的研究[J].化学学报,2008,66(6):633-638.
[2]赵锦航,牛小方,郑丽,等.基于HGB/PTh/AuNCs无标记癌胚抗原免疫传感器的研究[J].化学研究与应用, 2014,26(5):652-657.
[3]王广凤,朱艳红,陈玲,等.功能性纳米材料在电化学免疫传感器中的应用[J].分析化学评价与进展, 2013,41(4):608-615.
[4]朱宇萍,何伟,王碧.新型纳米二氧化钛的制备、表征及其在甲胎蛋白免疫传感器中的应用[J].分析测试学报,2013,32(11):1322-1327.
[5]张萍,冯年平,武培怡.聚合物空心纳米球及其在药学领域的应用[J].上海:上海中医药大学药剂教研室, 2006,30(8):350-353.
[6]朱宇萍,袁若,柴雅琴,等.基于碳纳米管/L-半管氨酸/ Fe3O4@Au的纳米复合材料的电流型甲胎蛋白免疫传感器的研究[J].分析化学,2012,40(3):359-364.
[7]Su Hui lan,Yuan Ruo,Chai Ya qin,et al.An Amperometric α-1-Fetoprotein Immunosensor Based on Sandwich Nanohybrid of Functionalized Multi-walled Carbon Nanotubes[J].Journal of Instrumental Analysis,2012, 31(9):1064-1069.
[8]刘艳,石文兵.功能化石墨烯复合材料在电化学免疫传感器中的应用[J].河南师范大学学报(自然科学版),2014,42(6):55-61.
[9]Hu Y,Jiang X Q,Ding Y,et al.Core-template-free strategy for preparing hollow nanospheres[J].AdvMater, 2004,16(11):933-937.
[10]梁敏.基于无机纳米材料构建夹心免疫传感器的研究[D].重庆:西南大学,2011.
[11]Chen Xian Guang,Qian Ying,Zhuang Su Juan,et al.Hydrogan peroxide Biosensor Based on Immobilizing Enzyme by Gold Nanoparticles and Thionine[J].Acta chimica sinice,2007,65(4):337-343.
[12]朱宇萍,袁若,柴雅琴,等.纳米金与磁性纳米复合物构建电流型免疫传感器的研究[J].分析测试学报, 2012,31(4):423-429.
[13]颜亮亮,温飞鹏,徐金龙,等.铂-金-铂纳米空球的制备及其催化甲酸氧化性能[C].第十二届全国有机分子电化学与工业学术会议论文集.上海:华东理工大学,2010.276-277.
[14]钟艳,温飞鹏,徐金龙,等.金-铂纳米空球催化甲醇氧化的行为[C].第十二届全国有机分子电化学与工业学术会议论文集.上海:华东理工大学,2010.173-177.
[15]李娟,贾丽萍,姚飞,等.Nafion/DNA/纳米铂复合膜修饰电极的制备及其应用于多巴胺的高灵敏高选择性测定[J].南京师大学报(自然学科版),2013,36(2): 67-73.
[16]李春香,曾云龙.基于原位电聚合硫堇的双酶型葡萄糖传感器的研究[J].分析科学学报,2006,22(3):339-341.
[17]刘珂珂,刘清,黄海平,等.基于聚(3,4-乙烯二氧噻吩) /天青I复合物薄膜和纳米金修饰的电流型甲胎蛋白免疫传感器的研究[J].分析化学,2014,42(2):192-196.
[18]李正.双金属纳米粒子修饰电极的电催化及无试剂电化学免疫传感器研究[D].江苏:苏州大学,2008.
[19]冉小琪.基于纳米材料构建甲胎蛋白、癌胚抗原及人绒毛膜促性腺激素电化学免疫传感器的研究[D].重庆:西南大学,2011.
[20]余晟,刘雪,余萌,等.石墨烯修饰离子液体电极制备癌胚抗原免疫传感器[J].信阳师范学院学报(自然科学版),2012,25(2):530-533.
[21]管姝,袁若,柴雅琴,等.基于聚2,6-二氨基吡啶膜及纳米金修饰的癌胚抗原免疫传感器研究[J].化学学报,2009,67(16):1923-1928.
[22]刘亚西.基于纳米材料构建癌胚抗原及甲胎蛋白电化学免疫传感器的研究[D].重庆:西南大学,2010.
Study on the carcinoembryonic antigen immunosensor modified by Pt-Au hollow nanocomposites
Zhu Yu-ping*,Liu Dan-dan
(College of Chemistry and Chemical Engineering,Neijiang Normal University,Neijiang 641112,China)
The Pt-Au hollow nanocomposites was prepared by template sacrifice.By bonding action,the nafion/ thionine was modified on the surface of the glassy carbon electrode.The Pt-Au hollow nanocomposites on which surface the selenite anion was adsorbed,were modified on the surface of the nafion/thionine film by the amidogen of the thionine,to immobilize antibody CEA to construct the CEA immunosensor.The conconstruction process and performance of the electrode were measured.The result showed that the immunosensor had well current response for CEA.Under the optimal conditions,in the concentration of CEA of 0.1~80 ng/mL,the linear relation was well,and the detection limit was 0.03 ng/mL.The immunosensor could be used for the clinical detection of CEA.
CEA;immune sensor;hollow nanocomposites;thionine;Pt-Au
四川省教育厅科研项目(15ZA0292)
*通信联系人,Tel:13696067037,E-mail:judy20060830@163.com

