基于目标物循环放大和DNA 分子机器的电致化学发光microRNA 传感器的研究
蒲楠平,张璞,卓颖*
(1.西南大学附属中学,重庆 400715)(2.西南大学化学化工学院,发光与实时分析重点实验室,重庆 400715)
基于目标物循环放大和DNA 分子机器的电致化学发光microRNA 传感器的研究
蒲楠平1,张璞2,卓颖2*
(1.西南大学附属中学,重庆 400715)(2.西南大学化学化工学院,发光与实时分析重点实验室,重庆 400715)
该研究首次将DNA分子机器—DNA纳米镊子引入到ECL传感体系中,并设计构建了新型的DNA酶诱导的目标物循环放大的电致化学发光生物传感器,用于超灵敏检测癌症细胞中的microRNA。首先,目标物microRNA-21依次打开两个发夹型探针,形成“Y”型DNA结构。通过DNA酶(Pb2+)的剪切实现了目标物的循环放大,并得到了大量的DNA引发链。该引发链可“关闭”DNA纳米镊子,随着镊子两端的发光物质靠近而发生能量转移,钌将能量转移给量子点,因而量子点电致化学发光信号得到显著增强。在优化的实验条件下,线性范围为10 nmol/L~0.1 pmol/L,检测限为0.03 pmol/L(S/N=3)。该研究通过引入新型的DNA分子机器,拓展了DNA纳米技术在生物传感及临床诊断方面的应用,对于疾病诊断及预防具有重要的理论意义及实用价值。
电致化学发光;目标物循环策略;MicroRNA;DNA分子机器
0 引言
在生物的整个发育过程中,microRNA具有调节细胞早期发育,参与细胞分化和组织发育,调控基因表达的生物功能[1-3]。近年来,MicroRNA对细胞进程的调控功能,尤其是对肿瘤等疾病进程的调控功能研究已发展为生物医学最热门的研究领域之一[4-6]。它的表达异常可以引起细胞分化、增殖、凋亡的异常,这与肿瘤的发生、发展关系密切。其作为疾病诊断的重要分子生物学标志物,在肿瘤的诊断、治疗中有着重要的潜在价值[7-8]。构建电化学生物传感器对microRNA进行检测,受到了越来越多科学研究者的关注。
分子机器人,是人类征服自然的整个宏伟蓝图中最富有想像力和创造力的部分,而且运用于医学可以用来清除肌体深处的病毒、癌细胞等,分子机器也称分子马达(molecular motor),由生物大分子构成,是能将化学能转化为机械能的纳米系统[9-10]。分子马达大体可分为六类:细胞骨架蛋白、聚合体、G蛋白、旋转的马达、环状蛋白以及核苷酸马达。天然的分子马达在生物体内的胞质运输、DNA复制、细胞分裂、肌肉收缩等生命活动起着重要作用。通过对分子马达的深入研究,分子机器人的研发已成为当今科技的前沿热点[11-12]。DNA分子步行器可分为spiders、tweezers、gears、walkers等。其中,DNA镊子由于其超强的灵活性、生物稳定性和许多动力学性质,具有非常广泛的应用前景。如果将DNA分子机器与ECL检测技术灵敏度高、易操作等优点相结合,必将为ECL生物传感及microRNA的检测提供了新的发展平台。
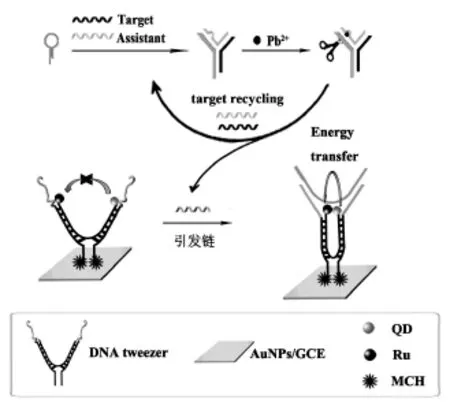
图1 MicroRNA传感器构建示意图Fig.1The operating principle of microRNA sensing platform
以合成制备的具有发光效率高、稳定性好的CdSe/ZnS核壳量子点作为电致化学发光体,该研究首次将DNA分子机器—DNA纳米镊子引入到ECL传感体系中,并设计构建了新型的DNA酶诱导的目标物循环放大的电致化学发光生物传感器,用于超灵敏检测癌症细胞中的microRNA(图1)。首先,目标物microRNA依次打开两个发夹型探针,形成“Y”型DNA结构。通过DNA酶(Pb2+)的剪切实现了目标物的循环放大,并得到了大量的DNA引发链。当引发链存在的条件下,引发链与DNA镊子裸露的单链DNA杂交,DNA镊子关闭,CdSe/ZnS核壳量子点与Ru(bpy)32+距离很近,因而Ru(bpy)32+可以把能量转移给CdSe/ZnS核壳量子点,使CdSe/ZnS核壳量子点的ECL信号大大增强,达到了高灵敏检测microRNA的目的。在优化的实验条件下,线性范围为10 nmol/L ~0.1 pmol/L,检测限为0.03 pmol/L(S/N=3)。该研究利用Pb2+作为剪切酶,不但实现了目标物的循环,降低传感器的检测限,而且避免了传统酶剪切易失活、价格贵等缺点,开辟了DNA链剪切的新途径。通过引入新型的DNA分子机器,拓展了DNA纳米技术在生物传感及临床诊断方面的应用,对于疾病诊断及预防具有重要的理论意义及实用价值。
1 实验部分
1.1 实验试剂
PBS缓冲液(pH7.4);氨基水溶性量子点-625(武汉珈源量子点技术开发有限责任公司);三(2-羧乙基)膦(TCEP)、NaCl(成都市新都区木兰镇工业开发区);MgCl2、柠檬酸三钠(重庆川东化工(集团)有限公司);1%HAuCl4·4H2O(天津市倍思乐色谱技术开发中心);联吡啶钌,巯基乙醇(MCH)(百灵威科技有限公司);DNA链(生工生物工程(上海)股份有限公司);microRNA(大连宝生物公司)。
1.2 实验仪器
CHI660D型电化学工作站(上海辰华仪器有限公司);MPI-E型ECL分析系统多功能化学发光检测仪(西安瑞迈分析仪器有限公司);WH-986静音搅拌器(海门市其林贝尔仪器制造有限公司)。
1.3 实验方法
1.3.1 目标物循环过程
2 μmol/L的发夹型探针、辅助探针与目标物各100 μL于PCR仪中37℃恒温270 min后,得到“Y”型DNA结构;当加入DNA酶—Pb2+后,发夹型探针被剪切成两段,“Y”型DNA结构解体并释放出目标物microRNA,目标物参与下一个循环。与此同时,剪切下来的引发链用于滴加在传感界面上,参与下一步反应。
1.3.2 DNA镊子的制备
将DNA链ABC均匀混合,于37℃下反应210 min,形成DNA镊子结构,并通过Au-S键组装在修饰有金纳米粒子的电极表面,并孵育过夜。将引发链滴于传感界面,用于关闭DNA镊子,此时,接近的量子点与钌产生能量转移,量子点的信号大大增加。
1.3.3 电极传感界面的制备
将玻碳电极依次用0.3 μm和0.05 μm的氧化铝浆料抛光,随后在无水乙醇、去离子水中进行超声清洗,在裸电极检测达到要求后进行修饰。首先将玻碳电极置于1%的氯金酸溶液中,于-0.2 V恒电位下电化学沉积30 s,再滴加10 μL 1 μmol/L DNA镊子溶液,于室温下孵育12 h,随后滴加10 μL MCH溶液孵育40 min以封闭多余的结合位点,防止非特异性吸附。滴加10 μL引发链,室温下在电极表面孵育2 h后,即得到ECL传感器界面。
2 结果与讨论
2.1 MicroRNA传感器的响应性能
在最优条件下,将传感器用于不同浓度的microRNA-21检测,探究ECL强度与microRNA浓度的关系(图2)。在一定范围内,随着microRNA-21浓度的增加,ECL峰值逐渐增高,峰型良好,且ECL强度与microRNA浓度的半对数呈现良好的线性关系。其线性范围为10 nmol/L~0.1 pmol/L,线性回归方程为I=13140.63+3199.86 lg c,相关系数r2为0.9935,检出限为0.03 pmol/L (S/N=3)。
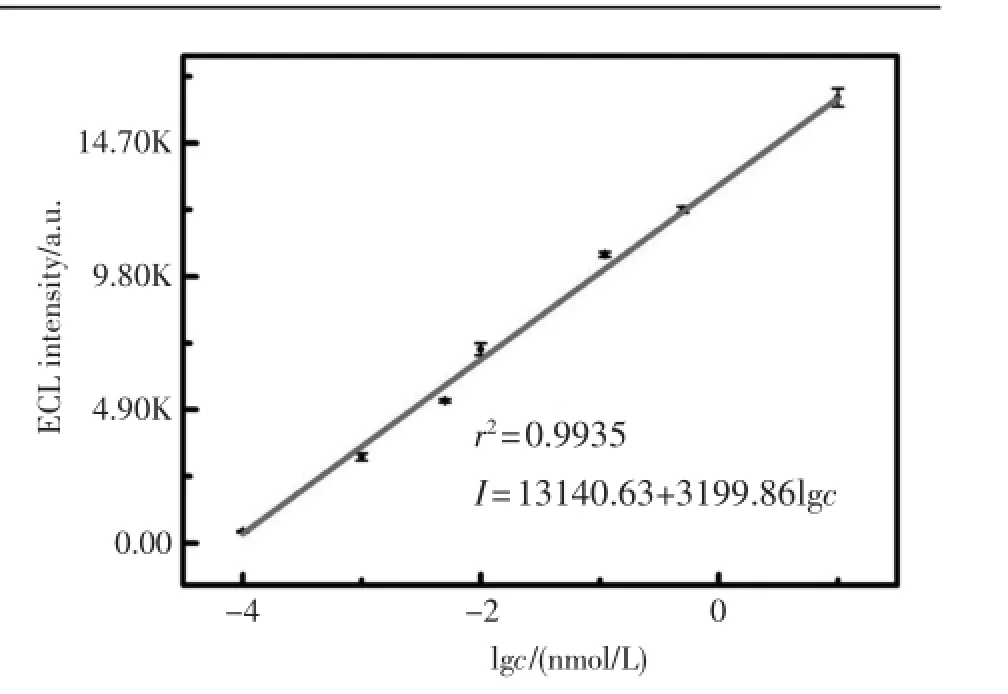
图2 microRNA传感器的校正曲线Fig.2Calibration curve for the various concentrations of microRNA
2.2 microRNA传感器的稳定性
在最优条件下,将已制备好的传感器连续扫描10圈(如图3),得到的ECL信号的相对标准偏差(RSD)为1.17%,表明传感器的稳定性良好,能保证测量的精确度,有望用于实际样品的检测。
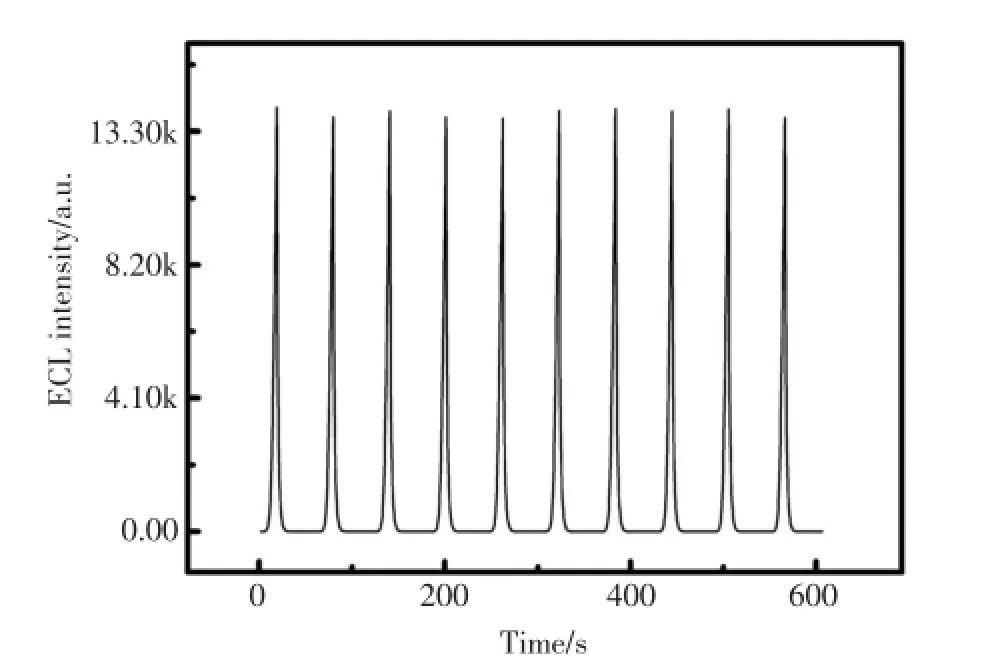
图3 在以循环伏安法连续扫描10圈的条件下,MicroRNA传感器信号表现出的稳定性Fig.3The stability of the proposed biosensor with ECL intensity-time curve under consecutive cyclic potential scans for 10 circles
2.3 microRNA传感器的重现性
在同一批电极中,取四根电极构建相同的传感器并测量其ECL信号,对比信号值得到批内重现性。再取同一根电极,连续三天构建相同的传感器,并测定其ECL信号,对比信号值得到批间重现性。实验结果得到批内、批间的相对标准偏差(RSD)均小于5%,说明构建的传感器重现性良好。
2.4 microRNA传感器的选择性
为了考察microRNA-21传感器的特异性,选取microRNA-155作为干扰物质进行测定(如图4)。分别以(A)blank,(B)microRNA-155,(C)microRNA-21,(D)microRNA-155+microRNA-21替换目标物microRNA-21,在相同条件下测得ECL信号。实验结果表明,microRNA-155对ECL信号的影响可忽略不计,即构建的传感器对microRNA-21的检测具有良好的特异性。
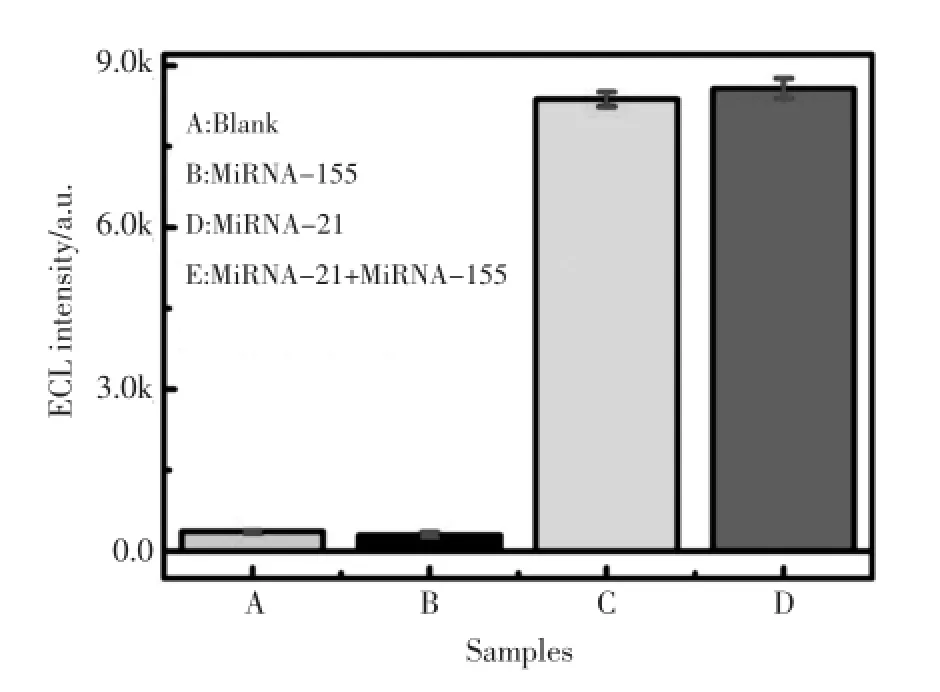
图4 microRNA-21生物传感器的特异性(A)空白对照;(B)microRNA-155(50 pmol/L);(C)microRNA-21 (1 pmol/L);(D)microRNA-21(1 pmol/L)+microRNA-155 (50 pmol/L)Fig.4The specificity of the proposed ECL biosensor:(A) Blank,(B)microRNA-155(50 pmol/L),(C)microRNA-21 (1 pmol/L),(D)microRNA-21(1 pmol/L)+microRNA-155 (50 pmol/L)
3 结论
综上所述,该研究将分子生物学和纳米材料技术结合,运用了目标链循环放大,并首次将DNA分子机器—DNA纳米镊子引入到ECL传感体系中,设计构建了新型的电致化学发光生物传感器,用于超灵敏检测癌症细胞中的microRNA-21。在优化的实验条件下,线性范围为10 nmol/L ~0.1 pmol/L,检测限为0.03 pmol/L(S/N=3)。通过引入新型的DNA分子机器,拓展了DNA纳米技术在生物传感及临床诊断方面的应用,对于疾病诊断及预防具有重要的理论意义及实用价值,有望用于前列腺癌的早期诊断及治疗。
[1]Jiang S,Zhang H W,Lu M H,et al.MicroRNA-155 functions as an OncomiR in breast cancer by targeting the suppressor of cytokine signaling 1 gene[J].Cancer Research,2010,70:3119-3127.
[2]Xu B,Feng N,Li P,et al.A functional polymorphism in Pre-miR-146a gene is associated with prostate cancer risk and mature miR‐146a expression in vivo[J].The Prostate,2010,70(5):467-472.
[3]Zamore P D,Haley B.Ribo-gnome:the big world of small RNAs[J].Science,2005,309:1519-1524.
[4]Zhang P,Wu X,Chai Y,et al.An electrochemiluminescent microRNA biosensor based on hybridization chain reaction coupled with hemin as the signal enhancer[J]. Analyst,2014,139(11):2748-2753.
[5]Chen A,Ma S,Zhuo Y,et al.In Situ Electrochemical Generation of Electrochemiluminescent Silver Naonoclusters on Target-Cycling Synchronized Rolling Circle Amplification Platform for MicroRNA Detection[J]. Analytical Chemistry,2016,88(6):3203-3210.
[6]Yang C,Dou B,Shi K,et al.Multiplexed and amplified electronic sensor for the detection of microRNAs from cancer cells[J].Analytical Chemistry,2014,86(23): 11913-11918.
[7]Zhou W,Li D,Chai Y,et al.RNA responsive and catalytic self-assembly of DNA nanostructures for highly sensitive fluorescence detection of microRNA from cancer cells[J].ChemicalCommunications,2015,51(92): 16494-16497.
[8]Hamilton A J,Baulcombe D C.A species of small antisense RNA in posttranscriptional gene silencing in plants [J].Science,1999,286:950-952.
[9]Chen Y,Liu H P,Ye T,et al.DNA-Directed Assembly of Single-Wall Carbon Nanotubes[J].Journal of the American Chemical Society,2007,129:8696-8697.
[10]Stulz E,Clever G,Shionoya M,et al.DNA in a modern world[J].Chemical Society Review,2011,40:5633–5635.
[11]Ding B Q,Deng Z T,Yan H,et al.Gold Nanoparticle Self-Similar Chain Structure Organized by DNA Origami [J].Journal of the American Chemical Society,2010, 132:3248–3249.
[12]Silvia H A,Karolis M,Vivek V T,et al.Voltage-Dependent Properties of DNA Origami Nanopores[J].Nano Letter,2014,14:1270-1274.
Studies on electrochemiluminescence microRNA biosensor based on target recycling amplification and DNA nanomachine
Pu Nan-ping1,Zhang Pu2,Zhuo Ying2*
(1.Affiliated middle school of Southwest University,Chongqing 400715,China)
(2.Key Laboratory of Luminescent and Real-Time Analytical Chemistry,College of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
A novel electrochemiluminescence(ECL)biosensor was constructed for the highly-sensitive detection of microRNA-21 coupling with the target recycling amplification and the DNA nanomachine.First,the primer probe with assistant probe and miRNA formed Y junction which was cleaved with the addition of Pb2+to release microRNA. Subsequently,the released microRNA could initiate the next recycling process,leading to the generation of numerous DNA reporters.In the presence of the DNA reporters,the tweezer transformed to“closed”state through the hybridization of reporter DNA and generate ERET of Ru(bpy)32+and QDs,increasing the ECL intensity of QDs remarkably.The proposed biosensor realized high sensitive detection of the microRNA in cancer cell.The linearity range was 10 nmol/L~0.1 pmol/L with a detection limit down to 0.03 pmol/L(S/N=3).This work offers a new modular platform for the construction of DNA nanomachines which could serve as an effective signal amplification strategy for the real application in biosensing and clinical diagnosis.
electrochemiluminescence;target recycling amplification strategy;microRNA;DNA nanomachine
国家自然科学面上基金项目(21575116,21675129,21675130);中央高校基本科研业务费专项资金资助(XDJK2015A002)
*通信联系人,E-mail:yingzhuo@swu.edu.cn,Tel:Fax:023-68253172

