传承和经典并重 融合与创新凸显
——2016高考化学反应速率和化学平衡命题分析
山东 孙 晶
传承和经典并重 融合与创新凸显
——2016高考化学反应速率和化学平衡命题分析
山东 孙 晶
备受瞩目的2016高考已落下帷幕,今年的高考命题有哪些特点?难度、新颖度如何?命题的侧重点对考生的知识结构与能力要求有哪些变化呢?我们在平日学习《化学反应速率和平衡》过程中应该从哪些方面培养自己的学习品质和思维能力呢?笔者精选几例,略作分析,算是抛砖引玉。
命题角度一:融合食品常识考查反应速率
例1 (2016北京)下列食品添加剂中,其试用目的与反应速率有关的是 ( )
A.抗氧化剂 B.调味剂
C.着色剂 D.增稠剂
【解析】抗氧化剂减少食品与氧气的接触,延缓氧化的反应速率,故A项正确;调味剂是为了增加食品的味道,与速率无关,故B项错误;着色剂是为了给食品添加某种颜色,与速率无关,故C项错误;增稠剂是改变物质的浓度,D项与速率无关。
【答案】A
【解法点睛】该题融合生活实际,与生活中息息相关的食品添加剂为命题背景,凸显命题的灵活与学以致用。
命题角度二:融合信息给予考查化学平衡移动
例2 (2016北京)K2Cr2O7溶液中存在平衡:(橙色)+(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
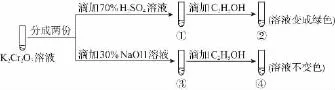
结合实验,下列说法不正确的是 ( )
A.①中溶液橙色加深,③中溶液变黄
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
【解析】在平衡体系中加入酸,平衡逆向移动,重铬酸根离子浓度增大,橙色加深,加入碱,平衡正向移动,溶液变黄,故A项正确;②中重铬酸钾氧化乙醇,重铬酸钾被还原,故B项正确;②是酸性条件,④是碱性条件,酸性条件下氧化乙醇,而碱性条件不能,说明酸性条件下氧化性强,故C项正确;若向④溶液中加入70%的硫酸到过量,溶液为酸性,可以氧化乙醇,溶液变绿色,故D项错误。
【答案】D
【解法点睛】本题以元素化合物知识作为背景信息,既考查了考试领悟新知识与平衡移动知识的融通能力,同时巩固了酸碱性环境不同时,含铬化合物颜色的多变性,体现了灵活机动、辩证发展看问题的人文思想。
命题角度三:融合图象分析综合考查
例3 (2016四川)一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(gCO(g)+3H2(g),设起始= Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是 ( )

A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
D.温度不变时,图中X 点对应的平衡在加压后φ(CH4)减小
【解析】从图分析,随着温度升高甲烷的体积分数逐渐减小,说明升温平衡正向移动,则正反应为吸热反应,故A项正确;的比值越大,则甲烷的体积分数越小,故a<3<b,故B项错误;起始加入量的比值为3,但随着反应的进行甲烷和水是按等物质的量反应,所以到平衡时比值不是3,故C项错误;温度不变时,加压,平衡逆向移动,甲烷的体积分数增大,故D项错误。
【答案】A
【解法点睛】平衡图象是历年高考命题的主角,但是2016年的创新之处是以反应物的比值作为变量进行平衡移动分析,于经典之中凸显创新,与传承之中侧重思维的综合性和融通性。
命题角度四:融合表格分析考查平衡比较
例4 (2016江苏)一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(gCH3OH(g)达到平衡。下列说法正确的是 ( )

容器 温度/K物质的起始浓度/mol·L-1物质的平衡浓度/mol·L-1c(H2)c(CO)c(CH3OH) c(CH3OH)Ⅰ400 0.20 0.10 0 0.080Ⅱ500 0 0 0.10 0.025 400 0.40 0.20 0Ⅲ
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
【解析】由Ⅰ、Ⅲ数据知反应开始时,Ⅰ中加入的H2、CO与Ⅲ中加入甲醇的物质的量相当,平衡时甲醇的浓度:Ⅰ>Ⅲ,温度:Ⅰ<Ⅲ,即升高温度平衡逆向移动,该反应正向为放热反应,A项正确;Ⅱ相当于将容器Ⅰ的体积缩小二分之一,该反应正向为气体的物质的量减小的反应,增大压强平衡正向移动,达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小,B项错误;Ⅰ和Ⅱ相比,Ⅱ相当于将容器Ⅰ的体积缩小二分之一,该反应正向为气体的物质的量减小的反应,增大压强平衡正向移动,则Ⅱ中氢气的浓度小于Ⅰ中氢气浓度的2倍,Ⅲ和Ⅰ相比,平衡逆向移动,氢气浓度增大,故达到平衡时,容器Ⅱ中c(H2)小于容器Ⅲ中c(H2)的两倍,C项错误;温度:Ⅲ>Ⅰ,其他条件不变时,升高温度反应速率加快,故达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大,D项正确。
【答案】AD
【解法点睛】融合表格数据进行不同状态下的平衡比对也是历年平衡考查不可或缺的一种命题形式,但2016年的这道高考题更加侧重等效思维和比拟思维的运用,把化学平衡是一种动态平衡考查得活灵活现、出神入化。
命题角度五:融合数据分析考查平衡常数
例5 (2016新课标Ⅲ)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2的化学名称为________。
(2)在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
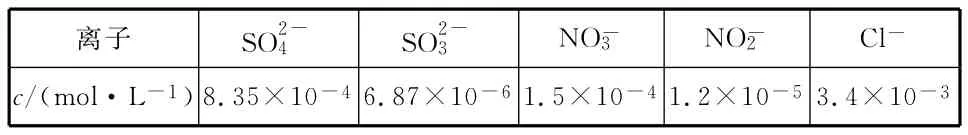
离子 SO2-4 SO2-3 NO-3 NO-2 Clc/(mol·L-1)8.35×10-46.87×10-61.5×10-41.2×10-53.4×10-3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式:________________。增加压强,NO的转化率________(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率________(填“大于”或“小于”)脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是__________________________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压px如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均________(填“增大”“不变”或“减小”)。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是________________________________________________。
②已知下列反应:

则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=_________________。
【解析】本题涉及的考点涉及氧化还原反应、盖斯定律、外界条件对反应速率和平衡状态的影响等多重知识点。
(2)①亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中是将NO转化为NO-3;正反应体积减小,则增加压强,NO的转化率提高。②根据反应的方程式可知,随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐降低。③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化。(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
①由图分析可知,反应温度升高,O2和NO的平衡分压减小,这说明反应向正反应方向进行,因此脱硫、脱硝反应的平衡常数均增大。②根据反应的方程式?可知,平衡常数(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。①由于生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好。②将已知反应依次编号为a,b,c,则根据盖斯定律可知a+b-c即得到反应。
【答案】(1)亚氯酸钠
(4)①生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行 ②ΔH1+ΔH2-ΔH3
【解法点睛】平衡常数是历年高考命题不能缺少的、必考的知识点,解答时紧扣平衡常数的表达式进行逐项分析即可。
通过上述几道高考题目的分析,不难看出高考对于《化学反应速率和平衡》的考查主要以基础题为主,考题紧扣考纲,注重基础,加大了对学生化学能力的考查力度,同时贴近生活生产实际,体现学科能力和素质要求。充分理解化学反应速率和平衡常数的计算、含义、影响因素等基础知识,娴熟掌握基本技能(如审题能力、观察能力、变通能力、融通能力、迁移能力、计算能力等)是高考取胜的前提。
(作者单位:山东省莒县四中)

