JAK/STAT1信号途径在低氧诱导肾小管上皮-间质转化中的作用*
蒲霞,郭庆喜,周鹏飞,曹灵,杨成万,孙兴旺
(1四川医科大学附属医院病理科,四川泸州646000;2眉山市第三人民医院肿瘤科;3四川医科大学附属医院肾病内科)
JAK/STAT1信号途径在低氧诱导肾小管上皮-间质转化中的作用*
蒲霞1,郭庆喜1,周鹏飞2,曹灵3,杨成万1,孙兴旺1
(1四川医科大学附属医院病理科,四川泸州646000;2眉山市第三人民医院肿瘤科;3四川医科大学附属医院肾病内科)
目的:采用低氧培养HKC细胞株,检测HKC STAT 1、α-SMA以及HIF-1α的动态表达,探讨JAK/STAT信号转导途径在低氧诱导的肾小管上皮上皮-间质转化中的作用。方法:将对数生长期HKC随机分为常规培养组(A组),常规+Flu培养组(B组),低氧培养组(C组),低氧+Flu培养组(D组)4组。C组和D组采用三气培养箱低氧培养。分别在实验第1、3、6 d观察细胞形态改变情况,免疫细胞化学检测HIF-1α、α-SMA以及STAT1表达。结果:与A、B组比较,C、D组细胞生长缓慢,随着低氧培养时间的延长,细胞形态变细长,呈梭形。HIF-1α在A、B组表达极低,C、D组表达显著增强(P<0.05),各时间点差异无统计学意义。从第3 d开始C组STAT1、α-SMA表达显著高于A组(P<0.05)。与C组相比,D组各时间点STAT1表达显著降低(P<0.05),α-SMA从第3 d开始表达明显降低(P<0.05)。结论:低氧可能通过JAK/STAT1信号通路诱导肾小管上皮细胞发生表型转化,从而促进肾间质纤维化的发展。
肾小管上皮细胞;EMT;STAT1;低氧;α-SMA
肾间质纤维化(renal interstitial fibrosis,RIF)是各种慢性肾病进展到终末期的共同归路,它是衡量慢性肾脏疾病进展的重要病理指标[1]。RIF形成涉及到细胞、细胞因子和细胞外基质(extracellular matrix, ECM)等多种因素,最终结局是肾间质肌成纤维细胞(myofibroblast,MFB)大量增生和ECM的过度积聚,肾小管上皮细胞-肌成纤维细胞转化(Epithelial-Myofiberoblast transition,EMT)是MFB主要来源之一[2]。研究发现慢性肾病存在组织内缺血、缺氧,其中缺氧可能为慢性肾病进行性发展的重要原因[3]。本实验在低氧条件下培养人近端肾小管上皮细胞,观察肾小管上皮细胞表型转化并探讨可能的机制。
1 材料及方法
1.1 细胞及试剂
人近端肾小管上皮细胞株(HKC)由四川大学华西医学中心药学院何黎黎博士惠赠。胎牛血清和DMEM培养液购于Gibco公司,HEPES和胰蛋白酶购于Sigma公司;注射用磷酸氟达拉滨(Fludarabin, Flu)(国药准字H20059418)购于重庆莱美药业股份有限公司;鼠抗人α-SMA单克隆抗体购于北京中杉金桥生物公司,兔抗人HIF-1α多克隆抗体购于北京博奥森生物技术有限公司,兔抗人STAT1多克隆抗体购于美国Bioword公司,SP免疫组化试剂盒购于北京中杉金桥生物公司。
1.2 细胞培养
采用组织贴壁法培养HKC细胞,以含10%胎牛血清的DMEM培养液,置于常规培养箱(21% O2,5%CO2,37℃)中,每隔2 d更换培养液,当细胞培养至80%~90%融合时,用0.25%的胰酶消化传代。实验用第4代细胞。
1.3 低氧培养
采用三气培养箱进行低氧培养。取对数生长期的HKC,以4×105/mL接种于24孔培养板中,每孔体积1 mL,置于低氧条件(1%O2,5%CO2,37℃)下、低氧培养基(2 mmol/L HEPES,pH 7.5,5%胎牛血清的DMEM)中培养[4],构建HKC缺氧模型。
1.4 实验分组
实验分为常规培养组(A组),常规+Flu培养组(B组),低氧培养组(C组),低氧+Flu培养组(D组)四组,其中A组和B组为常规氧浓度培养组,置于普通培养箱(21%O2,5%CO2,37℃)培养;C组和D组为低氧培养组,置于低氧条件(1%O2,5% CO2,37℃)下培养。B组和D组培养基内含10 nmol/L的Flu。分别于实验开始后第1、3、6 d观察各组细胞形态学改变情况。
1.5 细胞爬片制备
取对数生长期的HKC,调整细胞悬液浓度为4 ×105/mL按ABCD四组分别接种于24孔培养板中,每孔1 mL,各设5个复孔(内置预先经过多聚赖氨酸处理的盖玻片),进行培养。分别于实验开始第1、3、6 d后,取出贴附细胞的盖玻片,PBS冲洗处理后用4%多聚甲醛固定30 min,甩干后进行免疫细胞化学染色。
1.6 免疫细胞化学检测及结果判定
取1.5制备的细胞爬片,按照免疫组化SP试剂盒说明行STAT1、α-SMA和HIF-1α免疫细胞化学染色。同时以PBS代替一抗作阴性对照。随机观察选取10帧图像,采用Image-Pro Plus 4.5(MEDIA CYBERNETICS专业图像分析系统开发公司)软件,分析每帧图像免疫细胞化学染色表达阳性细胞的平均光密度(mean optical density,MOD)值,求得各组各时间点相应指标表达阳性细胞的MOD值的均值。
1.7 统计学分析
2 结果
2.1 低氧培养的HKC形态学改变
实验开始后的第1天,各组细胞形态没有明显差异。与A组比较,C组的HKC生长缓慢。随着培养时间的延长,与A组HKC典型的铺路石状的生长相比,B组HKC生长没有明显的改变;C组的HKC生长排列较为紊乱,部分细胞显现出梭形生长趋势;D组细胞形态梭形性变化趋势降低,细胞生长排列较之C组整齐(图1)。
2.2 HIF-1α免疫细胞化学染色结果
HIF-1α阳性为HKC细胞胞核呈棕黄色。常规条件培养的HKC几乎不表达HIF-1α,自低氧培养的第1 d起HKC HIF-1α表达明显增高(P<0.05);随着低氧培养时间延长,HIF-1α表达略有增高(表1、图1)。
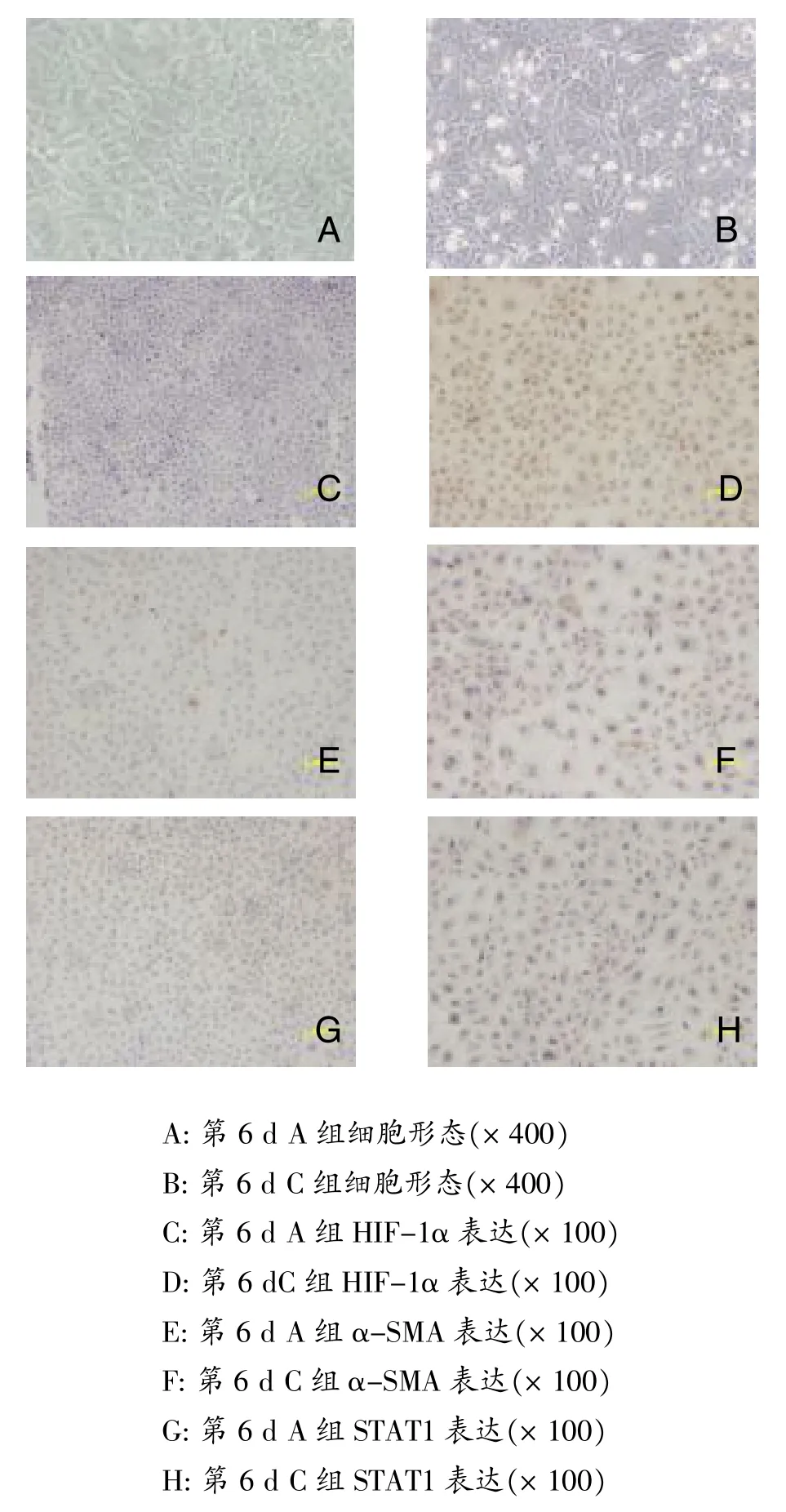
图1 HKC细胞形态及免疫表型
表1 各组各时间点HIF-1α表达阳性MOD值结果(±s)
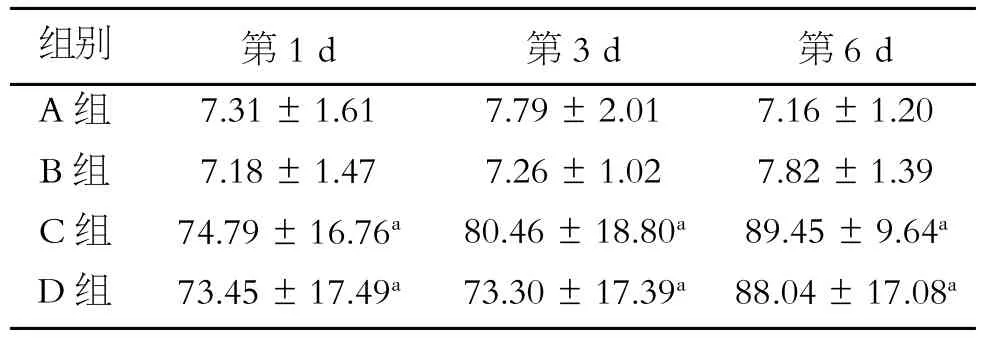
表1 各组各时间点HIF-1α表达阳性MOD值结果(±s)
注:与A组同一时间点比较,a.P<0.05
组别A组B组C组D组第1 d 7.31±1.61 7.18±1.47 74.79±16.76a73.45±17.49a第3 d 7.79±2.01 7.26±1.02 80.46±18.80a73.30±17.39a第6 d 7.16±1.20 7.82±1.39 89.45±9.64a88.04±17.08a
2.3 α-SMA免疫细胞化学染色结果
α-SMA阳性表达为胞质中的棕黄色颗粒。A、B组细胞α-SMA表达低。C组细胞从第3 d开始α-SMA表达较A组明显增高(P<0.05),且随缺氧时间延长表达增高(P<0.05)。与C组相比,D组第1 d α-SMA表达略有降低,第3 d和第6 d α-SMA表达显著降低(P<0.05,见表2、图1)。
表2 各组各时间点α-SMA表达阳性MOD值结果(±s)
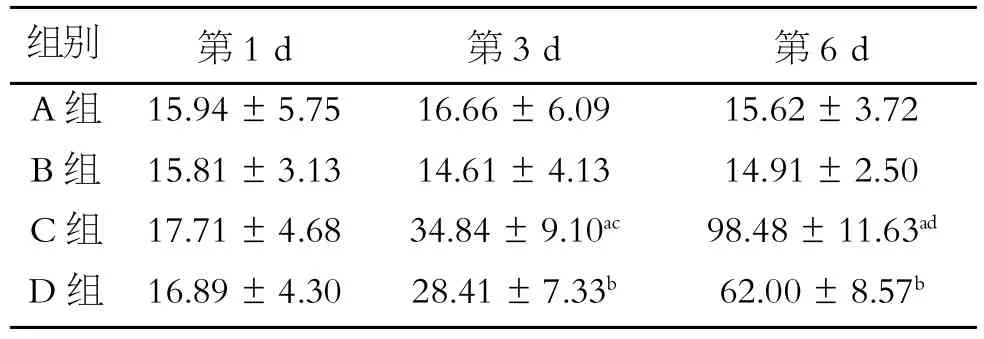
表2 各组各时间点α-SMA表达阳性MOD值结果(±s)
注:与A组同一时间点比较,a.P<0.05;与C组同一时间点比较,b.P<0.05;与C组第1 d比较,c.P<0.05;与C组第3 d比较,d.P<0.05
组别A组B组C组D组第1 d 15.94±5.75 15.81±3.13 17.71±4.68 16.89±4.30第3 d 16.66±6.09 14.61±4.13 34.84±9.10ac28.41±7.33b第6 d 15.62±3.72 14.91±2.50 98.48±11.63ad62.00±8.57b
2.4 STAT1免疫细胞化学染色结果
STAT1阳性表达为胞质中的棕黄色颗粒。与A组相比,从第3 d开始B组表达降低,差异有统计学意义(P<0.05);第3 d起C组STAT1表达较A组明显增高(P<0.05),且随缺氧时间延长呈增高趋势;D组各时间点较C组STAT1表达明显降低(P<0.05)(表3、图1)。
表3 各组各时间点STAT1表达阳性MOD值结果(±s)
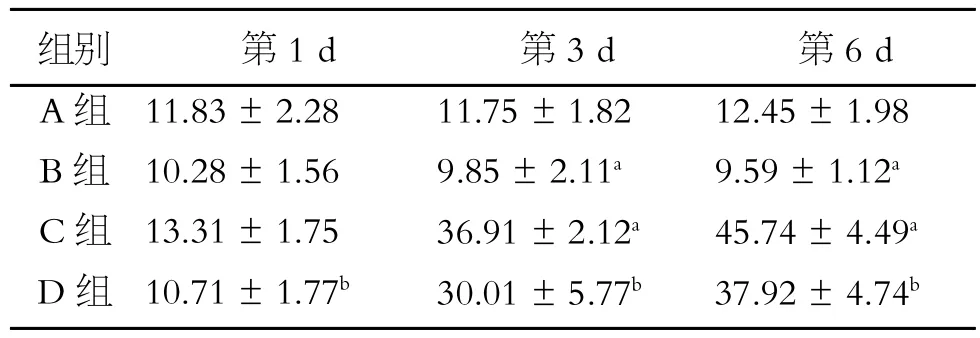
表3 各组各时间点STAT1表达阳性MOD值结果(±s)
注:与A组同一时间点比较,a.P<0.05;与C组同一时间点比较,b.P<0.05
组别A组B组C组D组第1 d 11.83±2.28 10.28±1.56 13.31±1.75 10.71±1.77b第3 d 11.75±1.82 9.85±2.11a36.91±2.12a30.01±5.77b第6 d 12.45±1.98 9.59±1.12a45.74±4.49a37.92±4.74b
3 讨论
HIF(hypoxic inducible factor,HIF)是迄今为止发现的惟一在低氧状态下发挥活性的特异性转录因子。体外研究显示,HIF-1α在供氧正常的细胞中不表达,而在低氧培养的细胞胞核内的表达显著上调[4]。本研究拟采用三气培养箱构建HKC缺氧模型,通过细胞形态观察,免疫细胞化学检测HIF-1α的表达情况,作为评判细胞是否处于低氧状态的指标。本实验在常规氧浓度培养HKC HIF-1α表达极低,而低氧培养时表达增高,差异有统计学意义(P<0.01)。实验开始后的第1 d,各组细胞形态没有明显差异。随着培养时间延长,低氧培养的HKC在第3天开始出现不规则生长的趋势,部分细胞呈梭形,具有向MFB转化的特征。同时,α-SMA作为HKC向MFB转化的重要标志,在本实验常规培养的HKC中表达低,而低氧培养的HKC第3 d起表达明显增加(P<0.01),且随着缺氧时间延长,α-SMA表达逐渐增加,与Manotham等[4]的研究结果一致,表明本实验采用三气培养箱成功构建HKC低氧转分化模型。
JAK/STAT信号转导通路是一条生长因子和细胞因子共用的信号转导级联,广泛参与细胞的活化、增殖、分化、凋亡以及免疫调节等过程[5-6]。JAKs蛋白家族属于非受体型酪氨酸蛋白激酶,目前知道的有四个成员:JAK 1、JAK 2、JAK 3和TYK2。STATs是JAKs的下游底物[7],广泛分布于多种类型的组织和细胞,目前发现该家族包括STAT1~STAT4、STAT 5a、STAT 5b、STAT 6七个成员。研究发现JAK/STAT途径在多种组织和器官(肾脏、肝脏、肺、胰腺、心脏及骨髓等)纤维化进程中都发挥重要作用[8-10]。STAT1(signal transducer and activator of transcription 1)是STAT家族发现的第一个成员。JAK激酶活化后催化细胞因子受体磷酸化,形成与STAT1结合的“停泊位点”(docking site)[11]。STAT1通过其SH2结构域与活化的受体结合而发生磷酸化,磷酸化的STAT1形成同/异二聚体并进入细胞核,与相应的靶基因启动子区域结合而激活相应基因的转录,参与细胞生长、分化及免疫调节等生理反应,并参与多种器官纤维化过程,研究发现JAK/STAT1通路参与博莱霉素诱导的肺纤维化[12]。Ma等[13]也在研究中发现肺纤维化组织中存在着JAK、STAT1和STAT3的过度表达。谢庆祥等[14]研究发现STAT1活性增强与梗阻性肾病的病理生理过程有关,特别在肾纤维化过程中发挥重要作用。氟达拉滨是一种嘌呤碱类似物,在体内可脱去磷酸代谢为F-ara-A,并主动转运至细胞内,通过抑制核酸还原酶、DNA聚合酶、DNA连接酶等机制抑制DNA的合成。近年来有研究发现它对STAT1的表达有特异性抑制作用[15]。在本研究中,低氧浓度培养第3天起HKC STAT1的表达高于常规氧浓度组(P<0.01),同时α-SMA表达水平也明显增加。加入氟达拉滨干预后,STAT1表达水平降低,在同一时间点α-SMA表达水平也降低,这种变化可以被STAT1特异性抑制剂氟达拉滨持续抑制,推测STAT1在体外低氧诱导的HKC转分化中发挥了重要作用,提示JAK/STAT1信号转导通路可能参与了体外低氧诱导的HKC转分化过程,为缺氧在慢性肾病及肾间质纤维化过程中的作用机制提供一定的理论依据。
1.Negri AL.Prevention of progressive fibrosis in chronic renal diseases:antifibrotic agents[J].J Nephrol,2004,17(4): 496-503.
2.Kalluri R,Neilson EG.Epithelial-mesenchymal transition and its implications for fibrosis[J].J Clin Invest,2003,112 (12):1776-1784.
3.Fine L G,Norman J T.Chronic hypoxia as a mechanism of progression of chronic kidney diseases:from hypothesis to noveltherapeutics[J].Kidney international,2008,74 (7):867-872.
4.Manotham K,Tanaka T,Matsumoto M,et al.Transdifferentiation of cultured tubular cells induced by hypoxia[J]. Kidney Int,2004(65):871-880.
5.Jatiani SS,Baker SJ,Silverman LR,et al.JAK/STAT pathways in cytokine signaling and myeloproliferative disorders:Approaches for targeted therapies[J].Genes Cancer, 2010(1):979-993.
6.Fossett N.Signal transduction pathways,intrinsic regulators,and the control of cell fate choice[J].Biochim Biophys Acta,2013,1830(2):2375-2384.
7.Swiatek Machado K,Kaminska B.STAT signaling in glioma cells[J].Adv Exp Med Biol,2013(986):189-208.
8.Matsui F,Meldrum KK.The role of the Janus kinase family/signal transducer and activator of transcription signaling pathway in fibrotic renal disease[J].J Surg Res,2012(178): 339-345.
9.Mehta PK,Griendling KK.AngiotensinⅡcell signaling: physiological and pathological effects in the cardiovascularsystem[J].Am J Physiol Cell Physiol,2007(292):C82-C97.
10.Hoermann G,CernyReiterer S,Herrmann H,et al.Identication of oncostatin M as a JAK2 V617F-dependent amplifier of cytokine production and bone marrow remodeling in myeloproliferative neoplasms[J].FASEB J,2012(26):894-906.
11.Arbouzova NI,Zeidler MP.JAK/STAT signaling in Drosophila:insights into conserved regulatory and cellular functions[J].Development,2006,133(14):2605-2616.
12.刘金苹,翟乃亮,范贤明,等.JAK/STAT1信号通路在博莱霉素致肺纤维化大鼠中的作用[J].山东医药,2008, 48:4-6.
13.Ma X,ChenR,Liu X,et al.Effects of matrine on JAKSTAT signaling transduction pathways in bleomycin-induced pulmonaryfibrosis[J].Afr J Tradit Complement Altern Med,2013(10):442-448.
14.谢庆祥,韩聪祥,林吓聪,等.STAT1在梗阻性肾组织中表达及与肾纤维化之间关系的研究[J].中国医学工程,2009, 3(17):197-198,201.
15.Frank DA,Mahajan S,Ritz J.Fludarabine-induced immunosup-pression is associated with inhibition of STAT1 signaling[J].Nat Med,1999(5):444-447.
(2015-10-27收稿)
Role of JAK/STAT1 signaling pathway in hypoxia-induced tubular epithelial-mesenchymal transition
Pu Xia1,Guo Qingxi1,Zhou Pengfei2,Cao Ling3,Yang Chengwan1,Sun Xingwang1
1Department of Pathology,the Affiliated Hospital of Sichuan Medical University,Luzhou 646000,Sichuan Province,China;2Department of Oncology,the Meishang Third People,s Hospital;3Department of Nephrology,the Affiliated Hospital of Sichuan Medical University
Objective:To observe the expression of HIF-1α、α-SMA,and STAT1 in the human kidney proximal epithelial cell(HKC)under the condition of hypoxia and to investigate the effect of JAK/STAT signaling pathway on EMT induced by hypoxia.Methods:Use a tri-gas incubator to build the model of EMT induced by hypoxia.The cells in exponential phase were divided into four groups randomly.They are routine culture(group A),routine culture+Flu(group B),hypoxia culture(group C),and hypoxia culture+Flu(group D).The morphology of cells weas observed under microscope and the expression of α-SMA,STAT1 and HIF-1α was evaluated by immunohistochemistry on day 1,3,and 6.Results:Cells grow slower in groups C and D compared to groups A and B under hypoxia.As time goes by,cells under hypoxia become heterogeneous in morphology,showing spindle-shaped.The expression of HIF-1α is increased in group C and group D compared to cells cultured in routine incubator in groups A and B,which hardly express HIF-1 α.Compared with the group A,cells in group C express much more STAT1 and α-SMA(P<0.05)on day 3 and 6.Compared with the group C,cells in group D express lower levels of STAT1(P<0.05)and α-SMA(P<0.05)at each time point on day 3 and 6.Conclusion:The JAK/STAT1 signaling pathway may participate in the process of EMT of HKC induced by hypoxia and thus play an important role in the process of renal interstitial fibrosis.
HKC;EMT;STAT1;Hypoxia;α-SMA
R692.6;R-33
A
10.3969/j.issn.1000-2669.2016.01.005
四川省科技厅重点项目(2010JY0080)]
蒲霞(1979-),女,讲师,硕士
孙兴旺(1965-),男,教授。E-mail:lzsunxw@163.com

