二肽基肽酶-IV介导内皮间质转化在糖尿病肾纤维化过程中的作用及机制研究*
宋丽,孙玉红,施森
(1四川医科大学附属第一医院麻醉科;2药理学教研室;3附属医院血管外科,四川泸州646000)
论著
二肽基肽酶-IV介导内皮间质转化在糖尿病肾纤维化过程中的作用及机制研究*
宋丽1,孙玉红2,施森3
(1四川医科大学附属第一医院麻醉科;2药理学教研室;3附属医院血管外科,四川泸州646000)
目的:探讨二肽基肽酶-IV在糖尿病肾纤维化中的作用及机制。方法:动物实验中建立糖尿病CD-1小鼠慢性肾纤维化模型,予以二肽基肽酶-IV抑制剂干预4周后,检测正常组、糖尿病组及干预组中肾脏组织中二肽基肽酶-IV的表达及内皮间质转化的变化。细胞实验中培养人微血管内皮细胞,分别予以TGFβ2及二肽基肽酶-IV抑制剂或siRNA干预,观察各组中二肽基肽酶-IV、内皮间质转化及TGFβ/smad信号通路的变化。结果:与正常小鼠相比,糖尿病小鼠肾组织表现出明显纤维化改变、高表达的二肽基肽酶-IV以及明显增强的内皮间质转化;二肽基肽酶-IV抑制剂干预后肾纤维化及内皮间质转化明显缓解及抑制。细胞实验中,二肽基肽酶-IV抑制剂或siRNA能明显降低TGFβ2诱导的内皮间质转化及TGFβ/smad信号通路。结论:二肽基肽酶-IV抑制剂能通过抑制内皮细胞间质转化来改善糖尿病肾纤维化。
二肽基肽酶-IV;糖尿病肾纤维化;内皮间质转化
肾脏纤维化是肾脏疾病发展过程中的最终通路,导致肾脏结构和功能恶化肾脏过滤功能的破坏[1]。肾纤维化是由长期的损伤与细胞外基质的过度积累所导致的正常的伤口愈合过程失调而引起。在纤维化过程中,肾成纤维细胞中发挥重要的作用,但对成纤维细胞的来源及机制尚不清楚[2]。最新研究发现在基质生产的成纤维细胞的起源中,内皮细胞间质转型(endothelial-to-mesenchymal transition,EndoMT)是肌成纤维细胞或活化的成纤维细胞的一个重要来源,EndoMT显著性标志是是由CD31和血管内皮钙黏蛋白(VE-cadherin)等血管内皮细胞标记物的丢失和以及α-平滑肌肌动蛋白等间充质蛋白的表达增加。研究表明EndoMT参与异常的心室壁收缩能力及心电所导致的心纤维化[3]。EndoMT也参与了肺纤维化,特发性高血压,角膜纤维化[4-5]。许多生长因子和信号通路支配调节EndoMT在胚胎心脏和心肌的纤维化中的作用。有研究发现EndoMT也参与早期肾脏纤维化[6],2008年zeisberge等首次在小鼠模型上证实EndoMT在肾纤维化中的重要作用[7]。关于其作用机制研究众多,目前普遍认为TGFβ信号通路起到重要作用[8]。
二肽基肽酶-IV(DPP-IV)是T细胞活化CD26抗原,它广泛分布于人体器官及组织。DPP-IV能选择性地切割内源性胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)的脯氨酸或丙氨酸,从而降低血糖。由于其分布的广泛及多效性的作用,DPP-IV抑制剂的使用也能潜在的保护器官,而肾脏是DPP-IV表达最高的器官之一[9]。研究表明,DPP-IV抑制剂能通过抑制TGFβ/smad信号通路改善心衰[10]。
DPP-IV抑制剂是否能通过TGFβ通路改善糖尿病小鼠肾纤维化目前鲜有报道。我们利用糖尿病小鼠慢性肾纤维化模型来设计本实验探讨DPP-IV抑制剂是否能通过抑制TGFβ/smad信号通路介导EndoMT从而改善糖尿病肾纤维化。
1 材料与方法
1.1 1型糖尿病模型
8周CD1雄性小鼠随机分为两组,实验组腹腔注射链脲佐菌素(STZ)200 mg/kg,STZ溶解于pH 4.4的枸橼酸钠缓冲液中,对照组注射注射用水。3 d后检测血糖,高于300 mg/dL确定造模成功。正常饮食饲养小鼠至干预。
1.2 DPP-IV抑制剂干预
STZ注射20周后,糖尿病小鼠随机分为糖尿病组和干预组,干预组以DPP-IV抑制剂KR-62436(Sigma)10 mg/kg/day溶于饮用水中。糖尿病组正常饮食。
1.3 标本收集
(1)实验中定时监测血糖、体重变化。干预4周后收集尿液,眼球取血后,取肾组织,分别制成冰冻切片、石蜡切片及部分组织-70℃保存。
(2)测各组尿素、肌酐等肾功能情况。
(3)免疫荧光检测FSP-1/CD31及α-SMA/CD31,双染阳性提示处于内皮间质转化的内皮细胞。
(4)western blot检测FSP-1、α-SMA、CD31、DPP-IV。
1.4 细胞实验
1.4.1 细胞培养
人微血管内皮细胞接种于6孔板后,孵育于EGM-2培养液,待细胞融合至70%时予以干预。具体分为3组:对照组,TGF β2(5 ng/mL)组,TGFβ2+ KR-62436(5.7 μM)组。
1.4.2 DPP-IV siRNA转染
培养好的人微血管内皮细胞分为3组:对照组,TGFβ2组,TGFβ2+DPP-IV siRNA。其中对照组及TGFβ2组细胞转入对照空白siRNA,TGFβ2+DPPIV siRNA组转入DPP-IV siRNA(ATCGGGAAGTGGCGTGTTCAA),转染前2 h更换无血清无双抗1640培养液。用无血清无双抗1640培养液稀释siRNA和转染试剂lipofectamineTM 2000(Invitrogen,USA),将稀释液混合,形成siRNA-转染试剂复合物,将其加入细胞中,siRNA终浓度为100 nmol/L,6 h后更换为正常培养液,24 h后TGFβ2组及TGFβ2+DPPIV siRNA组予以TGFβ2(5 ng/ml)刺激。
1.4.3 内皮细胞间质转型及DPP-IV检测
48 h后提取蛋白,western blot检测FSP-1、α-平滑肌细胞肌动蛋白(α-SMA)、CD31、DPP-IV、smad-3、phospho-smad 3。
1.4.4 迁移实验
将上述各组细胞置于迁移小室,观察48 h后各组细胞迁移情况。
2 结果
2.1 小鼠模型
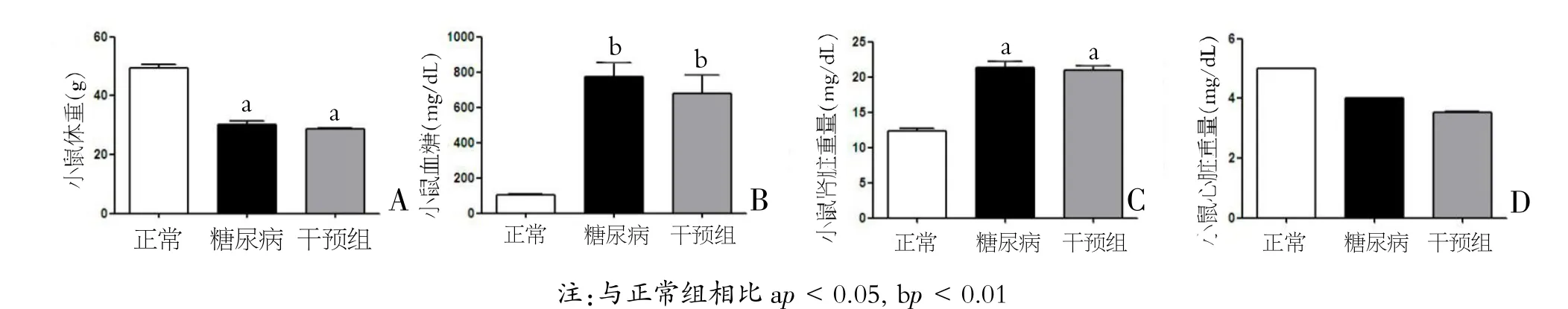
图1 DPP-IV抑制剂KR-62436干预后小鼠的体重、血糖、心脏及肾脏重量变化
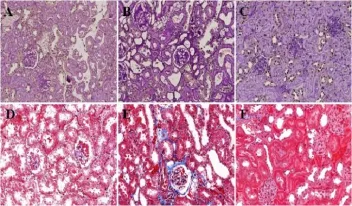
图2 DPP-IV抑制剂KR-62436干预后小鼠肾脏组织学染色及蛋白肌酐比值
与对照组相比,糖尿病小鼠体重明显降低,血糖显著升高,肾脏和肝脏重量明显增加。与糖尿病小鼠相比,KR-62436干预后,体重、血糖水平及器官重量(肾,肝,和心脏)均无明显变化(见图1A-D)。与对照组小鼠比较,STZ诱导20周后糖尿病小鼠表现出严重纤维化(肾小球明显增大,间质系膜扩张,相对纤维化面积扩张、尿微量白蛋白水平及血肌酐升高)。而KR-62436治疗的糖尿病的小鼠恢复正常的肾脏组织学结构及尿微量蛋白水平降低(见图2A-F、图3)。
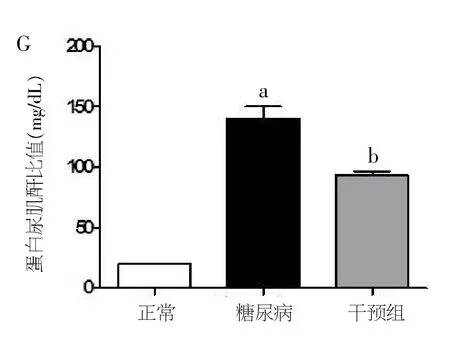
图3 小鼠蛋白尿肌酐比值图
2.2 肾组织免疫荧光及Western blot结果
通过定量分析免疫荧光中共同表达血管内皮标记CD31和间充质标记α-SMA的细胞,糖尿病小鼠肾组织中EndoMT过程的细胞数比正常小鼠肾脏明显增多(见图4 A-C)。KR-62436治疗后双染阳性细胞则显著减少。Western blot也提示与正常肾组织比较,糖尿病小鼠肾组织中DPP-IV、α-SMA、FSP1蛋白表达增加,而CD31则低于正常小鼠。与糖尿病小鼠相比较,KR-62436处理后DPP-IV、α-SMA、FSP1蛋白表达降低,CD31表达增加。这一结果表明糖尿病肾脏中EndoMT明显强于正常小鼠肾脏,而DPPIV抑制剂能抑制EndoMT。
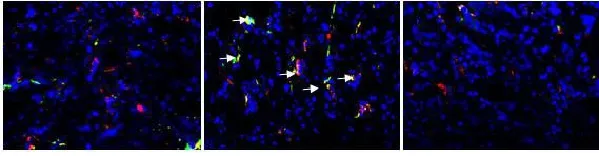
图4 EndoMT在糖尿病肾组织中的表达
2.3 细胞实验结果
HMVEC培养48 h后,与正常组培养相比较,TGFβ2干扰组中,α-SMA、DPP-IV、smad-3及phospho–smad 3蛋白水平明显增高,KR-62436组蛋白明显抑制上述蛋白表达。同时我们也可以观察到KR-62436能显著提高被TGF β2抑制的CD 31表达。
2.4 细胞转染实验结果
细胞转染DPP-IV siRNA后,DPP-IV水平明显抑制,α-SMA、TGFβR1及TGFβR 2也明显降低,而CD 31水平则增加。这表明DPP 4在EndoMT中起着重要作用,而且该作用与TGF/smad信号通路相关。在细胞迁徙试验中可以看到,TGF β2干预下迁移细胞较正常组明显增加,而DPP-IVsiRNA转染后可减少迁移细胞(见图5 A-D)。
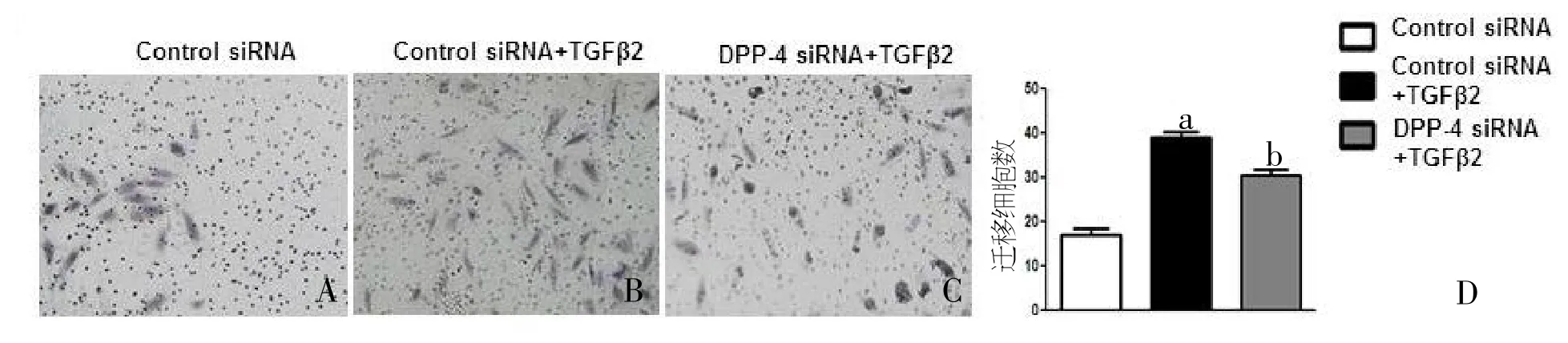
图5 DPP-IV抑制剂或siRNA转染后人微血管内皮细胞中细胞迁移变化
3 讨论
糖尿病肾病是目前全世界非常严重及发病率较高的疾病之一,可发展成终末期肾脏病,最终需要肾替代疗法。肾脏纤维化的程度决定残余肾功能,因此抑制肾纤维化和恢复肾的正常结构是研究包括糖尿病肾病在内的慢性肾脏疾病的治疗目标。
研究表明肾成纤维细胞是EndoMT的重要来源之一,在肾纤维化中占着重要作用[11]。本实验发现DPP-IV抑制剂KR-62436是抑制成纤维细胞活化过程的一个有效的治疗方案。肾组织DPP-IV表达最高的器官之一,而DPP-IV抑制剂的使用也能潜在的保护器官[12],本研究也发现,与未干预糖尿病小鼠相比较,我们发现,糖尿病小鼠肾脏DPP-IV蛋白表达明显增加,免疫组化揭示DPP-IV强表达于肾脏系膜,内皮细胞,肾小管小管。研究发现DPP-IV抑制剂维格列汀给药24周能防止STZ诱导的雄性SD糖尿病大鼠肾脏损伤[13]。本实验利用STZ诱导的一型糖尿病CD1小鼠模型检测糖尿病诱导20周后KR-62436干预是否能改善肾脏纤维化。我们发现,这种干预在不改变血糖体重等生理基础的前提下能显著改善肾纤维化,这说明以DPP-IV为靶向治疗糖尿病肾脏是有治疗价值的。本实验免疫组化结果表明与糖尿病小鼠相比较,DPP-IV抑制剂KR-62436治疗的糖尿病的小鼠肾脏组织学结构明显改善,尿微量蛋白水平也明显降低。DPP-IV抑制剂可通过抑制TGF-β/Smad信号来改善心脏功能,而本实验也证实DPP-IV抑制剂能抑制TGF-β/Smad信号,这也是其在内皮间质转型中的可能机制。目前对EndoMT和体内多种疾病关系的研究越来越受到人们关注,对调控EndoMT的作用机制进行了多方向多层面的探讨,未来对内皮间质转化过程更全面更深入的认识将有助于为解决多种疾病提供更加有效的诊疗措施。
1.Hu C,Sun L,Han Y,et al.Insights into the mechanisms involved in the expression and regulation of extracellular matrix proteins in diabetic nephropathy[J].Curr.Med. Chem,2015(22):2858-2870.
2.Zeisberg M,Neilson EG.Mechanisms of tubulointerstitial fibrosis[J].J Amer Soc.Nephrol,2010(21):1819-1834.
3.Liu Y,Hu ZF,Liao HH,et al.Toll-like receptor 5 deficiency attenuates interstitial cardiac fibrosis and dysfunction induced by pressure overload by inhibiting inflammation and the endothelial-mesenchymal transition[J].Biochim Biophys Acta,2015(1852):2456-66
4.Choi SH,Hong ZY,Nam JK,et al.A hypoxia-induced vascular endothelial-to-mesenchymal transition in development of radiation-induced pulmonary fibrosis[J].Clin Cancer Res,2015(21):3716-26
5.Roy O,Leclerc VB,Bourget JM,et al.Understanding the process of corneal endothelial morphological change in vitro[J].Invest Ophthalmol Vis Sci,2015(56):1228-37.
6.Kanasaki K,Kitada M,Koya D.Pathophysiology of the aging kidney and therapeutic Interventions[J].Hypertens Res,2012(35):1121-1128.
7.Zeisberg EM,Tarnavski O,Zeisberg M,et al.Endothelial-to-mesenchymal transition contributes to cardiac fibrosis[J].Nat Med,2007(13):952-961.
8.He J,Xu Y,Koya D,et al.Role of the endothelial-tomesenchymal transition in renal fibrosis of chronic kidney disease[J].Clin Exp Nephrol,2013(17):488-497.
9.Scheen AJ.Pharmacokinetics of dipeptidylpeptidase-4 inhibitors[J].Diabetes,obesity&metabolism,2010(12):648-658.
10.Takahashi A,Asakura M,Ito S,et al.Dipeptidyl-peptidase IV inhibition improves pathophysiology of heart failure and increases survival rate in pressure-overloaded mice[J].Am J Physiol Heart Circ Physiol,2013(304):H1361-1369.
11.LeBleu VS,Taduri G,O'Connell J,et al.Origin and function of myofibroblasts in kidney fibrosis[J].Nat Med, 2013(19):1047-1053.
12.Bromage DI,Davidson SM,Yellon DM.Stromal derived factor 1α:a chemokine that delivers a two-pronged defence of the myocardium[J].Pharmacol Ther,2014(143): 305-15.
13.Liu WJ,Xie SH,Liu YN,et al.Dipeptidyl peptidase IV inhibitor attenuates kidney injury in streptozotocin-induced diabetic rats[J].The Journal of pharmacology and experimental therapeutics,2012(340):248-255.
(2015-10-27收稿)
Effect and mechanisms of dipeptidyl peptidase-IV on endothelial-to-mesenchymal transition in diabetic kidney fibrosis
Song Li1,Sun Yuhong2,Shi Sen3
1Deparment of Anesthesiology,the Affiliated Hospital of Sichuan Medical University,2Department of Pharmacy, Sichuan Medical University;3Deparment of Vascular Surgery,the Affiliated Hospital of Sichuan Medical University, Luhzou 646000,Sichuan Province,China
Objective:To analyze the roles and mechanisms of dipeptidyl peptidase-IV(DPP-IV)on endothelial-to-mesenchymal transition in diabetic kidney fibrosis.Methods:Diabetic CD1 mice were used as chronic diabetic kidney fibrosis model.Mice were treated with or without DPP-IV inhibitor for 4 weeks,kidney samples from each groups were used to analyze the pathological changes,DPP-IV protein levels,and endothelialto-mesenchymal transition.In vitro,human microvascular endothelial cells were stimulated with or without TGFβ2,and after treatment with DPP-IV inhibitor or siRNA,cell migration,DPP-IV protein levels,endothelialto-mesenchymal transition,and TGFβ/smad signaling were analyzed.Results:Diabetic CD-1 mice exhibited significant kidney fibrosis and high levels of DPP-IV expression when compared with control mice.DPP-IV inhibitor-treated diabetic mice exhibited a suppression of DPP-IV protein expression and an amelioration of kidney fibrosis associated with the inhibition of EndoMT.In cultured endothelial cells,we found that DPP-IV inhibitor inhibited TGFβ2-induced EndoMT and TGFβ/Smad signaling.Conclusion:DPP-IV inhibitor can ameliorate kidney fibrosis by suppressing EndoMT and TGFβ/Smad signaling.
Dipeptidyl peptidase-IV;Diabetic kidney fibrosis;Endothelial-to-mesenchymal transition
R587.1;R-33
A
10.3969/j.issn.1000-2669.2016.01.002
国家自然科学基金项目(81500643)
宋丽(1980-),女,硕士,讲师
施森(1980-),男,硕士,副主任医师。E-mail:shisen80@163.com

