辣椒素对浸水-束缚应激大鼠胃动力作用及机制研究*
李泽培,唐川康,史孝敏,彭燕
(四川医科大学第一附属医院消化内科,四川泸州646000)
辣椒素对浸水-束缚应激大鼠胃动力作用及机制研究*
李泽培,唐川康,史孝敏,彭燕
(四川医科大学第一附属医院消化内科,四川泸州646000)
目的:研究辣椒素(CAP)对浸水束缚应激(模型)导致的大鼠胃动力障碍的作用及其机制。方法:选取雄性SPF级SD大鼠40只随机均分为对照组、模型组、模型组+CAP组和CAP组4组,每组10只。采用浸水束缚应激法建立胃动力障碍大鼠模型,胃管注入CAP 1 mg/g,连续4周。实验末测定大鼠胃酚红排空率,并取胃窦组织用RT-PCR方法检测c-kit mRNA、SCF mRNA的转录水平。结果:①胃酚红排空率:CAP组胃酚红排空率显著高于对照组和模型组(P<0.05),模型组+CAP组、对照组胃酚红排空率显著高于模型组(P<0.05);②c-kit mRNA、SCF mRNA的转录水平:模型组c-kit mRNA转录水平显著低于对照组,CAP组c-kit mRNA转录水平显著高于模型组(P<0.05);模型+CAP组、CAP组SCF mRNA转录水平显著高于对照组和模型组(P<0.05),对照组SCF mRNA转录水平显著高于模型组(P<0.05)。结论:小剂量CAP 4周可促进正常大鼠及模型大鼠胃动力,其机制可能与CAP调节SCF的表达有关,但与c-kit、Cajal间质细胞的相关性尚不明确。
辣椒素;胃动力;Cajal间质细胞;c-kit;SCF
Key wordsCapsaicin;Gastric motility;Interstitial cells of Cajal;C-kit;SCF.
胃肠动力障碍性疾病(disorders of gastrointestinal motility,DGIM)的发病率逐年上升,目前已成为消化系统中发病率最高,最缺少治疗手段的疾病之一。辣椒素(capsaicin,CAP)是红辣椒中的主要活性成分,其化学名称为反8-甲基-N-香草基-6-壬烯基酰胺,近年CAP对胃肠动力的作用已引学者重视。大量研究显示适量的CAP对胃肠动力具有促进作用[1-3],CAP对胃肠动力的作用机制目前尚不清楚。本实验通过研究CAP对水浸-束缚应激(water immersionrestraint stress,WIRS)模型大鼠胃酚红排空率的影响,以及胃窦组织c-kit和SCF mRNA的转录水平,探讨CAP对大鼠胃动力的作用及可能机制。
1 材料与方法
1.1 实验动物
成年雄性SPF级SD大鼠40只,体重180~250 g(泸州医学院动物实验中心提供)。
1.2 主要试剂及仪器主要试剂
95%的辣椒素(河南倍特生物技术有限公司),酚红(国药集团化学试剂有限公司),总RNA提取试剂盒(Trizol试剂盒)(北京TIANGEN),RT-PCR试剂盒(成都博瑞克生物技术有限公司),DNA Maker(北京TIANGE),琼脂糖法国(BIOWEST公司);主要实验仪器:低温高速离心机(美国Thermo公司),紫外分光光度仪(SHIMADZU公司),电子分析天平(Mettler公司),-70℃超低温冰箱(美国Thermo公司),水平电泳仪(美国Bio-Rad公司),PCR扩增仪(杭州博日公司),凝胶成像系统(美国Bio-Rad公司),全波长分光光度计(美国Thermo公司)。
1.3 实验方法
1.3.1 CAP饲料的配制方法
精确称取95%的CAP 105.3 mg(含CAP 100 mg),完全溶解于30 mL的食用油(金龙鱼)中,再加入食用面粉100 g,混匀,所得即为CAP含量1 mg/g的饲料。
1.3.2 造模方法及验证
1.3.2.1 模型组每日上午进行造模
将大鼠四肢束缚固定于鼠板上,然后将鼠板垂直浸入(19±1)℃水中,水面平胸骨剑突,持续1 h。造模结束后大鼠自由摄食进水,连续4周。正常组自由摄食进水,连续4周。
1.3.2.2 4周后测定大鼠胃酚红排空率
在20 mL的大鼠胃内容物中加入20 mL浓度为0.5 mol/L的NaOH搅拌混匀。取5 mL上清液,加入0.5 mL浓度为20%的三氯乙酸去蛋白离心10 min。取上清液,用分光光度计测在560 nm波长下待测液的吸光度值,为实测酚红吸光度。另取2 mL酚红溶液,先后加入18 mL蒸馏水、20 mL浓度为0.5 mol/L的NaOH、4 mL浓度为20%的三氯乙酸搅拌混匀,用分光光度计测在560 nm波长下测标准液的吸光度值,为标准酚红吸光度。大鼠的胃酚红排空率=(1—实测酚红吸光度/标准酚红吸光度)×100%。
1.3.3 实验分组及CAP干预实验
SD大鼠40只,体重180~250 g,用代谢笼饲养,温度(24±1)℃,通风良好,随机分为4组,每组10只。即:
A组(对照组):自由摄食进水,连续4周;
B组(模型组):每日模型1 h,模型结束后自由摄食进水,连续4周;
C组(模型组+CAP组):每日模型1 h,模型结束后胃管注入CAP饲料(CAP含量为1 mg/g)5 g/ kg/只,待CAP饲料食用完后,再给予普通饲料喂养,连续4周;
D组(CAP组):每日胃管注入CAP饲料(CAP含量为1 mg/g)5 g/kg/只,待CAP饲料食用完后,再给予普通饲料喂养,连续4周。
1.3.4 标本采集
4周后所有大鼠禁食24 h,于次日早晨给予浓度为50 mg/dL的酚红溶液2 mL/鼠灌胃。灌入酚红溶液30 min后处死大鼠。将贲门与幽门结扎,取出鼠胃沿胃大弯侧剪开,用蒸馏水将胃内容物冲洗到器皿中定容为20 mL,用于测定酚红排空率。取胃窦组织存于-70℃超低温冰箱,用RT-PCR方法检测c-kit mRNA及SCF mRNA的转录水平。
1.3.5 检测指标和方法
1.3.5.1 大鼠胃酚红排空率的测定
同1.3.2.2,1.3.5.2 RT-PCR检测c-kit mRNA及SCF mRNA的转录水平。
1.3.5.2 组织总RNA的提取
取100 mg大鼠胃窦组织,加入1 mL裂解液RZ,液氮研磨;后依次加入氯仿,无水乙醇进行RNA沉淀,经洗涤后加入RNase-free ddH2O溶解RNA沉淀,测其浓度及纯度备用。
1.3.5.3 RT-PCR反应及琼脂糖电泳检测
每个标本的RNA用Rnase free H2O配成相同浓度,按RT试剂盒说明书合成cDNA,以此为模板进行RT-PCR反应。反应条件为:94℃5 min,94℃30 s,退火温度30 s,72℃1 min,72℃1 min,30个循环(其中GAPDH、c-kit、SCF退火温度分别为57.3℃、56.2℃、53.0℃)。根据GenBank上公布的基因序列分别设计大鼠c-kit、SCF及GAPDH的引物(见表1)。取每一样本PCR反应产物各5 uL加入琼脂糖凝胶电泳槽样孔内,上样孔内加入DNA Marker进行电泳,结束后胶置于紫外凝胶成像系统成相,分析并保存实验结果。

表1 c-kit、SCF及GAPDH的引物序列和扩增产物长度
1.3.5.4 结果分析
电泳后紫外凝胶成像结果用Quantity One软件测定条带灰度值,用c-kit、SCF分别与GAPDH条带灰度值的比值作为mRNA的相对表达量,分析各组相对表达量之间是否具有统计学意义。
1.4 统计学处理
2 结果
2.1 模型验证
2.1.1 动物一般情况
正常组(ZC组):大鼠一般状态好,活动灵活,进食正常,大小便正常,无死亡;
模型组(MX组):大鼠精神状态差,行动迟缓,进食较少,大便干结,但无死亡。
2.1.2 大鼠胃酚红排空率
正常组、WIRS模型组大鼠胃酚红排空率分别为:61.76%±1.22%,53.07%±2.19%,WIRS模型组胃酚红排空率显著低于正常组(P<0.05,见图1)。

图1 两组大鼠胃酚红排空率的直方图
2.2 CAP干预的实验结果
2.2.1 动物一般情况
A组:大鼠一般状态好,活动灵活,进食正常,大小便正常;
B组:大鼠精神状态差,行动迟缓,进食较少,大便干结,其中3只大鼠实验过程中精神萎靡,但未死亡;
C组:大鼠精神状态良好,行动稍迟缓,进食正常,大小便正常;
D组:大鼠一般状态好,活动灵活,进食量较多,大小便正常。
2.2.2 大鼠胃酚红排空率
各组大鼠胃酚红排空率:组间比较采用单因素方差分析LSD法,结果显示D组胃酚红排空率显著高于A、B、C组(P<0.05),A、C组胃酚红排空率显著高于B组(P<0.05,见表2)。
表2 各组大鼠胃酚红排空率(±s)

表2 各组大鼠胃酚红排空率(±s)
注:a.与A组比较,P<0.05;b.与B组比较,P<0.05;c与C.组比较,P<0.05
组别A B C D动物数(只)10 10 10 10胃排空率(%)62.91±1.10 55.33±1.79a61.88±2.07b70.78±2.42abc
2.2.3 胃窦组织c-kit mRNA、SCF mRNA的表达
2.2.3.1 大鼠胃窦组织c-kit mRNA的表达
RT-PCR结果显示:大鼠胃窦组织c-kit mRNA表达水平:A组、D组c-kit mRNA转录水平显著高于B组(P<0.05,见表3、2)。
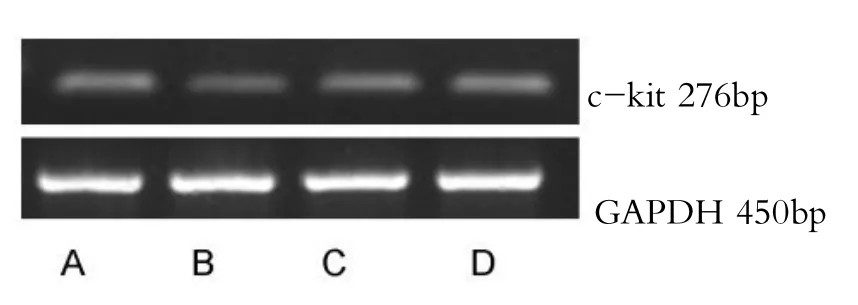
图2 RT-PCR检测各组c-kit mRNA的表达
2.2.3.2 大鼠胃窦组织SCF mRNA的表达
RT-PCR结果显示:大鼠胃窦组织SCF mRNA表达水平:A组SCF mRNA转录水平显著高于B组(P<0.05),C组、D组SCF mRNA转录水平显著高于A、B组(P<0.05,见表3)。
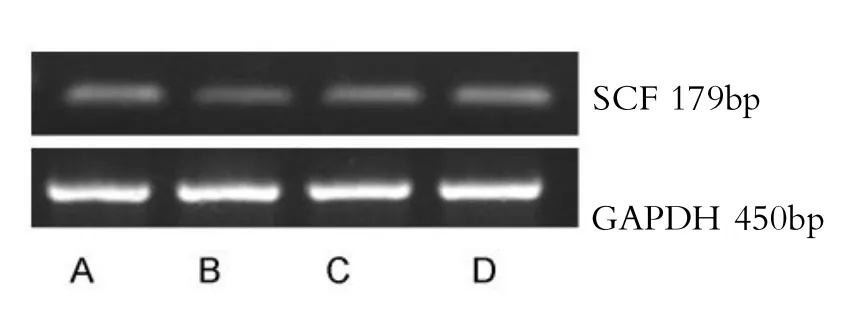
图3 RT-PCR检测各组SCF mRNA的表达
表3 RT-PCR检测各组c-kit mRNA、SCFmRNA的表达(±s)

表3 RT-PCR检测各组c-kit mRNA、SCFmRNA的表达(±s)
注:与A组比较,P<0.05;与B组比较,P<0.05
组别A B C D动物数(只)10 10 10 10 c-kit 0.624±0.016 0.606±0.011a0.622±0.011 0.633±0.013aSCF 0.894±0.011 0.853±0.009a0.932±0.009ab0.949±0.012ab
3 讨论
近年来研究发现CAP对胃肠动力有一定影响,有关CAP与胃肠动力关系的实验结果不一。多数研究认为小剂量CAP可促进胃动力,而大剂量时则对胃动力产生抑制作用。Mozsi K等[1]研究发现CAP能促进胃肠道疾病患者的胃排空。Bartho等[4]报道,CAP可诱发豚鼠食道出现两相收缩,即瞬时收缩和持久收缩。Bartho等[5]报道CAP可引起豚鼠回肠平滑肌的收缩,且此作用与神经末梢释放的生物活性物质刺激平滑肌细胞和肌间神经元有关。本实验通过配制CAP大鼠饲料,CAP的用量为5 mg/kg/d,连续喂食4周,结果显示:CAP组胃酚红排空率显著高于正常对照组与模型组,模型+CAP组胃酚红排空率显著高于模型组,提示CAP可能对正常大鼠及模型大鼠胃动力具有改善作用,这与Mozsi等的研究一致。
胃肠运动主要受神经系统与体液因素调节。其中肠神经系统-Cajal间质细胞(interstitial cells of Cajal,ICC)-平滑肌细胞组成的网络是胃肠动力的基本功能单位,对胃肠道的运动功能起决定性作用[6]。大量研究发现ICC可维持胃肠平滑肌节律性运动,并有产生起搏电位和传导慢波电位、调节神经递质等功能[7-8]酪氨酸激酶受体(c-kit)是ICC表面表达的特异性标志物,其在肠神经信号传递中起重要作用,检测其含量可作为消化系Cajal间质细胞的定量指标[9]。 c-kit与其自然配体-干细胞生长因子(stem cell factor,SCF)结合后启动的信号途径,对维持ICC的生长、发育及表型起着重要作用[10]。
慢波信号主要由ICC的一种亚型-肠肌从ICC(ICC-MY)产生,慢波传递至胃肠道平滑肌细胞,使平滑肌细胞外的Ca2+内流,使之产生兴奋性收缩来调节胃肠道的节律性运动,胃肠道动力障碍与慢波信号的减弱有密切关系[11-13]。Klein等[14]研究发现ICC缺失小鼠的小肠缺少慢波活动,并出现不协调性收缩。Chen J等[15]研究发现破坏ICC结构可导致大鼠胃肠道慢波紊乱。
肠神经系统(the enteric nervous system ENS)参与肠道动力的调节,很多胃肠动力障碍性疾病都存在ENS的紊乱。病理状态下ENS结构的紊乱发生在ICC病变之后,ICC的减少往往伴随着肠道神经元和肠道胶质细胞的减少[16,17]。Rolle等[18]发现肠内神经元发育不良与新生儿期ICC细胞网络系统的缺失有密切关系。ICC可能通过刺激神经细胞的干细胞因子影响ENS,神经细胞则是通过生成氮氧化物合酶,诱导产生NO刺激ICC细胞的增生[19]。由此提示c-kit、SCF与胃肠动力可能有一定联系。
本实验通过研究c-kit与SCF基因RT-PCR结果显示模型组c-kit mRNA转录水平显著低于正常对照组,但CAP组c-kit mRNA转录水平与正常对照组差异无统计学意义;模型组SCF mRNA转录水平显著低于正常对照组,CAP组SCF mRNA转录水平显著高于正常对照组与模型组。据此我们推论模型引起的大鼠胃排空率减慢,可能与应激影响SCF/ c-kit信号途径,影响ICC的功能有关;CAP可能对SCF的表达有一定影响,但与c-kit、Cajal间质细胞的相关性尚不明确。
综上所述,本实验研究发现正常大鼠及模型大鼠摄食小剂量CAP饲料4周可促进或改善胃动力,可能与CAP调节SCF的表达有关,为临床胃动力障碍的治疗提供方向,但CAP与c-kit、Cajal间质细胞的相关性尚不明确有待进一步研究。
1.Mozsik G.Capsaicin as new orally applicable gastroprotective and therapeutic drug alone or in combination with nonsteroidal anti-inflammatory drugs in healthy human[J]. Prog Drog Res,2014,68:209-258.
2.Debreceni A,Abdel-Salam OM,Figler M,et al.Capsaicin increases gastric emptying rate in healthy human subjects measured by 13C-labeled octanoic acid breath test[J].J Physiol Paris,1999,93(5):455-460.
3.Matsumoto K,Kurosawa E,Terui H,et al.Localization of TRPV1 and contractile effect of capsaicin in mouse large intestine:high abundance and sensitivity in rectum and distal colon[J].Am J Physiol Gastrointest Liver Physiol, 2009,297(2):G348-360.
4.Bartho L,Lenard L,Patacchini R,et al.Tachykinin receptors are involved in the"local efferent"motor response to capsaicin in the guinea-pig small intestine and oesophagus[J].Neuroscience,1999,90(1):221-228.
5.Bartho L,Benko R,Patacchini R,et al.Effects of capsaicin on visceral smooth muscle:a valuable tool for sensory neurotransmitter identification[J].Eur J Pharmacol,2004,500 (1-3):143-157.
6.李毅,齐清会.胃肠道神经-Cajal间质细胞-平滑肌网络研究进展[J].国际消化病杂志2007,27(3):225-227.
7.Lammers WJ,Stephen B.Origin and propagation of individual slow waves along the intact feline small intestine[J]. Exp Physiol,2008,93(3):334-346.
8.Apoznanski W,Koleda P,Wozniak Z,et al.The distribution of interstitial cells of Cajal in congenital ureteropelvic junction obstruction[J].Int Urol Nephrol,2013,45(3):6077-612.
9.张虹玺.养荣润肠舒合剂对慢传输型便秘模型大鼠结肠中c-Kit、SP与VIP的影响[J].中国药房,2015,26(25):3476-3478.
10.袁成代,高庆剑.温阳健脾法治疗便秘50例[J].河南中医,2015,35(7):1619-1620.
11.Huizinga JD,Zarate N,Farrugia G.Physiology,injury, and recovery of interstitial cells of Cajal:basic and clinical science[J].Gastroenterology,2009,137(5):1548-1556.
12.Sanders KM,Koh SD,Ward SM.Interstitial cells of cajal as pacemakers in the gastrointestinal tract[J].Annu Rev Physiol,2006,68:307-343.
13.Hennig GW,Spencer NJ,Jokela-Willis,et al.ICC-MY coordinate smooth muscle electrical and mechanical activity in the murine small intestine[J].Neurogastroenterol Motil, 2010,22(5):e138-151.
14.Klein S,Seidler B,Kettenberger A,et al.Interstitial cells of Cajal integrate excitatory and inhibitory neurotransmission with intestinal slow-wave activity[J].Nat Commun,2013, 4:1630.
15.Chen J,Du L,Xiao YT,et al.Disruption of interstitial cells of Cajal networks after massive small bowel resection[J]. World J Gastroenterol,2013,19(22):3415-6422.
16.Villanacci V,Annese V,Cuttitta A,et al.An immunohistochemical study of the myenteric plexus in idiopathic achalasia[J].J Clin Gastroenterol,2010,44(6):407-410.
17.Bassotti G,Villanacci V,Maurer CA,et al.The role of glial cells and apoptosis of enteric neurones in the neuropathology of intractable slow transit constipation[J].Gut,2006,55 (1):41-46.
18.Rolle U,Piaseczna-Piotrowska A,Puri P.Interstitial cells of Cajal in the normal gut and in intestinal motility disorders of childhood[J].Pediatr Surg Int,2007,23(12):1139-1152.
19.Choi KM,Gibbons SJ,Roeder JL,et al.Regulation of interstitial cells of Cajal in the mouse gastric body by neuronal nitric oxide[J].Neurogastroenterol Motil,2007,19(7): 585-595.
(2015-10-04收稿)
Effects and mechanisms of capsaicin on gastric motility in water immersion restraint stress rats
Li Zepei,Tang Chuankang,Shi Xiaomin,Pen Yan
Department of Gastroenterology,the First Affiliated Hospital of Sichuan Medical University,Luzhou 646000, Sichuan Province,China
Objective:To investigate the effects and mechanisms of capsaicin(CAP)on gastric motility in water immersion restraint stress rats.Methods:Forty male SD rats were randomly divided into 4 groups(n=10): normal control group,model group,model+CAP group,and CAP group.The model of water immersion restraint stress was created by injecting capsaicin 1mg/g for 4 consecutive weeks.At the end of the experiment,gastric emptying rate of phenol red was tested and the expression of c-kit and SCF mRNAs were evaluated in the gastric antrum tissues.Results:①The gastric emptying rate in CAP group was significantly higher than that in the control and model groups(P<0.05),and the gastric emptying rate in the model+CAP and control groups were significantly higher than that in the model group(P<0.05).②The expression of c-kit mRNA in model group was significantly lower than that in the control group(P<0.05),and the expression of c-kit mRNA in CAP group was significantly higher than that in the model group(P<0.05).The expression of SCF mRNA in model+CAP and CAP groups was significantly higher than that in the control and model groups(P<0.05),and the expression of SCF mRNA in control group was significantly higher than that in the model group(P<0.05).Conclusion:The CAP fed for 4 weeks could improve the gastric emptying rate in the normal and WIRS rats.The effect of CAP on gastric motility may come from the altered expression of SCF,but have no obvious relationship with interstitial cells of Cajal and the expression of c-kit.
R453.9;R-33
A
10.3969/j.issn.1000-2669.2016.01.006
*四川省科技厅项目基金(编号:12037)
李泽培(1987—),男,住院医师,硕士生
彭燕(1963—),女,主任医师。E-mail:1806857826@qq.com

