替吉奥单药治疗老年或体弱转移性结直肠癌患者疗效分析
孟秋丽,吴晓邡
(巩义市人民医院肿瘤血液科,河南 郑州 451200)
替吉奥单药治疗老年或体弱转移性结直肠癌患者疗效分析
孟秋丽,吴晓邡
(巩义市人民医院肿瘤血液科,河南 郑州 451200)
[摘要]目的观察分析替吉奥单药作为老年或体弱转移性结直肠癌(mCRC)患者治疗方案的疗效和毒副反应。方法24例老年或体弱mCRC患者接受口服替吉奥治疗,即替吉奥35 mg·m-2,每天2次,连用2周,停药1周。观察其近期疗效、疾病无进展生存期、总生存期、毒副反应等。结果全组24例患者的总有效率为16.7%,疾病控制率为75.0%;中位无进展生存期为4.1(95% CI为2.8~5.4)个月,中位总生存期:12.3(95% CI为9.9~14.7)个月;主要毒副反应为胃肠道反应、骨髓抑制,多为轻度,无患者因毒副反应终止治疗。结论替吉奥单药治疗老年或体弱mCRC患者安全性高、疗效好。
[关键词]替吉奥;老年患者;体弱患者;转移性结直肠癌
结直肠癌(colorectal cancer,CRC)患者50%大于70岁,在确诊时大多已出现转移,而且世界上老年CRC发病率持续上升[1]。目前以伊立替康或奥沙利铂为基础,联合氟尿嘧啶和亚叶酸钙作为转移性CRC(mCRC)的一线治疗,这些方案比单药治疗更有效[2-3]。但是,这些方案潜在毒副反应和氟尿嘧啶中心静脉给药的不方便性消减了这些方案作为姑息治疗的价值[4]。替吉奥是由替加氟、吉美嘧啶、奥替拉西钾组成的复方制剂,口服后替加氟在体内缓慢转变为氟尿嘧啶,吉美嘧啶减慢氟尿嘧啶分解代谢、提高氟尿嘧啶的有效浓度,奥替拉西钾降低氟尿嘧啶在胃肠道分布浓度、减轻其毒副反应。替吉奥在治疗老年晚期结直肠癌较其他方案有优势[5-7]。
在临床实践中,老年患者常常在器官功能上有年龄相关的改变,并且有多种合并疾病,增加了不良事件的发生,PS评分2分的患者(体弱),非常难进行合适化疗,他们均不能接受标准(足量)联合化疗,而且目前关于PS评分2分的mCRC患者的标准化疗方案没有共识。因此,需要寻求对老年(70~85岁)及体弱(65~69岁,PS评分2分)的mCRC患者更有效、毒副反应更轻的治疗方案。本研究观察分析了老年或体弱mCRC患者以替吉奥作为一线治疗的疗效及毒副反应。
1资料与方法
1.1临床资料纳入2010年1月至2013年1月入住我科的24例患者,入选条件:1)病理确诊为mCRC;2)70~85岁PS评分0~2分的老年mCRC患者和65~69岁PS评分2分的mCRC患者,以往未接受过放疗或化疗;3)有良好的血液系统功能:白细胞数目≥4×109·L-1,中性粒细胞数目≥1.5×109·L-1,血红蛋白≥100 g·L-1,血小板≥100×1012·L-1;4)有良好的肝肾功能:血清肌酐<15 g·L-1,胆红素<15 g·L-1,血清转氨酶<正常上线的3倍(肝转移患者<5倍);5)除外脑转移、严重胃出血和同时使用任何可能与替吉奥有潜在影响的药物(如:氟胞嘧啶、别嘌醇、华法林和苯妥英等);6)患者的预计生存期>3个月。在开始治疗前15 d进行筛选评估,包括全面的临床体检、病史、放射学检查、心电图检查和实验室检查。
1.2治疗方法24例患者均接受口服替吉奥治疗:35 mg·m-2,每天2次,连续2周,后休息1周,3周为1周期。依据体表面积来计算药物剂量,依据治疗相关的毒副反应来调整或中断治疗。治疗持续至确定肿瘤进展、不能耐受的毒副反应或患者拒绝。
1.3疗效及毒副反应评估每2周期进行肿瘤疗效评估,评估标准依据实体瘤疗效评价标准。主要终点是总有效率,包括完全缓解(CR)和部分缓解(PR)。次要终点包括疾病无进展生存期、总生存期和毒副反应。疾病无进展生存期为从治疗开始到肿瘤进展或任何原因导致死亡的时间。总生存期的计算是从开始治疗到死亡日期或最后随访时间。毒副反应评估是在患者接受至少1周期替吉奥化疗后,依据NCI通用标准3.0版进行评估,分为0~Ⅳ度。
1.4统计学处理采用SPSS 19.0进行数据分析,率的比较采用χ2检验,疾病无进展生存期及总生存期分析采用Kaplan-Meier法,检验水准α=0.05。
2结果
2.1患者一般资料24例患者的中位年龄73(65~81)岁,5例(20.8%)65~69岁患者PS评分2分(体弱),19例(79.2%)70~85岁(老年)患者,其中只有1例患者PS评分2分。病理分化级别以低分化为主:高分化3例(12.5%),中分化5例(20.8%),低分化15例(62.5%),未分化1例(4.2%)。见表1。
2.2近期疗效总治疗周期为107周期,平均每例患者4(2~22)周期。24例患者均可进行疗效评价,其中CR 0例(0.0%),PR 4例(16.7%),SD 14例(58.3%),PD 6例(25.0%),总有效率为16.7%,疾病控制率为75.0%。
表124例患者的一般资料
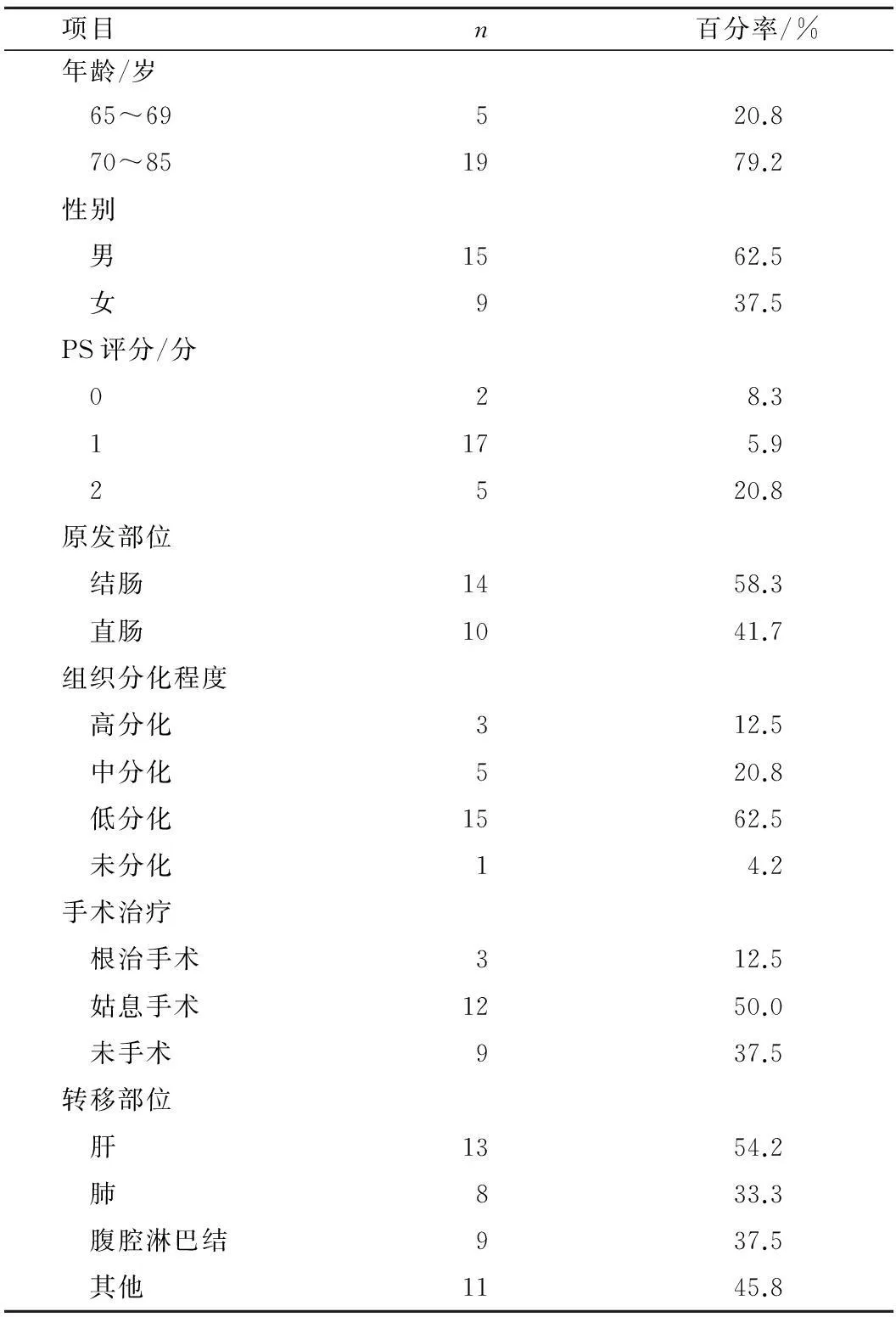
项目n百分率/%年龄/岁 65~69520.8 70~851979.2性别 男1562.5 女937.5PS评分/分 028.3 1175.9 2520.8原发部位 结肠1458.3 直肠1041.7组织分化程度 高分化312.5 中分化520.8 低分化1562.5 未分化14.2手术治疗 根治手术312.5 姑息手术1250.0 未手术937.5转移部位 肝1354.2 肺833.3 腹腔淋巴结937.5 其他1145.8
2.3生存分析结果中位疾病无进展生存期为4.1(95%CI为2.8~5.4)个月。中位生存期为12.3(95%CI为9.9~14.7)个月。1 a生存率为54.2%。见图1、2。
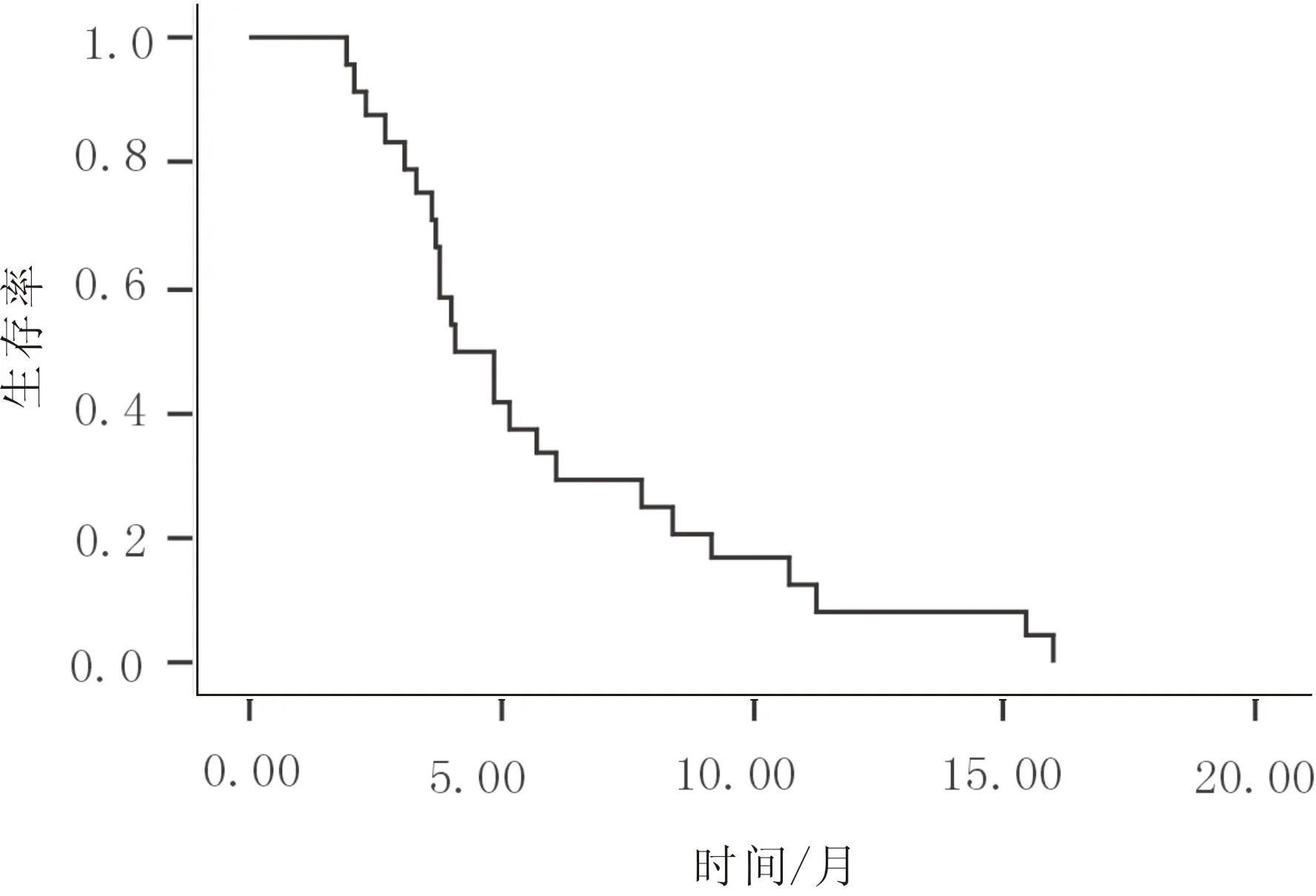
图1 24例患者的疾病无进展生存曲线

图2 24例患者的总生存曲线
2.4毒副反应主要毒副反应为胃肠道反应、骨髓抑制,多为轻度,无患者因毒副反应终止治疗。见表2。
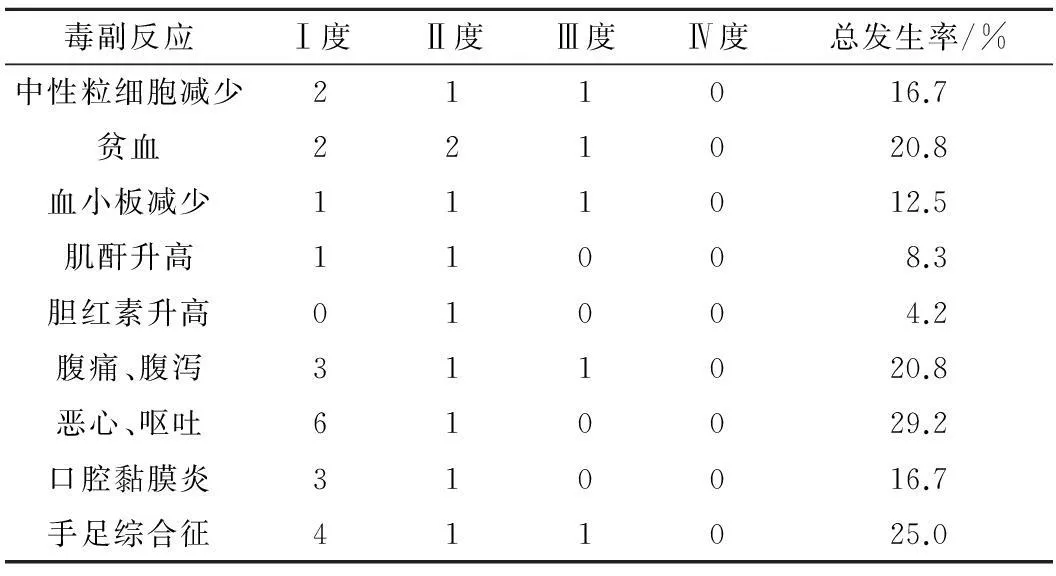
表2 24患者治疗相关毒副反应 n
3讨论
在以伊立替康或奥沙利铂为基础,联合氟尿嘧啶和亚叶酸钙作为mCRC的一线治疗中,老年及体弱患者相关毒副反应的发生率及严重程度均有所增加,故能否获益仍不确定。研究[8]报道应用氟尿嘧啶和亚叶酸钙加奥沙利铂方案,>65岁的患者比年轻患者发生腹泻的风险高。在另外一个研究中,高龄是腹泻、呕吐、白细胞减少、2个以上器官功能损害、严重的毒副反应和治疗相关死亡等的独立预测因素[9]。研究[10-11]证实,用氟尿嘧啶单药初始治疗,随后联合化疗,可能与那些一线联合化疗的有效率相似,在老年或体弱患者有效率、疾病无进展生存期和毒副反应均增加,但是生存率不增加[12]。有报道替吉奥单药治疗含伊立替康和奥沙利铂的方案化疗失败的mCRC患者,有14.3%的有效率和低的毒副反应率[13]。
本研究观察到入组患者中位生存期为12.3个月,与优福定和亚叶酸钙一线治疗组(12.5个月)[14]相似,显著优于单药卡倍他滨(11个月)[15]。而且,替吉奥作为单药一线化疗有比较好的耐受性,81%的受试者接受替吉奥全剂量化疗,严重毒副反应发生率较低,未出现Ⅳ度毒副反应。而在优福定方案中有Ⅲ度腹泻(25%)和卡倍他滨方案Ⅲ度手足综合征(6%)[9]。手足综合征是最严重毒副反应之一,可以对患者生活有相当大的影响。越来越多的证据表明,手足综合征可能是因为氟尿嘧啶的代谢降解的二氢嘧啶脱氢酶起始的产物造成。替吉奥能结合二氢嘧啶脱氢酶抑制剂具有消弱手足综合征发生率和严重程度的潜能[16]。有研究[17-18]也报道过对于老年及体弱的结直肠癌患者选择替吉奥单药化疗有较好的耐受性和有效性。综上所述,对>70岁或PS评分2分的体弱患者应用替吉奥单药一线化疗安全可靠、疗效肯定。但从目前公布的研究推断出,应根据结直肠癌患者的年龄、评分、并发疾病、肿瘤负荷及生物学状态来确定治疗方案。我们这个临床观察中最大的限制是缺乏老年功能状态测量标准,样本量小,无亚组分析,因此,需要进一步行大样本亚组综合评定。
参考文献:
[1]Yancik R,Ries LA.Cancer in older persons: an international issue in an aging world[J].Semin Oncol, 2004,31(2):128-136.
[2]Goldberg RM.Therapy for metastatic colorectal cancer[J].Oncologist, 2006,11(9):981-987.
[3]Goldberg RM,Rothenberg ML,Van Cutsem E,et al.The continuum of care: a paradigm for the management of metastatic colorectal cancer[J].Oncologist, 2007,12(1):38-50.
[4]Ledermann JA,Leonard P,Seymour M.Recommendation for caution with irinotecan,fluorouracil,and leucovorin for colorectal cancer[J].N Engl J Med, 2001,345(2):145-146.
[5]赖灿辉,张江灵,郑维斌,等.替吉奥维持治疗晚期结直肠癌的临床疗效[J].中国肿瘤临床与康复,2015,(2):194-196.
[6]李陆,王蓉,何怡.单药替吉奥一线治疗老年晚期结直肠癌临床疗效观察[J].西南军医,2015,17(1):22-24.
[7]Shin SJ,Jeong JH,Park YS,et al.Phase Ⅱ trial of S-1 monotherapy in elderly or frail patients with metastatic colorectal cancer[J].Invest New Drugs, 2011,29(5):1073-1080.
[8]Yasui H,Muro K,Shimada Y,et al.A phase 3 non-inferiority study of 5-FU/l-leucovorin/irinotecan (FOLFIRI) versus irinotecan/S-1 (IRIS) as second-line chemotherapy for metastatic colorectal cancer: updated results of the FIRIS study[J].J Cancer Res Clin Oncol, 2015,141(1):153-160.
[9]Shingai T,Sakai D,Sugimoto N,et al.A feasibility study of adjuvant therapy with capecitabine plus oxaliplatin (XELOX) for Japanese patients with advanced colorectal cancer[J].Gan To Kagaku Ryoho, 2015,42(2):195-199.
[10]Koopman M,Antonini NF,Douma J,et al.Sequential versus combination chemotherapy with capecitabine,irinotecan,and oxaliplatin in advanced colorectal cancer (CAIRO): a phase Ⅲ randomised controlled trial[J].Lancet, 2007,370(9582):135-142.
[11]Seymour MT,Maughan TS,Ledermann JA,et al.Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial[J].Lancet, 2007,370(9582):143-152.
[12]Seymour MT,Thompson LC,Wasan HS,et al.Chemotherapy options in elderly and frail patients with metastatic colorectal cancer (MRC FOCUS2): an open-label,randomised factorial trial[J].Lancet, 2011,377(9779):1749-1759.
[13]Jeung HC,Rha SY,Cho BC,et al.A phase Ⅱ trial of S-1 monotherapy in metastatic colorectal cancer after failure of irinotecan- and oxaliplatin-containing regimens[J].Br J Cancer, 2006,95(12):1637-1641.
[14]Saiura A,Yamamoto J,Hasegawa K,et al.A combination of oral uracil-tegafur plus leucovorin (UFT + LV) is a safe regimen for adjuvant chemotherapy after hepatectomy in patients with colorectal cancer: safety report of the UFT/LV study[J].Drug Discov Ther, 2014,8(1):48-56.
[15]Feliu J,Escudero P,Llosa F,et al.Capecitabine as first-line treatment for patients older than 70 years with metastatic colorectal cancer: an oncopaz cooperative group study[J].J Clin Oncol, 2005,23(13):3104-3111.
[16]Yen-Revollo JL,Goldberg RM,McLeod HL.Can inhibiting dihydropyrimidine dehydrogenase limit hand-foot syndrome caused by fluoropyrimidines? [J].Clin Cancer Res, 2008,14(1):8-13.
[17]Saif MW.Chemotherapy options in elderly and frail patients with metastatic colorectal cancer[J].Ann Gastroenterol, 2012,25(3):274-275.
[18]Varol U,Dirican A,Yildiz I,et al.First-line mono-chemotherapy in frail elderly patients with metastatic colorectal cancer[J].Asian Pac J Cancer Prev, 2014,15(7):3157-3161.
Efficacy of S-1 Monotherapy in the Treatment of Elderly or Frail Patients with Metastatic Colorectal Cancer
Meng Qiuli,Wu Xiaofang
(DepartmentofOncologyandHematology,GongyiCityPeople’sHospital,Zhengzhou451200,China)
[Abstract]ObjectiveTo evaluate the efficacy and toxicities of S-1 monotherapy in the treatment of elderly or frail patients with metastatic colorectal cancer.MethodsA total of 24 elderly or frail patients with metastatic colorectal cancer were eligible for S-1 of 35 mg·m-2given twice daily for 2 weeks followed by 1 week of rest.The short term effects,progression-free survival,overall survival time,toxicities were observed.ResultsThe overall response rate of all the 24 patients was 16.7%,the disease control rate was 75.0%.The median progression-free survival was 4.1 months (95% CI 2.8-5.4 months),the median overall survival was 12.3 months (95% CI 9.9-14.7 months).The main toxicities were gastrointestinal reactions and bone marrow suppression,none of the patients terminated treatment due to toxicities.ConclusionS-1 monotherapy was well-tolerated and efficacious in the treatment of elderly or frail patients with metastatic colorectal cancer.
[Key words]S-1; elderly patients; frail patients; metastatic colorectal cancer
(收稿日期:2015-06-05)
[中图分类号]R735.3;R730.53
[文献标识码]A
[文章编号]1673-5412(2016)01-0039-04
DOI:10.3969/j.issn.1673-5412.2016.01.012
作者简介:孟秋丽(1969-),女,副主任医师,主要从事肿瘤内科临床工作。E-mail: mengqiuli0630@126.com

