Hedgehog信号通路转录因子Gli1蛋白在结直肠癌组织中的表达
郭丽梅,杜 娟,廖 鹰,李 扬,王光熙,刘 岩
(北京大学医学部病理学系,北京 100091)
Hedgehog信号通路转录因子Gli1蛋白在结直肠癌组织中的表达
郭丽梅,杜娟,廖鹰,李扬,王光熙,刘岩
(北京大学医学部病理学系,北京 100091)
[摘要]目的探讨Hedgehog信号通路转录因子脑胶质瘤相关癌基因1(Gli1)蛋白在结直肠癌组织中的表达及作用。方法免疫组化法检测Gli1蛋白在147例手术切除结直肠癌组织中的表达;Western blotting法检测Gli1蛋白在19例结直肠癌新鲜组织和2个结肠癌细胞系中的表达;同时用共聚焦激光显微镜观察Gli1转录水平的抑制剂GANT61对8例直肠癌组织中直接分离的肿瘤细胞的影响。结果147例结直肠癌根治切除标本中,Gli1蛋白在78.2%(115/147)的结直肠癌组织中表达升高,阳性信号表达在肿瘤细胞的细胞核和细胞浆。Gli1蛋白在结直肠癌组织中的表达与结直肠癌浸润前缘肿瘤细胞团数目、浸润深度、淋巴结转移、TNM分期有关(P<0.05)。在5例Gli1蛋白阳性的结直肠癌组织中,间质细胞,包括肿瘤相关纤维母细胞和内皮细胞内高表达Gli1蛋白。Gli1蛋白在结直肠癌组织和2个结肠癌细胞系中的表达也升高。对结直肠癌组织中直接分离出的肿瘤细胞,培养以后加入GANT61,可以明显抑制肿瘤细胞内Gli1蛋白的表达,而对肿瘤相关纤维母细胞没有显著影响。结论Gli1蛋白的活化可能增强肿瘤细胞的侵袭和转移能力,从而促进结直肠癌的进展;GANT61可能为进展期结直肠癌的治疗提供新的契机。
[关键词]Hedgehog信号通路;脑胶质瘤相关癌基因1;结直肠癌;免疫组织化学
结直肠癌是胃肠道常见恶性肿瘤,近年来我国结直肠癌的发病率和死亡率均呈上升趋势,多数患者发现时已属于中晚期。城市患者发病高峰在50岁左右,中位发病年龄比欧美提前约10 a[1-2]。有关结直肠癌发病机制的研究[3-6]表明,多种信号通路与基因的异常变化参与了肿瘤的发生和进展。其中,Hedgehog信号通路近来被广泛报道,该通路功能的异常活化可以促进结直肠癌的发生和进展,已受到越来越多的关注[5-9]。
Hedgehog信号通路因调节果蝇成体刚毛的形成而得名,众多研究发现该通路除了在哺乳动物胚胎发育过程中起重要的形态形成因子作用以外,与人类肿瘤的发生和演进也紧密相关。Hedgehog信号通路的异常激活可以导致多种肿瘤发生和进展,如基底细胞癌、髓母细胞瘤、肺小细胞癌、乳腺癌、前列腺癌、肝癌、胰腺癌、胃肠道恶性肿瘤、淋巴瘤等[10-20]。Hedgehog信号通路主要由3部分组成:Hedgehog信号肽(Shh、Ihh、Dhh)、跨膜受体(Ptch)、细胞内传导分子(Smo)、下游转录因子(Gli)。经典途径中,Hedgehog信号通路的激活是通过配体Hedgehog与跨膜受体Ptch结合,进而解除Ptch对另一跨膜蛋白Smo的抑制作用,Smo然后通过激活转录因子Gli1和(或)Gli2,进而促进一系列下游靶基因转录,其中包括促进细胞增殖、抑制细胞凋亡、促进上皮-间质转化、肿瘤血管生成等众多基因的转录[10-11,21-23]。此外,有研究[24-26]发现Gli1可以不经过Hedgehog配体引发的级联反应、而由PI3K/AKT、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、K-ras等直接活化。以上发现提示,无论经典途径或非经典途径,Gli1的活化对肿瘤发生和发展都非常重要。本研究旨在通过观察Gli1蛋白在结直肠癌组织和细胞中的表达状况,确立其在肿瘤演进过程中的作用,并初步探讨针对Gli1的小分子化合物GANT61对肿瘤细胞的影响。
1材料与方法
1.1材料收集2009年至2013年在北京大学第三医院进行的术前未经过新辅助治疗的结直肠癌患者147例,其中肿瘤限于黏膜下层内者29例,浸润至肌层或更深部肠壁者118例。从19例至少为肌层浸润的病例获得结直肠癌组织和正常肠黏膜组织,其中有8例肿瘤组织同时用于直接分离肿瘤细胞。
1.2试剂Gli1抗体购自美国Santa Cruz公司;二抗、DAB试剂盒购自丹麦Dako公司;GANT61购自德国Merck公司;结肠癌细胞系(HCT116、DLD-1)购自美国ATCC细胞库。


2结果
2.1Gli1蛋白在结直肠癌组织中原位表达的观察结果147例结直肠癌组织标本中,Gli1蛋白在78.2%(115/147)的结直肠癌组织中表达升高,阳性信号表达在肿瘤细胞的细胞核和细胞浆。在5例Gli1蛋白阳性的结直肠癌组织中,间质细胞,包括肿瘤相关纤维母细胞和血管内皮细胞的细胞核和细胞浆也表达有Gli1蛋白(图1)。对结直肠癌根治标本冰冻切片中Gli1蛋白进行免疫荧光染色后共聚焦显微镜观察,发现肿瘤细胞的细胞浆和细胞核内均有表达(图2)。Gli1蛋白在结直肠癌组织中的表达结直肠癌浸润前缘肿瘤细胞团数目、浸润深度、淋巴结转移、TNM分期有关(P<0.05),即Gli1蛋白的表达水平越高,肿瘤浸润层次越深、浸润前缘肿瘤细胞团数目越多、淋巴结转移概率越高、TNM分期越高(表1)。

图1 免疫组化显示不同结直肠组织中Gli1蛋白的表达
A:正常直肠(×200);B:进展期结肠腺癌(×100);C:进展期直肠腺癌(×200);D:进展期直肠腺癌中肿瘤间质内肿瘤相关纤维母细胞和脉管内皮细胞(×200)
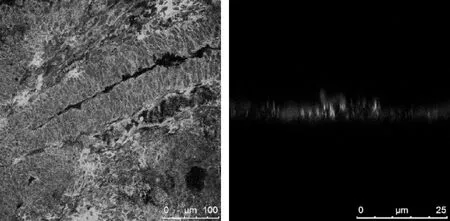
图2 免疫荧光染色后共聚焦
2.2Western blotting法半定量分析Gli1蛋白在结直肠癌组织和结肠癌细胞系中的表达Western blotting结果显示,在42.1%(8/19)的进展期结直肠癌组织中,Gli1蛋白的表达明显升高(图3)。在2个结肠癌细胞系中,Gli1蛋白在细胞核内表达强于细胞浆(图4)。
2.3GANT61对结直肠癌分离肿瘤细胞生长的影响加入针对Gli1转录水平的小分子化合物抑制剂GANT61,原位观察GANT61对8例结直肠癌组织分离、培养的肿瘤细胞及肿瘤相关纤维母细胞的影响。发现加入DMSO的对照组中,肿瘤细胞的细胞浆与细胞核内Gli1蛋白均有表达;加入GANT61之后,Gli1蛋白在细胞核内的表达明显减弱(图5)。而对于纤维母细胞,加入DMSO或GANT61后,Gli1蛋白的阳性信号没有明显变化,在细胞浆和细胞核中仍均有表达(图6)。
3讨论
Hedgehog基因作为一种重要的胚胎形态发育调控因子,最早被确认参与体内多种器官和组织的发育成熟。出生后,Hedgehog蛋白仅少量表达于呼吸道、胃肠道等上皮内的基底干细胞。Hedgehog通路成员基因的异常表达则会启动靶基因转录,引起细胞异常分裂增殖,从而导致肿瘤形成[6,10]。大量研究[5-6,21-26]证实Hedgehog信号通路参与多种恶性肿瘤的发生和演进,可能的致癌途径有3个:1)通过配体Shh蛋白表达:内源性Shh过表达,并与受体Ptch结合,从而解除后者对下游因子Smo的抑制作用,促使全长的Gli1或Gli2进入核内启动靶基因;2)Ptch和(或)Smo发生突变:导致下游信号传导调节失控,靶基因不断激活;3)不经由Hedgehog/Ptch/Smo的级联传导,而是由PI3K/AKT、TGF-β1、K-ras等直接激活Gli1或Gli2,促进下游靶基因活化。除调控肿瘤的发生发展外,Hedgehog信号通路还参与炎症修复、血管新生等过程[27-29]。
本研究纳入的结直肠癌患者个体化根治组织标本中,Gli1蛋白在多数肿瘤实质细胞及少数间质细胞内表达均增强。肿瘤细胞Gli1蛋白表达的阳性比例和阳性信号越高,肿瘤的浸润和侵袭行为越强,淋巴结发生转移的概率越高,TNM分期越高。这些结果提示Gli1蛋白高表达的患者,其肿瘤的生物学行为可能更差,常规辅助治疗效果可能不理想,预后差。
有关Hedgehog信号通路抑制剂的研究很多。其中,环巴胺,一种从百合科藜芦属植物中提取的异甾体类生物碱,通过与Smo结合而阻断Hedgehog信号通路传导的作用机制得到揭示。由环巴胺衍生的另一抑制剂Vismogib(GDC0449)目前正在临床应用于转移性基底细胞癌患者的治疗。而针对Gli转录水平的抑制剂GANT61可能对抑制Hedgehog信号通路的功能更为重要[22-23,29-31]。本研究中,我们向直接分离、培养的结直肠癌细胞与肿瘤相关纤维母细胞内加入GANT61,发现其对肿瘤细胞内Gli1蛋白的细胞核内表达有明显抑制,部分肿瘤细胞核Gli1蛋白表达减弱,而对纤维母细胞没有明显影响。我们推测GANT61可能通过抑制Gli1入核或抑制Gli1与靶基因的结合,无法转录激活下游靶基因,从而抑制细胞生长,促进细胞死亡。这提示GANT61有可能作为一个新的治疗靶点,但其对肿瘤生长依赖的微环境的改善与抑制效果有限。
表1Gli1蛋白在结直肠癌组织中的表达与其临床病理参数的关系

项目n染色比例阳性阴性P染色程度评分P年龄/岁 ≤50282172.165±0.367 >501199425>0.052.133±0.500>0.05性别 男7657192.705±0.778 女715813>0.052.367±0.800>0.05肿瘤位置 右半结肠4732151.900±0.037 左半结肠19154>0.052.533±0.300>0.05 乙状结肠262151.820±0.073 直肠554782.100±0.920组织学类型 管状腺癌8668182.367±0.466 黏液腺癌39318>0.051.945±0.183>0.05 印戒细胞癌221662.515±0.300病理分化程度 高分化191362.867±0.766 中分化655114>0.052.367±0.621>0.05 低分化6351123.005±0.805浸润前缘癌细胞数 ≤52710170.420±0.074 >5~1054468<0.051.670±0.260<0.05 >10665972.896±0.167浸润深度 黏膜下297222.800±0.365 肌层35278<0.052.225±0.036>0.05 浆膜下层494722.133±0.460 浆膜343223.024±0.537脉管瘤栓 有5242102.610±0.133 无957322>0.053.100±0.720>0.05淋巴结转移 N05833251.300±0.200 N1~289827<0.053.000±0.533<0.05临床分期 Ⅰ~Ⅱ期6736311.327±0.020 Ⅲ~Ⅳ期80791<0.053.055±0.133<0.05
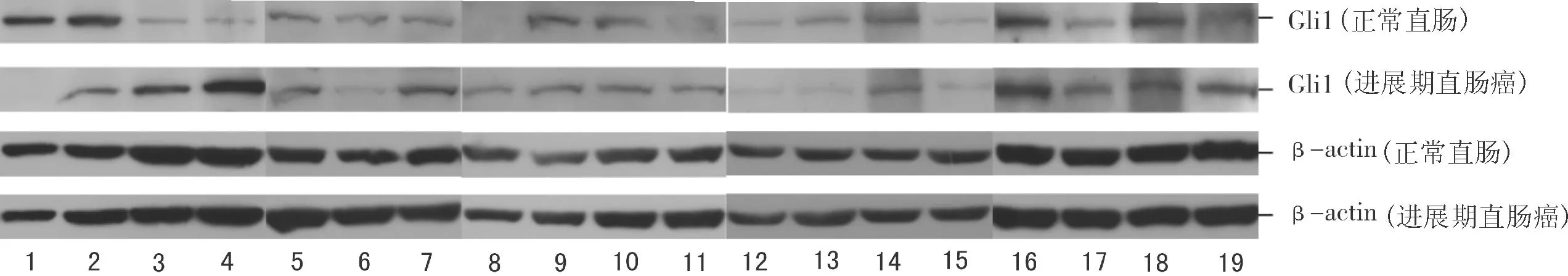
图3 Western Blotting结果示19例进展期直肠癌和正常直肠黏膜组织中Gli1蛋白表达水平

图4 Western blotting结果示2个

图5 共聚焦激光显微镜示结直肠癌分离
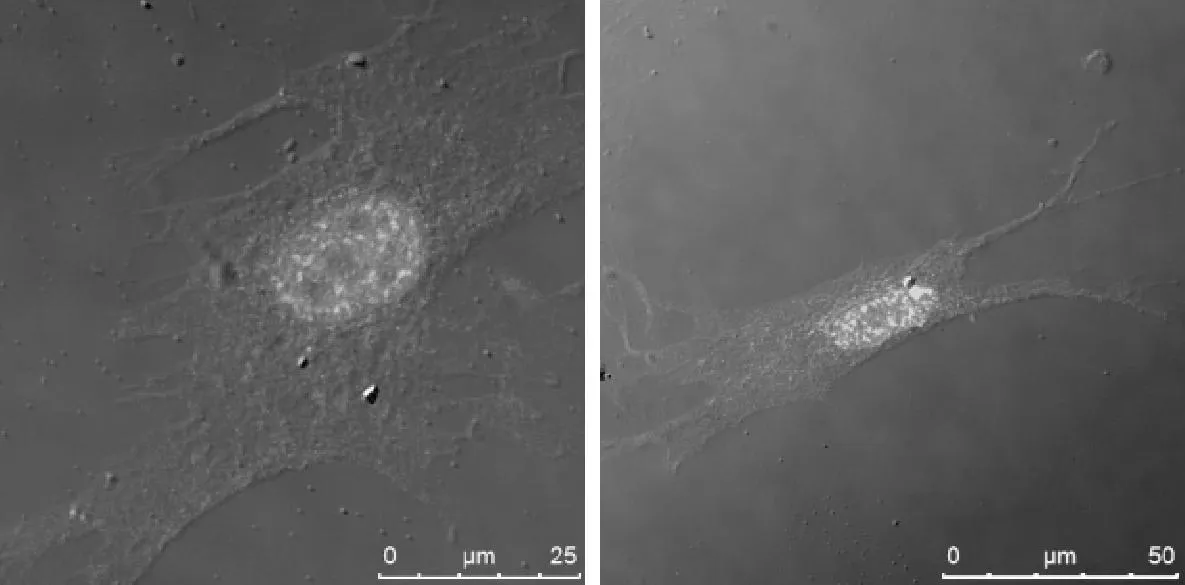
图6 共聚焦激光显微镜示结直肠癌分离肿瘤相关
Gli1蛋白在多数进展期直肠癌组织中表达水平升高,提示其功能的持续活化。在结直肠癌发生和演进过程中,Hedgehog信号通路可能通过2种不同的激活方式起作用,即依赖于Shh配体以及不依赖于Shh激活的可能性。进一步的研究需要结合Gli1表达与其他促进结直肠癌发生和演进的分子途径,观察如Wnt/APC通路、PTEN等,关注与Hedgehog信号通路的相互作用。因此,Hedgehog已不是一条单一的信号通路,而更像是一个分子网络,更多Gli1非配体依赖的活化途径需要证实。例如Gli1的活化可能受K-ras基因突变的影响,有必要结合肿瘤细胞K-ras基因点突变检测的相关性分析。由于本研究结果也进一步证实,Gli1蛋白在结直肠癌组织中的表达与结直肠癌的侵袭和转移密切相关,所以针对Gli1蛋白的分析可以更好区分开Hedgehog信号通路活化与非活化组,活化组的患者其肿瘤恶性行为更凶,预后可能更差,应采用不同的治疗方案。
参考文献:
[1]中华人民共和国卫生和计划生育委员会医政医管局,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2015版) [J].中华消化外科杂志,2015,14(10): 783-799.
[2]张玥,石菊芳,黄慧瑶,等.中国人群结直肠癌疾病负担分析 [J].中华流行病学杂志,2015,36(7): 709-714.
[3]Wang WS,Chen PM,Su Y.Colorectal carcinoma: from tumorigenesis to treatment [J].Cell Mol Life Sci,2006,63(6): 663-671.
[4]Abetov D,Mustapova Z,Saliev T,et al.Biomarkers and signaling pathways of colorectal cancer stem cells [J].Tumour Biol,2015,36(3): 1339-1353.
[5]Song L,Li ZY,Liu WP,et al.Crosstalk between Wnt/β-catenin and Hedgehog/Gli signaling pathways in colon cancer and implications for therapy[J].Cancer Biol Ther,2015,16(1):1-7.
[6]Taipale J,Beachy PA.The Hedgehog and Wnt signaling pathways in cancer [J].Nature,2001,411(6835): 349-354.
[7]Qualtrough D,Buda A,Gaffield W,et al.Hedgehog signalling in colorectal tumor cells: induction of apoptosis with cyclopamine treatment [J].Int J Cancer,2004,110(6): 831-837.
[8]Douard R,Moutereau S,Pernet P,et al.Sonic hedgehog-dependent proliferation in a series of patients with colorectal cancer [J].Surgery,2006,139(5): 665-670.
[9]Monzo M,Moreno I,Artells R,et al.Sonic hedgehong mRNA expression by real-time quantitative PCR in normal and tumor tissues from colorectal cancer patients[J].Cancer Lett,2006,233(1):117-123.
[10]Ruiz AA,Sanchez P,Dahmane N.Gli and hedgehog in cancer: tumors,embryos and stem cells [J].Nat Rev Cancer,2004,2(5): 361-372.
[11]Cai X,Yu K,Zhang L,et al.Synergistic inhibition of colon carcinoma cell growth by Hedgehog-Gli1 inhibitor arsenic trioxide and phosphoinositide 3-kinase inhibitor LY294002 [J].Onco Targets Ther,2015,8: 877-883.
[12]Piérard-Franchimont C,Hermanns-Lê T,Paquet P,et al.Hedgehog- and mTOR-targeted therapies for advanced basal cell carcinomas [J].Future Oncol,2015,11(22): 2997-3002.
[13]Tiberi L,Bonnefont J,van den Ameele J.A BCL6/BCOR/SIRT1 complex triggers neurogenesis and suppresses medulloblastoma by repressing Sonic Hedgehog signaling [J].Cancer Cell,2014,26(6): 797-812.
[14]Flemban A,Qualtrough D.The Potential Role of Hedgehog Signaling in the Luminal/Basal Phenotype of Breast Epithelia and in Breast Cancer Invasion and Metastasis [J].Cancers (Basel),2015,7(3): 1863-1884.
[15]Gonnissen A,Isebaert S,Haustermans K.Hedgehog signaling in prostate cancer and its therapeutic implication [J].Int J Mol Sci,2013,14(7): 13979-14007.
[16]Watkins DN,Berman DM,Burkholder SG,et al.Hedgehog signalling within airway epithelial progenitors and in small-cell lung cancer [J].Nature,2003,422(6929): 313-316.
[17]Thayer SP,Magliano MP,Heiser PW,et al.Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis [J].Nature,2003,425(6960): 851-855.
[18]Berman DM,Karhadkar S,Maitra A,et al.Widespread requirement for hedgehog ligand stimulation in growth of digestive tract tumors [J].Nature,2003,425(6960): 846-851.
[19]Al-Bahrani R,Nagamori S,Leng R,et al.Differential Expression of Sonic Hedgehog Protein in Human Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma[J].Pathol Oncol Res,2015,21(4):901-908.
[20]Geng L,Wang X.New insight into hedgehog signaling in hematological malignancies [J].Leuk Lymphoma,2015,56(4): 858-865.
[21]Falkenstein KN,Vokes SA.Transcriptional regulation of graded Hedgehog signaling [J].Semin Cell Dev Biol,2014,33: 73-80.
[22]Marini KD,Payne BJ,Watkins DN.Mechanisms of Hedgehog signalling in cancer [J].Growth Factors,2011,29(6): 221-234.
[23]Katoh Y,Katoh M.Hedgehog target genes: mechanisms of carcinogenesis induced by aberrant hedgehog signaling activation [J].Curr Mol Med,2009,9(7): 873-886.
[24]Zhou J,Zhu G,Huang J,et al.Non-canonical GLI1/2 activation by PI3K/AKT signaling in renal cell carcinoma: A novel potential therapeutic target[J].Cancer Lett,2016,370(2):313-323.
[25]Perrot CY,Javelaud D,Mauviel A.Overlapping activities of TGF-β and Hedgehog signaling in cancer: therapeutic targets for cancer treatment [J].Pharmacol Ther,2013,137(2): 183-199.
[26]Huang M,Tang SN,Upadhyay G.Embelin suppresses growth of human pancreatic cancer xenografts,and pancreatic cancer cells isolated from KrasG12D mice by inhibiting Akt and Sonic hedgehog pathways [J].PLoS One,2014,9(4): e92161.
[27]Coon D,Roberts D,Loscertales M,et al.Differential epithelial expression of Shh and Foxf1 in usual and non-specific interstitial pneumonia [J].Exp Mol Pathol,2006,80(2): 119-123.
[28]Salka S,Muragakt Y,Olada Y,et al.Sonic hedgehog expression and role in healing corneal epithelium [J].Invest Ophthal Vis Science,2004,45(8): 2577-2585.
[29]Beachy PA,Karhadkar SS,Berman DM.Mending and malignancy[J].Nature,2004,431(7007):402.
[30]Agyeman A,Jha BK,Mazumdar T,et al.Mode and specificity of binding of the small molecule GANT61 to GLI determines inhibition of GLI-DNA binding[J].Oncotarget,2014,5(12):4492-4503.
[31]Fu J,Rodova M,Roy SK,et al.GANT-61 inhibits pancreatic cancer stem cell growth in vitro and in NOD/SCID/IL2R gamma null mice xenograft[J].Cancer Lett,2013,330(1):22-32.
Expression of Hedgehog Signal Path Transcription Factor Gli1 in the Human Colorectal Carcinoma
Guo Limei,Du Juan,Liao Ying,Li Yang,Wang Guangxi,Liu Yan
(DepartmentofPathology,PekingUniversityHealthScienceCenter,Beijing100091,China)
[Abstract]ObjectiveTo explore the expression and significance of Hedgehog signal path transcription factor glioma associated oncogene 1 (Gli1) in the human colorectal carcinoma.MethodsExpressions of Gli1 protein was detected and evaluated in the 147 cases of human colorectal carcinoma by immunohistochemistry.Western blotting was used to analyze Gli1 protein in the fresh colorectal carcinoma tissues and the two cell lines of colon carcinoma.Additionally,the carcinoma cells directly isolated from 8 cases of colorectal carcinoma tissues were added with GANT61,and were observed by confocal laser microscopy.ResultsGli1 protein was detected in the nucleus and cytoplasm of carcinoma cells in the 78.2% (115/147) of the 147 cases of human colorectal carcinoma.Statistically,the expression of Gli1 protein in the human colorectal carcinoma was significantly correlated with the tumor cell clusters of invasion edge,deepness of tumor invasion,lymph node metastasis,and TNM staging,respectively (P<0.05).In 5 cases of human colorectal carcinoma with positive expression of Gli1 protein,Gli1 protein was also detected in the tumor stroma cells,including cancer associated fibroblasts and endothelial cells.Gli1 protein high expression was confirmed by Western blotting in the carcinoma tissues and the two cell lines.In addition,GANT61 inhibited the expression of Gli1 protein in the carcinoma cells isolated from the CRC tissues significantly,but not for the carcinoma-associated fibroblasts.ConclusionOverexpression of Gli1 protein may involve in the progression of human colorectal carcinoma through increasing tumor invasion and metastasis; furthermore,GANT61 may be a new drug for the therapy of advanced CRC.
[Key words]Hedgehog signal path; glioma associated oncogene 1; colorectal carcinoma; immunohistochemistry
(收稿日期:2015-11-30)
[中图分类号]R735.3;R730.23
[文献标识码]A
[文章编号]1673-5412(2016)01-0001-06
DOI:10.3969/j.issn.1673-5412.2016.01.001
作者简介:郭丽梅(1973-),女,博士,副教授,主要从事消化系统肿瘤病理诊断及研究。E-mail: guolimei@bjmu.edu.cn
基金项目:国家自然科学基金青年基金资助项目(编号:30700349);国家自然科学基金主任专项基金资助项目(编号:30440012);北京市科学技术委员会基金资助项目(编号:Z131100004013036)

