基质金属蛋白酶2,9,12与慢性阻塞性肺疾病的临床研究
李敏王宇宏李巍
基质金属蛋白酶2,9,12与慢性阻塞性肺疾病的临床研究
李敏①王宇宏①李巍①
【摘要】目的:探讨慢性阻塞性肺疾病(COPD)与血清基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)、基质金属蛋白酶12(MMP-12)的相关性。方法:选取COPD患者80例,其中急性加重期(AECOPD)40例,临床缓解期40例,健康对照者45例,采用双抗夹心ELISA法测定所有研究对象的血清MMP-2、MMP-9、MMP-12含量,并做统计学分析。结果:COPD患者血清MMP-2、MMP-9、MMP-12水平均明显高于健康对照者,差异均有统计学意义(P<0.05或P<0.01);且AECOPD患者血清MMP-2、MMP-9、MMP-12水平显著高于临床缓解期患者(P<0.01)。稳定期COPD患者血清MMP-2、MMP-9、MMP-12水平与第1秒用力呼气容积(FEV1)成负相关(r=-0.529,P<0.01;r=-0.385,P<0.05;r=-0.627,P<0.01)。结论:COPD患者血清MMP-2、MMP9、MMP-12水平均明显升高,且与疾病严重程度成正相关。
【关键词】基质金属蛋白酶; 慢性阻塞性肺疾病; 第1秒用力呼气容积
①吉林省吉林市中心医院 吉林 吉林 132011
【Key words】 Matrix metalloproteinase; Chronic obstructive pulmonary disease; Forced expiratory volume in first second
First-author’s address:The Central Hospital of Jilin City,Jilin 132011,China
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是持续性气流受限为特征的可以预防和治疗的疾病,其气流受限呈可逆性进行性进展,与气道和肺组织对香烟烟雾等有害气体或颗粒的异常慢性炎症反应。COPD的发生与炎症机制、蛋白酶和抗蛋白酶失衡、氧化应激机制以及自主神经系统功能紊乱、营养不良等有关。气道壁纤维化、细支气管平滑肌增生和肺泡壁变薄、肺泡腔变大是COPD气道重塑的主要病理特征。支气管肺泡组织中弹性成分的降解是肺气肿发生发展的最主要原因。细胞外基质(extracellular matrix,ECM)的合成与降解之间的平衡对维持肺泡结构和肺功能具有重要作用。基质金属蛋白酶(matrix metalloproteinase,MMPs)是调节ECM的主要限速酶,在维持正常组织结构、组织细胞分化、细胞信号传导、血管形成等多种病理生理过程中发挥着重要作用[1]。蛋白酶增加或抗蛋白酶不足均可以导致肺组织机构的破坏,产生肺气肿。自上个世纪60年代提出蛋白酶和抗蛋白酶失衡是导致COPD的重要机制以来,MMPs在COPD的发病过程中得到深入研究。本试验基于理论与基础研究,通过测定COPD患者血清的MMP-2、MMP-9、MMP-12的水平,探索MMPs在COPD中的表达及其相关性。
1 资料与方法
1.1一般资料 选择2013年12月-2014年12月在本院特诊呼吸科住院的COPD患者80例,所有入选对象均按照《慢性阻塞性肺疾病指南》标准[2],入组前均签署知情同意书。按患者入院时病情轻重分为急性发作期(AECOPD)、临床缓解期,其中急性加重期40例,临床缓解期40例;男46例,女34例,平均年龄(72.00±11.00)岁。同时选取同期健康体检对象45例作为健康对照组。详细采集所有入选对象的一般资料及既往病史(性别、年龄、吸烟史、家族史),行心电图、肺CT、肺功能、肝功、肾功能、心彩等检查。排除标准:急性心、脑血管疾病、急性肺栓塞、风湿结缔组织疾病、严重肝肾功能不全以及其他呼吸系统疾病以及恶性肿瘤等疾病患者。根据肺功能检查结果,FEV1占预计值的百分比将临床缓解期40例患者分为4组。轻度组,FEV1% pred≥80%,共5例,平均年龄(65.56±8.23)岁;中度组,50%≤FEV1% pred<80%,共18例,平均年龄(68.30±9.18)岁;重度组,30%≤FEV1% pred<50%,共11例,平均年龄(72.66±9.34)岁。极重度组,FEV1% pred<30%,共6例,平均年龄(75.12±8.54)岁。健康对照组45例,平均年龄(61.24±9.54)岁。COPD组与对照组的年龄、性别、高血压、吸烟、体重等基线资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2方法 所有研究对象于入院24 h内抽取静脉血3 mL,2000 r/min离心20 min收集上层血清,采用双抗体夹心ELISA法测定血清MMP-2、MMP-9、MMP-12含量。检测试剂盒由上海酶联生物技术有限公司提供,严格按照试剂盒操作进行。
1.3统计学处理 采用SPSS 17.0软件对所得数据进行统计分析,计量资料用(±s)表示,比较采用t检验,两因素之间相关性分析采用Pearson直线相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1COPD组与对照组血清MMP-2、MMP-9、MMP-12水平比较 COPD组患者血清MMP-2、MMP-9、MMP-12水平均明显高于对照组,差异均有统计学意义(P<0.05或P<0.01),AECOPD组患者血清MMP-2、MMP-9、MMP-12水平均显著高于临床缓解期组,差异均有统计学意义(P<0.05),见表1。
表1 COPD组与对照组血清MMP-2、MMP-9、MMP-12水平比较(±s) ng/mL
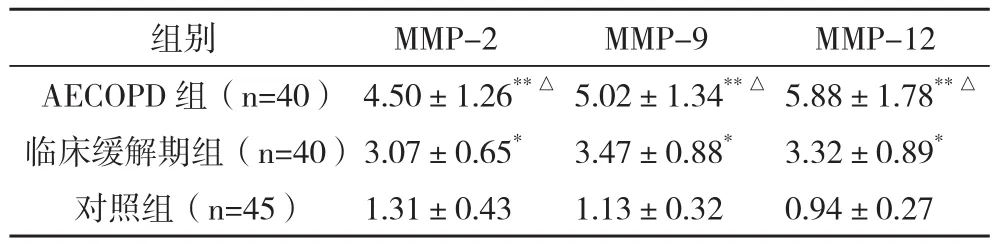
表1 COPD组与对照组血清MMP-2、MMP-9、MMP-12水平比较(±s) ng/mL
*P<0.05,**P<0.01,与对照组比较;△与临床缓解期组比较,P<0.05
组别 MMP-2 MMP-9 MMP-12 AECOPD组(n=40)4.50±1.26**△5.02±1.34**△5.88±1.78**△临床缓解期组(n=40)3.07±0.65* 3.47±0.88* 3.32±0.89*对照组(n=45) 1.31±0.43 1.13±0.32 0.94±0.27
2.2血清MMP-2、MMP-9、MMP-12水平与FEV1相关性分析 稳定期COPD患者血清MMP-2、MMP-9、MMP-12水平与FEV1成负相关(r=-0.529,P<0.01;r=-0.385,P<0.05;r=-0.627,P<0.01),见表2。
表2 血清MMP-2、MMP-9、MMP-12水平与FEV1相关性分析(±s) ng/mL
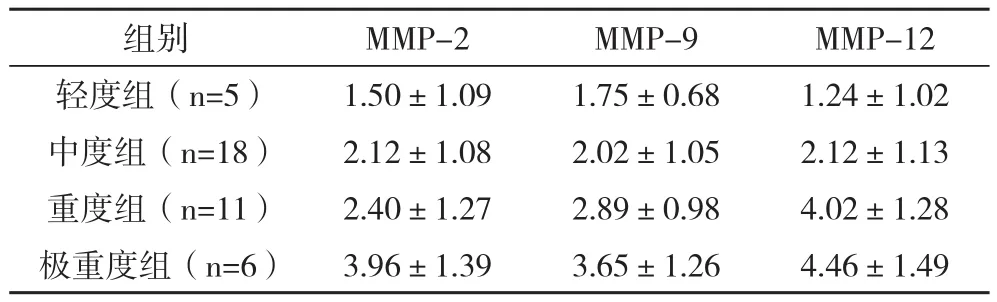
表2 血清MMP-2、MMP-9、MMP-12水平与FEV1相关性分析(±s) ng/mL
组别 MMP-2 MMP-9 MMP-12轻度组(n=5) 1.50±1.09 1.75±0.68 1.24±1.02中度组(n=18) 2.12±1.08 2.02±1.05 2.12±1.13重度组(n=11) 2.40±1.27 2.89±0.98 4.02±1.28极重度组(n=6) 3.96±1.39 3.65±1.26 4.46±1.49
3 讨论
COPD是以ECM破坏、组织纤维化为特点的慢性炎症性疾病,其发病率及致残率高,严重影响患者生活质量,全球死因居于第四位。1992年在我国北部和中部地区对102 230名农村成年人进行调查,COPD患病率为3%;近年来对我国地区20 245名成年人进行调查,COPD的患病率占40岁以上人群的8.2%,预计到2020年时COPD将占世界疾病经济负担的第五位[3]。目前COPD发病机制主要为炎症反应、氧化应激、自主神经功能失调、蛋白酶—抗蛋白酶失衡。Montagnana等[4]认为肺泡壁基底膜断裂,而分泌细胞通过断裂的基底膜侵入肺泡,导致肺泡细支气管化,促进肺气肿形成。现已证明,破坏肺泡壁基底膜的蛋白酶有中性粒细胞弹性蛋白酶、组织蛋白酶、MMPs、基质金属蛋白酶组织抑制剂(TIMPs)等。MMPs是一个大家族,因其需要Ca2+、Zn2+等金属离子作为辅助因子而得名。MMPs 有26个成员,编号分别为MMP1~26。根据作用底物以及片断同源性,将MMPs分为6类,分别为胶原酶、明胶酶、弹性蛋白酶类、间质溶解素、模型蛋白酶类和其他型。它们主要由中性粒细胞(PMN)、肺泡巨噬细胞(AM)和呼吸道上皮细胞产生,能够降解肺实质ECM的所有成分,包括弹性蛋白、胶原蛋白、蛋白多糖、层粘连蛋白和纤维连接蛋白等[5]。胶原酶包括MMP-2、MMP-9,作用底物为基底膜Ⅳ、Ⅴ、Ⅶ、Ⅹ胶原酶,纤维粘连蛋白、明胶等。MMP-12属于弹性蛋白酶类,作用底物为弹性纤维、纤维粘连蛋白等。MMP-2、MMP-9及MMP-12在降解ECM占主要地位[6]。
MMP-9在正常肺组织中并不产生,当受到各种因素刺激时,支气管上皮细胞、肺泡Ⅱ型细胞、成纤维细胞及内皮细胞等均可产生。MMP-9加速呼吸道壁ECM和基底膜崩解,使气道壁失去正常结构,还能促进炎症细胞积聚于气道壁,并释放炎症因子,加重呼吸道的炎性反应[7]。它还能刺激并激活生长因子,促进血管生成、成纤维细胞增生,引起气道重塑,导致肺组织的破坏。Calikoglu等[8]研究发现稳定期COPD患者血清MMP-9水平高于正常对照组,发现大部分COPD患者的血液、痰液以及肺组织活检中MMP-9的水平与活性均较高。Papakonstantinou等[9]纳入97例COPD患者进行试验,其中44例为AECOPD,测定COPD患者MMP9、TIMP-1、TIMP-2含量、结构,AECOPD患者支气管肺泡灌洗液中上述指标均显著升高,且与肺功能呈负相关。Linder等[10]入选594例COPD患者进行研究,对照组为948例健康者,结果COPD 组MMP-9中位数535 ng/mL,对照组为505 ng/mL (P=0.017)。校正年龄、性别、吸烟量等后,发现MMP-9水平与FEV1%显著相关(P=0.033)。吸烟是COPD发病中最主要的危险因素,研究表明80%~90%的COPD患者有吸烟史,而MMP-9与吸烟的相关性也得到证实:吸烟在COPD的发病机制中作为直接刺激因素,有可能导致蛋白酶增多及活性增强。Aviles等[11]报道,COPD患者痰液中MMP-9的浓度显著高于健康吸烟者,健康吸烟者痰液中MMP-9浓度高于健康非吸烟者,且该浓度与他们吸烟量有一定相关性。MMP-2在正常肺组织中表达极少,主要来源于中性粒细胞、肿瘤细胞、单核细胞、巨噬细胞、血管内皮细胞等[12],其在降解细胞间基质成分及基底膜的Ⅳ型胶原中有“钻头”的作用。MMP-2在所有MMPs中分布最广泛,当组织受损或细胞恶变时MMP-2表达增加,其表达增加同时伴有蛋白水解酶活性增强,而后者加速了肺泡壁的破坏。Chen等[13]报道健康人与COPD 0、Ⅰ、ⅡA、ⅡB及Ⅲ级五组MMP-2水平分别为(0.7±0.4)、(4.0±0.9)、(4.5±1.5)、(7.7±3.1)、(11.9±3.5)、(18.5±5.0)microg/L(P<0.01)。王小莉等[14]研究表明,被动吸烟大鼠支气管肺泡灌洗液MMP-2的活性和表达明显增加(P<0.01)。孔英君等[15]研究MMP-2、MMP-9与COPD气流阻塞的关系,结果COPD组MMP-2、MMP-9 mRNA均显著高于对照组(P<0.01)。MMP-2、MMP-9蛋白广泛表达在支气管肺泡组织,而对照组表达非常弱;肺组织MMP-2mRNA及蛋白表达与FEV1占预计值%、FEV1/FVC均呈负相关。
MMP-12又被称为人巨噬细胞弹性蛋白酶,体内许多细胞因子(如白介素-4、粒细胞集落刺激因子、低密度脂蛋白)均能诱导或刺激MMP-12在转录水平的表达,其具体激活机制目前还不清楚。1993年Shapiro等[16]成功在吸烟者的肺泡巨噬细胞中克隆出MMP-12的cDNA序列。MMP-12不仅能够降解富含于肺及动脉壁的细胞外基质的大多数成分,还能激活其他MMPs,使蛋白水解的作用放大[17]。1975年Werb等[18]首次在小鼠腹膜巨噬细胞中发现MMP-12基因;敲掉该小鼠的MMP12基因则能够阻止吸烟小鼠的肺气肿模型形成,认为MMP-12在动物COPD发生发展过程中起重要作用。Hunninghake等[19]报道MMP-12与吸烟者的COPD发病有关,且与COPD患者FEV1下降存在一定关系。Demedts等[20]发现肺功能轻到中度的COPD患者痰液中MMP-12浓度及活性明显高于对照组(包括吸烟者、不吸烟者以及既往吸烟者)。Yu等[21]的试验通过对1751例COPD患者及2472例健康者研究发现,MMP12 rs652438基因为COPD发生的危险因素,MMP12基因多态性与COPD发生密切相关。
综上所述,MMPs作为细胞外弹性蛋白和胶原蛋白的内切酶,与COPD的发生有密切关系。通过本试验验证了MMP-2、MMP-9、MMP-12在COPD患者中显著升高,其升高水平与肺功能严重程度成正相关。TIMPs与MMPs基因多态性在COPD发生发展过程中又起到怎样的作用,尚需要大量的临床研究来证实,从而为COPD的防治提供理论基础及临床依据。而TIMPs有望成为延缓COPD进展的有效手段之一[6]。
参考文献
[1]王煜.金属基质蛋白酶及其在慢性阻塞性肺疾病中的应用[J].疑难病杂志,2011,10(5):394-397.
[2]黄俊芳,王广发.慢性阻塞性肺疾病全球倡议慢性阻塞性肺疾病指南(2013年更新版)解读[J].中国医学前沿杂志,2013,5(3):58-60.
[3]葛均波,徐永健.内科学[M].第8版.北京:人民卫生出版社,2013:1-10.
[4] Montagnana M,Lippi G,Albiero A,et al.Evaluation of metalloproteinases 2 and 9 and their inhibitors in physiologic and preeclamptic pregnancy[J].Clin Lab Anal,2009,23(2):88-92.
[5] Lagente V,Boichot E.Role of matrix metalloproteinases in the inflammatory process of respiratory diseases[J].J Mol Cell Cardiol,2010,48(3):440-444.
[6] Srivastava P K,Dastidar S G,Ray A.Chronic obstructive pulmonary disease:role of matrix metalloproteases and future challenges of drug therapy[J].Expert Opin Investig Drugs,2007,16(7):1069-1078.
[7] Woode D,Shiomi T,D'Armiento J.Collagenolytic matrix metalloproteinases in chronic obstructive lung disease and cancer[J].Cancers (Basel),2015,7(1):329-341.
[8] Calikoglu M,Vnln A,Tamer L,et al.MMP-9 and TIMP-1 levels in the sputum of patients with chronie obstructive pulmonary disease and asthma[J].Tuberk Torakes,2006,54(2):114-121.
[9] Papakonstantinou E,Karakiulakis G,Batzios S,et al.Acute exacerbations of COPD are associated with significant activation of matrix metalloproteinase 9 irrespectively of airway obstruction,emphysema and infection[J].Respir Res,2015,16(1):78.
[10] Linder R,Rönmark E,Pourazar J,et al.Serum metalloproteinase-9 is related to COPD severity and symptoms-cross-sectional data from a population based cohort-study[J].Respir Res,2015,16 (1):28.
[11] Aviles B,Belda J,Margarit G,et al.Markers of airway remodeling in induced sputum from healthy smokers[J].Arch Bronconeuol,2006,42(5):235-240.
[12]刘江,何建方,施柏年,等.慢性肝病患者血清基质金属蛋白酶-2和基质金属蛋白酶-2组织抑制因子与肝纤维化指标的关系[J].临床内科杂志,2005,22(8):522-524.
[13] Chen Y,Chen P.Expressions of cyclooxygenase-2 and matrix metalloproteinase-2 and airflow obstruction in patients with chronic obstructive pulmonary disease[J].Chinese Journal of Tuberculosis and Respiratory Diseases,2005,28(5):324-327.
[14]王小莉,石莺,龚兴牡.MMP-2在实验性大鼠慢性阻塞性肺疾病的表达及意义[J].临床肺科杂志,2010,15(5):608-609.
[15]孔英君,石玉枝,霍建民,等.慢性阻塞性肺疾病患者肺组织基质金属蛋白酶2、9的表达与气流阻塞的关系[J].中华结核和呼吸杂志,2006,29(6):417-418.
[16] Shapiro S D,Kobayashi D K,Ley T J.Cloning and characterization of a unique elastolytic metalloproteinase produced by human alveolar macrophages[J].J Biol Chem,1993,268(32):23 824-23 829.
[17] Mocchegiani E,Giacconi R,Costarelli L.Metalloproteases/antimetalloproteases imbalance in chronic obstructive pulmonary disease:genetic factors and treatment implications[J].Curr Opin Pulm Med,2011,17(Suppl 1):S11-S19.
[18] Werb Z,Gordon S.Elastase secretion by stimulated macrophages. Characterization and regulation[J].J Exp Med,1975,142(2):361-377.
[19] Hunninghake G M,Cho M H,Tesfaigzi Y,et al.MMP12,lung function,and COPD in high-risk populations[J].N Engl J Med,2009,361(27):2599-2608.
[20] Demedts I K,Morel-Montero A,Lebecque S,et al.Elevated MMP12 protein levels in induced sputum from patients with COPD[J].Thorax,2006,61(3):196-201.
[21] Yu X L,Zhang J,Zhao F,et al.Relationships of COX2 and MMP12 genetic polymorphisms with chronic obstructive pulmonary disease risk:a meta-analysis[J].Mol Biol Rep,2014,41(12):8149-8162.
Clinical Research of Matrix Metalloproteinase 2,9,12 with Chronic Obstructive Pulmonary Disease
/LI Min,WANG YU-hong,LI Wei.//Medical Innovation of China,2016,13(02):044-047
【Abstract】Objective:To investigate the correlation of patients with chronic obstructive pulmonary disease(COPD) with matrix metalloproteinase2(MMP-2),matrix metalloproteinase9(MMP-9) and matrix metalloproteinase 12(MMP-12) in the serum.Method:Double-antibody sandwich method (ELISA) was used to measure the concentrations of MMP-2,MMP-9,MMP-12 in the serum of 80 patients with COPD,including acute exacerbation (AECOPD) for 40 cases and clinical remission for 40 cases.45 healthy people were selected as the healthy control group.The statistical analysis was conducted.Result:The concentrations of MMP-2,MMP-9,MMP-12 in patients with COPD were significantly higher than those of the healthy control group,the differences were statistically significant(P<0.05 or P<0.01).These index in AECOPD group were significantly higher than those in the clinical remission group(P<0.01).The concentrations of MMP-2,MMP-9,MMP-12 in stable COPD patients were passively correlated with forced expiratory volume in first second(FEV1)(r=-0.529,P<0.01;r=-0.385,P<0.05;r=-0.627,P<0.01).Conclusion:The serum level of MMP-2,MMP-9,MMP-12 in COPD patients are obviously higher,and they are positively correlated with the severity of the disease.
收稿日期:(2015-07-17) (本文编辑:欧丽)
doi:10.3969/j.issn.1674-4985.2016.02.013
通信作者:李敏

