rh-bFGF对兔视网膜缺血再灌注损伤的保护作用及其机制
邵宏超,葛嫣然,刘岩,苏杰,田华
(华北理工大学附属医院,河北唐山063000)
rh-bFGF对兔视网膜缺血再灌注损伤的保护作用及其机制
邵宏超,葛嫣然,刘岩,苏杰,田华
(华北理工大学附属医院,河北唐山063000)
摘要:目的研究重组人碱性成纤维细胞生长因子(rh-bFGF)对兔视网膜缺血再灌注损伤(RIRI)的保护作用,并探讨其作用机制。方法 66只雄性体健大耳白兔随机分为3组:A组为RIRI组(30只)、B组为RIRI+rh-bFGF组(30只)、C组为正常假手术组(6只),A、B组按6、12、24、48、72 h 5个时间点又随机分为5组,每组6只。造模初期,分别往A、B组实验动物玻璃体腔内注入相同剂量的生理盐水和rh-bFGF溶液,并分别于制模后5个时间点处死动物摘取眼球,制作视网膜标本。C组实验动物给予前房穿刺,处死并摘除眼球。组织标本常规HE染色后观察各组兔视网膜组织病理学变化,免疫组化法检测c-Fos、c-Jun阳性细胞数。结果C组兔视网膜各层次清晰、细胞平行排列且形态规则,视网膜神经节细胞呈单层排列、规则,无空泡变性。A组兔视网膜出现高度水肿,层次紊乱、细胞结构疏松,视网膜神经节细胞出现空泡样变性,神经节细胞数目减少。B组兔视网膜结构层次和细胞组织变化与A组变化大致相同,但其损害程度较A组明显减轻。C组兔视网膜中未发现c-Fos、c-Jun表达;与A组比较,B组RIRI后5个时间点视网膜组织中 c-Fos、c-Jun阳性细胞数减少(P均<0.05)。结论 rh-bFGF对兔视网膜RIRI有保护作用,其机制可能与抑制c-Fos、c-Jun的表达有关。
关键词:缺血再灌注损伤;重组人碱性成纤维细胞生长因子;视网膜;c-Fos;c-Jun;兔
以视网膜缺血再灌注损伤(RIRI)为病理生理过程的一类疾病是临床诊疗过程中常见的视功能损伤性疾病,严重者可导致视功能不可逆性损伤[1]。目前研究认为其损害机制是多方面的[2],作为重要的早期应答基因,c-Fos、c-Jun被认为与细胞凋亡密切相关[3]。rh-bFGF是一种具有多种生物活性的神经营养因子。最新研究表明,其能有效减少缺血再灌注后受损神经细胞的凋亡,但机制欠清楚[4、5]。本实验通过建造兔RIRI模型,并于玻璃体腔内注射rh-bFGF后,观察rh-bFGF对c-Fos、c-Jun表达的影响,进一步探讨rh-bFGF对RIRI保护作用的可能机制。
1材料与方法
1.1材料实验动物:66只雄性体健大耳白兔,购自本院动物中心,外眼及眼底正常者纳入试验,体质量(2.5±0.2)kg。动物饲养于相同生长环境。66只大耳白兔被随机分为3组:A组为RIRI组(30只)、B组为RIRI+rh-bFGF组(30只)、C组为正常假手术组(6只)。A、B组按6、12、24、48、72 h 5个时间点又随机分为5组,每组6只。主要试剂:rh-bFGF由上海西塘生物科技有限公司提供,c-Fos单克隆抗体、c-Jun单克隆抗体均由武汉博士德生物工程有限公司提供。
1.2兔RIRI模型制备及rh-bFGF干预A、B组均制备RIRI模型。建立RIRI模型前,A组和B组分别往兔玻璃体内注射相同剂量生理盐水和rh-bFGF溶液。RIRI模型的建立采取前房加压灌注法:以1 g/L的乌拉坦5 mg/kg注射兔耳缘静脉,麻醉成功后固定于实验台上,均选取左眼造模,A、B组给予散瞳药散开瞳孔,准备一端连有5号头皮针、另一端连接生理盐水输液瓶,将头皮针沿角巩膜缘处穿刺入前房,将输液瓶高度缓慢升高使其产生16.7 kPa压力[5]。观察可见:球结膜、虹膜颜色变苍白,视网膜明显水肿且苍白。60 min后缓慢降低输液瓶高度至动物眼水平,此时球结膜、虹膜颜色恢复正常,视网膜血供恢复橘红色,提示RIRI造模成功[6]。C组实验动物给予前房穿刺,无其他操作。
1.3视网膜组织病理学变化的观察及c-Fos、c-Jun表达的检测 C组动物处死并摘除眼球。A、B组于制模后5个时间点处死并摘除眼球,组织标本给予行HE染色和免疫组化染色。HE染色:烘干切片,脱蜡,乙醇复水,每个浓度2 min。苏木素染色,0.5%盐酸乙醇分化,1%氨水泛蓝,1%伊红染色,之后乙醇脱水,各浓度2 min。二甲苯透明,中性树胶封片。光学显微镜下观察兔视网膜各层组织结构变化。c-Fos、c-Jun的检测采用SABC免疫组织化学法。切片常规脱蜡至水,然后加入H2O2灭活内源性酶,再加入山羊血清封闭液。之后顺次加入一抗、二抗,SABC、DAB显色,苏木素轻度复染,脱水,透明,封片。显微镜下观察c-Fos、c-Jun表达。每只眼球随机选取4张不同的切片,每张切片随机取4个不同的视野,由各视野的阳性细胞数算出平均值。
2结果
2.1兔RIRI后视网膜组织病理学变化显微镜下C组兔视网膜各层次清晰、细胞结构规整,呈平行排列,视网膜神经节细胞(RGC)呈单层排列、规则,无空泡变性。A组兔视网膜出现高度水肿,层次紊乱、细胞结构疏松, RGC出现空泡样变性,神经节细胞数目减少。B组兔视网膜结构层次和细胞组织变化与A组变化大致相同,但其损害程度较A组明显减轻。
2.2兔视网膜组织中c-Fos、c-Jun蛋白的表达详见表1。
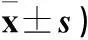
表1 各组兔视网膜组织中c-Fos、c-Jun阳性
注:与B组同时间比较,*P<0.05;与A、B组同时间比较,**P<0.01;与同组6 h比较,△P<0.05;与同组12 h比较,▲P<0.05;与同组24 h比较,☆P<0.05;与同组48 h比较,★P<0.05。
3讨论
研究发现,RIRI可通过诱导RGC发生凋亡,继而导致视网膜不可逆性伤害。临床上视网膜急性缺血性疾病经过治疗后,视网膜细胞在缺血损伤后再次进行再灌注,视功能未得到提高反而会进一步损害[7]。本研究结果显示,C组兔视网膜各层次清晰、细胞结构规整、RGC呈单层排列、无空泡变性。A组视网膜出现了损伤改变,B组轻于A组。提示rh-bFGF对RIRI有保护作用。
细胞凋亡是个复杂的过程,同时受许多凋亡基因及抗凋亡基因调控[8],其中c-Fos、c-Jun被认为是两个重要的凋亡调控基因[9]。Otori等[10]发现细胞变性和RIRI组织中存在c-Fos、c-Jun的阳性表达。在哺乳动物中,FOS 家族(c-Fos、FosB、Fra-1、Fra-2)和JUN 家族(c-Jun、JunB、JunD) 共同组成激活蛋白1(AP-1) ,AP-1 以同源或异源二聚体的形式发挥作用[11]。生理条件下,细胞中AP-1 以同源二聚体为主发挥作用,活性表达很低;当细胞受到生理和病理因素刺激时,AP-1会以异源二聚体为主要形式发挥作用,与基因中的AP-1调节位点紧密结合并激活靶基因,参与细胞凋亡以及对细胞损伤的反应,其表达水平及活性明显增加[12]。RIRI可激活细胞内信号转导途径,促进c-Jun、c-Fos基因的表达,并进一步激活AP-1,诱导执行凋亡相关酶类与蛋白的表达,最后导致细胞凋亡、解体、死亡。
rh-bFGF是一种重要的神经营养因子[13]。它与相应受体结合后,诱导内皮细胞迁移、促进毛细血管增生,形成胶原纤维;可使血管细胞快速分裂增殖,进而改善组织局部的微循环和组织的营养代谢状况[14]。本实验中视网膜RIRI后给予玻璃体腔内注入rh-bFGF,可使凋亡基因c-Fos、c-Jun蛋白的阳性表达下降,从而减少神经细胞凋亡数量,这可能是rh-bFGF治疗RIRI的作用机制之一,为rh-bFGF能进一步应用于临床治疗视网膜缺血再灌注疾病提供了依据。
参考文献:
[1] Wang XD, Kashii S, Zhao L, et al. Vitamin B6protects primate retinal neurons from ischemic injury[J]. Brain Res, 2002,940(1-2):36-43.
[2] 赵成,游志鹏.视网膜缺血再灌注损伤的治疗进展[J].国际眼科杂志,2007,7(2):475-477.
[3] Smeyne RJ, Vendrell M, Hayward M, et al. Continuous c-fos expression precedes programmed cell death in vivo[J]. Nature, 1993,363(6425):166-169.
[4] 曾环想,张宏波,黄凯,等.碱性成纤维细胞生长因子的药学研究进展[J].中国新药杂志,2010,19(11):949-952.
[5] 王小兵,王晓健,张宝林.不同浓度的重组人碱性成纤维细胞生长因子对离体人表皮细胞增殖的影响[J].中国药物与临床,2008,8(12):969-970.
[6] Foulds WS, Johnson NF. Rabbit electroretinogram during recovery from induced ischaemia[J]. Trans Ophthalmol Soc U K, 1974,94(2):383-393.
[7] 刘朋朋,张琦.外源性H2S预处理对大鼠RIRI细胞凋亡的影响[J].国际眼科杂志,2012,12(1):33-35.
[8] Miyaki K, Matsubara A, Nishiwaki A, et al. Pitavastatin attenuates
中图分类号:R774
文献标志码:A
文章编号:1002-266X(2016)01-0038-03
doi:10.3969/j.issn.1002-266X.2016.01.013
基金项目:唐山市科技计划项目(12140209A-45)。

