小鼠皮肤损伤愈合过程中PI3K/Akt通路的作用
高彦令,刘长胜,赵 锐,王林林,李姗姗,刘 敏,张 淼,姜述堃,田志岭,王 檬,官大威(.中国医科大学法医学院法医病理学教研室,辽宁沈阳000;2.苏州市公安局刑警支队,江苏苏州25000;.鞍山市人民检察院技术处,辽宁鞍山400)
小鼠皮肤损伤愈合过程中PI3K/Akt通路的作用
高彦令1,2,刘长胜3,赵锐1,王林林1,李姗姗1,刘敏1,张淼1,姜述堃1,田志岭1,王檬1,官大威1
(1.中国医科大学法医学院法医病理学教研室,辽宁沈阳110001;2.苏州市公安局刑警支队,江苏苏州215000;3.鞍山市人民检察院技术处,辽宁鞍山114001)
摘要:目的探讨小鼠皮肤损伤愈合过程中损伤区磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、磷酸化磷脂酰肌醇-3-激酶(phospho-PI3K,p-PI3K)、蛋白激酶B(protein kinase B,PKB,又称Akt)和磷酸化蛋白激酶B(phospho-Akt,p-Akt)的表达及其随时间的变化规律。方法应用免疫组织化学染色、Western印迹法和real-time PCR技术检测小鼠皮肤损伤不同时间段PI3K、Akt、p-PI3K及p-Akt的变化情况。结果免疫组织化学染色显示,皮肤损伤后,PI3K、p-Akt阳性染色出现在单核细胞和成纤维细胞,峰值出现在组织修复期。Western印迹法显示,各个时间段均有PI3K、p-PI3K、Akt、p-Akt的阳性条带,其中p-PI3K、p-Akt表达的峰值出现在炎症期和增生期,PI3K、Akt表达的高峰出现在组织重建期。real-time PCR结果显示,PI3K mRNA的峰值出现在炎症期和组织重建期,Akt mRNA的峰值出现在组织重建期。结论在皮肤损伤愈合过程中,PI3K、Akt、p-PI3K及p-Akt的表达变化呈现不同的规律性并有较好的时间依赖性,PI3K/Akt通路的表达规律可以用于法医学损伤时间推断。
关键词:法医病理学;创伤和损伤;皮肤;磷脂酰肌醇-3-激酶;磷酸化磷脂酰肌醇-3-激酶;蛋白激酶B;磷酸化蛋白激酶B;小鼠
皮肤损伤愈合过程包括炎症期、增生期和组织重建期[1]。在这期间,中性粒细胞、单核细胞和成纤维细胞是重要的效应细胞,中性粒细胞和单核细胞发挥的是清除异物及坏死物质的作用,而成纤维细胞发挥的是组织修复的作用。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称Akt)是细胞内重要的信号传导通路,参与细胞增殖、分化和凋亡等多种生物过程[2]。研究[3]表明,该信号通路在皮肤损伤愈合过程中发挥重要的调节作用。本研究在建立小鼠不同时间皮肤损伤模型基础上,应用免疫组织化学染色、Western印迹法和real-time PCR技术检测PI3K、Akt、磷酸化磷脂酰肌醇-3-激酶(phospho-PI3K,p-PI3K)、磷酸化蛋白激酶B(phospho-Akt,p-Akt)的表达及其随时间的变化,探讨PI3K/Akt通路应用于损伤时间推断的可行性。
1材料与方法
1.1主要试剂和仪器
山羊抗小鼠p-PI3K多克隆抗体、兔抗小鼠p-Akt多克隆抗体(sc-12929、sc-101629)、小鼠抗β-actin单克隆抗体、兔抗山羊IgG、山羊抗兔IgG、山羊抗小鼠IgG、ECL发光液(美国Santa Cruz公司)。兔抗小鼠PI3K多克隆抗体、兔抗小鼠Akt多克隆抗体、小鼠源p-Akt单克隆抗体(美国Proteintech公司)。PV-9001兔超敏检测试剂盒、DAB显色剂(北京中杉金桥生物有限公司),6条带预染Marker(加拿大Fermentas公司),Western印迹法及IP细胞裂解液(上海碧云天生物技术有限公司)。PI3K、Akt、β-actin引物、RNA PCR试剂盒(日本Takara公司)。Trizol试剂盒(美国Invitrogen公司)。
DM3000显微镜(德国Leica公司),Tanon 5500全自动化学发光图像分析系统(上海天能科技有限公司),7500 Real-Time PCR系统(美国AB公司)。
1.2动物模型制作及分组
健康成年清洁级昆明系雄性小鼠50只,体质量35~40g,随机分为伤后1、3、5、7、9、11、13、17、21d组和对照组,每组5只。损伤动物模型于腹腔注射1%戊巴比妥钠溶液(175mg/kg)麻醉,背部剃毛处理,碘伏消毒后,在背部中央、脊柱两侧对称处用打孔器打2个内径6mm皮肤全层厚的圆孔,创面自然止血,不包扎,不施药。损伤后每只小鼠给予清洁饲料及蒸馏水,分笼饲养,并保持创面干燥,防止感染。分别于伤后1、3、5、7、9、11、13、17、21d腹腔注射2%戊巴比妥钠溶液(350 mg/kg)处死小鼠,取损伤处皮肤组织1cm×1cm。对照组小鼠不做皮肤打孔,取相同部位同等大小皮肤。
1.3组织病理学检验
每组1/2皮肤组织放入4%多聚甲醛-PBS溶液中固定12h后,乙醇脱水,二甲苯透明,石蜡包埋,制作5μm厚度连续切片。
1.3.1 HE染色
切片脱蜡,水化,苏木素染色5min,在1%盐酸-乙醇溶液中分化数秒,自来水中返蓝30 min,1%伊红染色3min,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.3.2免疫组织化学染色
切片脱蜡,水化,微波抗原修复后用3% H2O2孵育,分别用兔抗小鼠PI3K多克隆抗体(1∶300)和兔抗小鼠p-Akt多克隆抗体(1∶100)作为一抗,应用SP超敏二步法进行免疫组织化学染色,DAB显色,苏木素核复染。染色中以PBS代替一抗作为空白对照。
1.4 Western印迹法检测
冰浴(4℃)下将各时间段另1/2皮肤组织剪碎,加入组织裂解液300 μL,其中苯甲基磺酰氟(PMSF)浓度为1mmol/L,匀浆,超声破碎后,4℃下以离心半径9.35cm,12000r/min,离心15min,提取上清液,用BCA法测量蛋白浓度,将蛋白置于-80℃保存,备用。变性后,总蛋白量为30μg。10% SDS-PAGE凝胶电泳分离蛋白后,湿转法将蛋白转移到PVDF膜上。TBST洗涤3次,用5%脱脂牛奶封闭2h,分别用山羊抗小鼠p-PI3K多克隆抗体(1∶100)、兔抗小鼠PI3K多克隆抗体(1∶800),兔抗小鼠Akt多克隆抗体(1∶600)、小鼠源p-Akt单克隆抗体(1∶2000)孵育,4℃过夜。TBST洗涤3次后,分别与山羊抗小鼠IgG二抗(1∶5 000)、山羊抗兔IgG二抗(1∶5000)、山羊抗小鼠IgG(1∶5000)室温孵育2h,TBST洗涤3次,ECL发光。
1.5 real-time PCR技术检测
冰上取各组小鼠损伤区皮肤,按试剂盒说明书进行总mRNA提取,然后以逆转录法先合成cDNA,再进行real-time PCR检测。用Primer Express 5软件查找PI3K、β-actin引物,Akt引物按照文献[4]进行合成,引物序列见表1。应用PRISM®7500 Real-Time PCR系统进行扩增。20 μL反应体系组成:SYBR® Premix Ex Taq(2×)10μL,ROX DyeⅡ0.4μL,去离子水6μL,PCR上游引物0.8μL,PCR下游引物0.8μL,cDNA 2 μL。两步法PCR扩增标准程序:95℃30 s,1个循环;95℃5s,60℃34s,40个循环;95℃15s,60℃30s,95℃15s,1个循环。采集荧光信号,绘制溶解曲线。

表1 real-time PCR引物序列
1.6结果分析
1.6.1免疫组织化学染色
PI3K、p-Akt阳性表达位于胞质及胞核,用DAB显色呈棕黄色。显微镜(×400)下,在每张切片损伤及其周边区(距损伤区200μm范围内)随机选择10个视野,计算多核粒细胞、单核细胞及成纤维细胞的阳性细胞数及与三种细胞总数的比值(阳性细胞率)。应用Image pro plus 6.0图像分析软件计算所选视野的积分光密度(IOD)。
1.6.2 Western印迹法
应用Tanon 5500全自动化学发光图像分析系统进行谱带分析和光密度值测定。
1.6.3 real-time PCR技术
real-time PCR结果由PRISM®7500 Real-Time PCR系统自动采集给出PI3K、Akt基因的相对含量。
1.7统计学分析
采用SPSS 13.0软件,应用方差分析对数据进行统计学处理,组间比较用t检验,数据应用x±s表示,检验水准α=0.05。
2结 果
2.1 HE染色
伤后1d,损伤区内可见大量炎症细胞浸润,以多核粒细胞和单核细胞为主;伤后3d,肉芽组织形成,中性粒细胞明显减少,可见大量单核细胞和成纤维细胞;伤后7d,肉芽组织内可见大量长梭形细胞核管腔样结构;伤后11~13d,损伤基本愈合,损伤及其周边区内中性粒细胞、单核细胞及成纤维细胞逐渐减少,间质增多,肉芽组织向瘢痕组织转变;伤后21d,损伤完全愈合,细胞排列紧密,与13d相比,无明显变化。
2.2免疫组织化学染色及阳性细胞率、积分光密度值
对照组小鼠皮肤组织内,表皮、毛囊、皮脂腺、皮肌层表达PI3K、p-Akt。
伤后1d,PI3K主要表达于多核粒细胞和部分单核细胞;3~5 d,单核细胞逐渐增多,成纤维细胞开始出现,其阳性染色集中于单核细胞及成纤维细胞,并于5d阳性细胞率达到高峰;7~11d,PI3K阳性染色以成纤维细胞为主,积分光密度值达到峰值;13~21 d,损伤愈合,损伤及其周边区成纤维细胞逐渐减少,以瘢痕组织代替(图1,表2)。
伤后1 d,p-Akt主要表达于多核粒细胞和部分单核细胞;3~5d,其阳性染色集中于单核细胞和成纤维细胞,阳性细胞率逐渐升高;7~11 d,p-Akt阳性染色以成纤维细胞为主,并于7d阳性细胞率达到高峰;13~21 d,损伤愈合,p-Akt积分光密度值降低(图2,表2)。
2.3 Western印迹法
以β-actin(相对分子质量4.3×104)为内参,PI3K、p-PI3K、Akt、p-Akt在对照组及各损伤组均有阳性条带,分别位于1.26×105、8.5×104、6.2×104、6.6×104处,且表达强度具有一定规律。伤后1d,PI3K表达强度略有下降;3~11 d,表达逐渐增强,并于11 d达到峰值;随后表达逐渐减弱。伤后1~3d,p-PI3K表达强度逐渐增强,3 d达到峰值;随后表达逐渐减弱。伤后1d,Akt蛋白表达略有下降;3~13d,表达逐渐升高,在13d达到峰值;随后表达逐渐降低。伤后1d,p-Akt蛋白表达达到峰值;随后表达逐渐降低(表3,图3~4)。
表2小鼠皮肤损伤后各时间段PI3K、p-Akt的阳性细胞率和积分光密度值 (n=5,±s)
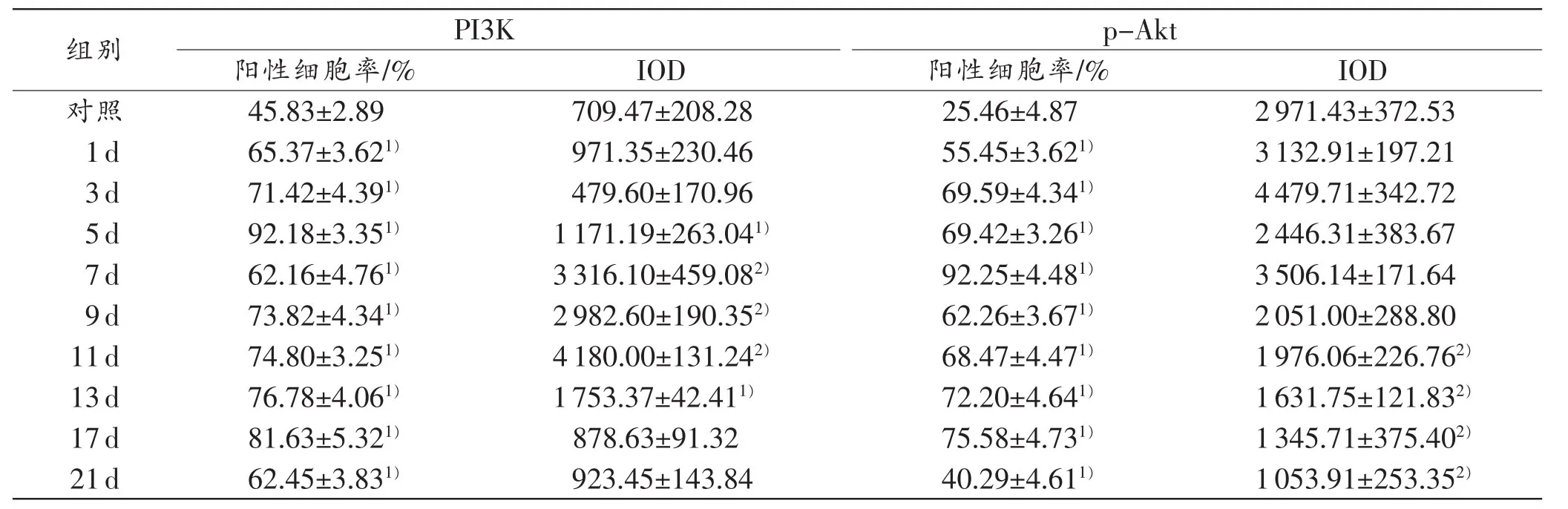
表2小鼠皮肤损伤后各时间段PI3K、p-Akt的阳性细胞率和积分光密度值 (n=5,±s)
注:1)与相邻上组比较,P<0.05;2)与对照组比较,P<0.05
组别 PI3K p-Akt阳性细胞率/% IOD 阳性细胞率/% IOD对照 45.83±2.89 709.47±208.28 25.46±4.87 2971.43±372.53 1d 65.37±3.621) 971.35±230.46 55.45±3.621) 3132.91±197.21 3d 71.42±4.391) 479.60±170.96 69.59±4.341) 4479.71±342.72 5d 92.18±3.351) 1171.19±263.041) 69.42±3.261) 2446.31±383.67 7d 62.16±4.761) 3316.10±459.082) 92.25±4.481) 3506.14±171.64 9d 73.82±4.341) 2982.60±190.352) 62.26±3.671) 2051.00±288.80 11d 74.80±3.251) 4180.00±131.242) 68.47±4.471) 1976.06±226.762)13d 76.78±4.061) 1753.37±42.411) 72.20±4.641) 1631.75±121.832)17d 81.63±5.321) 878.63±91.32 75.58±4.731) 1345.71±375.402)21d 62.45±3.831) 923.45±143.84 40.29±4.611) 1053.91±253.352)
表3小鼠皮肤损伤后各时间段Western印迹法检测PI3K、p-PI3K、Akt、p-Akt的平均光密度值(n=5,±s)
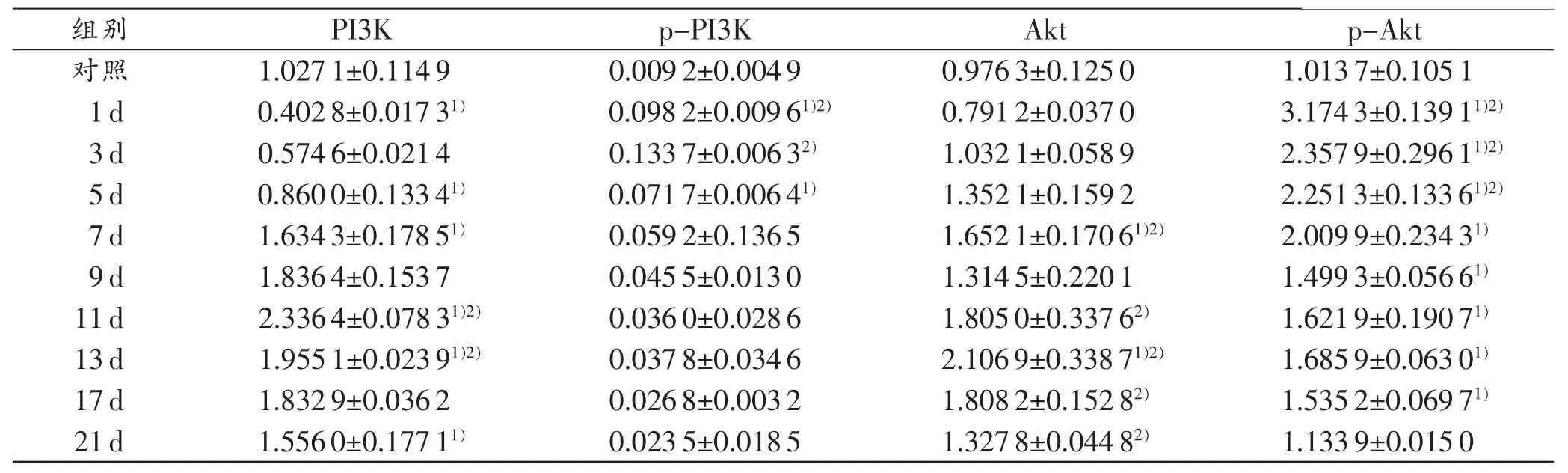
表3小鼠皮肤损伤后各时间段Western印迹法检测PI3K、p-PI3K、Akt、p-Akt的平均光密度值(n=5,±s)
注:1)与相邻上组比较,P<0.05;2)与对照组比较,P<0.05
组别 PI3K p-PI3K Akt p-Akt对照 1.0271±0.1149 0.0092±0.0049 0.9763±0.1250 1.0137±0.1051 1d 0.4028±0.01731) 0.0982±0.00961)2) 0.7912±0.0370 3.1743±0.13911)2)3d 0.5746±0.0214 0.1337±0.00632) 1.0321±0.0589 2.3579±0.29611)2)5d 0.8600±0.13341) 0.0717±0.00641) 1.3521±0.1592 2.2513±0.13361)2)7d 1.6343±0.17851) 0.0592±0.1365 1.6521±0.17061)2) 2.0099±0.23431)9d 1.8364±0.1537 0.0455±0.0130 1.3145±0.2201 1.4993±0.05661)11d 2.3364±0.07831)2) 0.0360±0.0286 1.8050±0.33762) 1.6219±0.19071)13d 1.9551±0.02391)2) 0.0378±0.0346 2.1069±0.33871)2) 1.6859±0.06301)17d 1.8329±0.0362 0.0268±0.0032 1.8082±0.15282) 1.5352±0.06971)21d 1.5560±0.17711) 0.0235±0.0185 1.3278±0.04482) 1.1339±0.0150
2.4 real-time PCR技术
以β-actin为对照,实时定量PCR结果由PRISM® 7500 Real-Time PCR自动采集并给出PI3K、Akt基因的相对含量。损伤组各时间段PI3K mRNA和Akt mRNA的表达水平变化具有一定规律。伤后1d,PI3K mRNA表达第一次达到峰值;3d略有下降;5~11d表达逐渐升高,于11d再次达到峰值;随后表达逐渐下降。伤后1~9d,Akt mRNA表达逐渐升高,于9d达到峰值;随后表达逐渐下降(表4)。
表4小鼠皮肤损伤后各时间段real-time PCR技术检测PI3K、Akt的mRNA相对含量(n=5,±s)
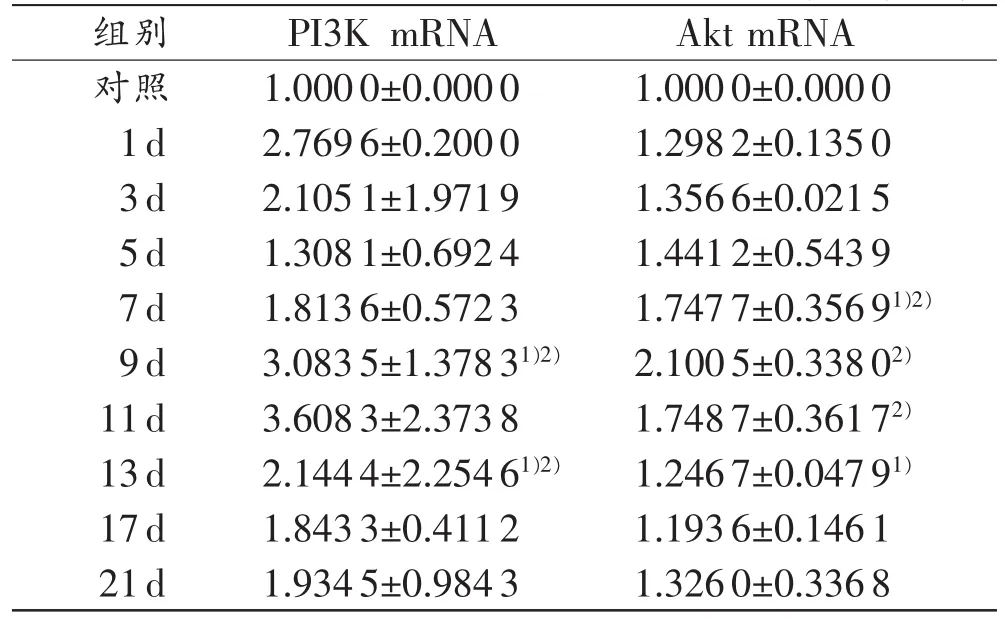
表4小鼠皮肤损伤后各时间段real-time PCR技术检测PI3K、Akt的mRNA相对含量(n=5,±s)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05
组别 PI3K mRNA Akt mRNA对照 1.0000±0.0000 1.0000±0.0000 1d 2.7696±0.2000 1.2982±0.1350 3d 2.1051±1.9719 1.3566±0.0215 5d 1.3081±0.6924 1.4412±0.5439 7d 1.8136±0.5723 1.7477±0.35691)2)9d 3.0835±1.37831)2) 2.1005±0.33802)11d 3.6083±2.3738 1.7487±0.36172)13d 2.1444±2.25461)2) 1.2467±0.04791)17d 1.8433±0.4112 1.1936±0.1461 21d 1.9345±0.9843 1.3260±0.3368
3讨 论
当细胞受到细胞因子、理化因素等刺激时,PI3K/Akt信号通路激活,参与调节细胞增殖、分化和凋亡的过程[5]。目前,针对PI3K/Akt的研究大多通过检测Akt 及p-Akt反映通路的活化情况[6]。
前期研究结果[7-9]表明,小鼠皮肤损伤愈合过程中p38MAPK、JNK、iNOS、eNOS、caspase-8、caspase-9、calpain等多个凋亡相关因子的表达变化具有时间规律性,可以用于损伤时间推断,同时认为细胞凋亡在小鼠皮肤损伤愈合过程中发挥重要的作用,即多种参与皮肤损伤愈合过程的细胞通过细胞凋亡来维持其数量的稳定[7];凋亡相关的caspase-3、caspase-6、caspase-7在损伤区的中性粒细胞中也呈规律性表达[8-9]; Zhu等[10]研究表明,加入caspase广谱抑制剂不能抑制中性粒细胞凋亡,同时发现在凋亡过程中,p-Akt表达减弱;若PI3K/Akt信号通路过度表达,则可抑制中性粒细胞的凋亡。Knall等[11]研究表明,IL-8通过PI3K/Akt信号通路介导中性粒细胞迁移。Kuo等[12]在研究TPA诱导的皮肤炎症过程中发现,厚朴酚通过抑制PI3K/Akt信号通路发挥抑制炎症的作用。Sun 等[13]证实,在炎症过程中PI3K/Akt信号通路的抑制剂是通过抑制促炎因子的释放来抑制炎症。本实验观察到在皮肤损伤炎症期,PI3K、p-Akt在中性粒细胞有较高的阳性细胞率,同时Western印迹法结果显示,p-PI3K、p-Akt表达水平明显升高,推测可能与p-PI3K、p-Akt发挥促进中性粒细胞活化和迁移相关;而p-PI3K、p-Akt表达高峰分别出现在3d、1 d,可能与Akt的磷酸化存在其他机制相关[14]。
在损伤愈合过程中发挥清除异物及坏死物质作用的巨噬细胞,可以分为促炎M1和抗炎M2两种亚型[15]。有研究[16]表明,PI3K/Akt信号通路在单核细胞分化为M2型的过程中发挥重要的作用。本研究中,免疫组织化学染色和Western印迹法结果显示,PI3K、p-Akt在损伤增殖期高表达,推测可能与PI3K/Akt在巨噬细胞增殖和分化中发挥作用有关。
前期研究[17-18]表明,在皮肤损伤愈合过程中,成纤维细胞的募集和分化具有时间规律性,可以用于损伤时间推断[17]。Kondo等[18]研究证实皮肤损伤愈合过程中巨噬细胞和成纤维细胞均表达Fas/FasL,部分共同表达Fas/FasL的细胞发生凋亡。有研究[19]表明,TGF-β通过激活PI3K/Akt信号通路促进人肺成纤维细胞胞外基质合成,促进肺纤维化。博来霉素通过PI3K/Akt信号通路来提高肺成纤维细胞增殖和胶原蛋白表达,直接发挥促纤维化的作用[20]。本研究发现,PI3K 和Akt的表达量在组织重建期明显增高,PI3K mRNA 和Akt mRNA的表达峰值略早于其蛋白表达的峰值,推测可能由于从mRNA到合成蛋白需要一定的时间有关。
本实验结果表明,正常皮肤中,PI3K、p-Akt在表皮、毛囊、皮脂腺中表达;在皮肤损伤愈合过程中PI3K、p-Akt在中性粒细胞、巨噬细胞、成纤维细胞中表达,其阳性细胞率随时间呈规律性的表达变化。在皮肤损伤愈合的炎症期,p-PI3K、p-Akt表达明显升高,而PI3K、Akt变化不明显,表明炎症期检测p-PI3K、p-Akt的变化更有利于损伤时间推断。PI3K、p-Akt的阳性细胞率峰值出现在增殖期,推测可能与PI3K、Akt发挥增殖作用及巨噬细胞和成纤维细胞表达重叠相关。在组织重建期,PI3K和Akt表达明显升高可能与其在成纤维细胞发挥促进皮肤纤维化有关,同时Western印迹法和real-time PCR检测结果表明PI3K和Akt的表达变化推断损伤时间更易观测。在皮肤损伤愈合过程中,PI3K和Akt的表达变化呈现一定的时间规律,PI3K和Akt有望用于皮肤损伤时间推断。
参考文献:
[1] Reinke JM,Sorg H. Wound repair and regeneration[J]. Eur Surg Res,2012,49(1):35-43.
[2] Nagai S,Kurebayashi Y,Koyasu S. Role of PI3K/Akt and mTOR complexes in Th17 cell differentiation[J]. Ann N Y Acad Sci,2013,1280:30-34.
[3] Castilho RM,Squarize CH,Gutkind JS. Exploiting PI3K/mTOR signaling to accelerate epithelial wound healing[J]. Oral Dis,2013,19(6):551-558.
[4] Simmons CD,Pabona JM,Zeng Z,et al. Response of adult mouse uterus to early disruption of estrogen receptor-alpha signaling is influenced by Krüppel-like factor 9[J]. J Endocrinol,2010,205(2):147-157.
[5] Tsuchiya A,Kanno T,Nishizaki T. PI3 kinase directly phosphorylates Akt1/2 at Ser473/474 in the insulin signal transduction pathway[J]. J Endocrinol,2013,220(1):49-59.
[6] Shehadah A,Chen J,Zacharek A,et al. Niaspan treatment induces neuroprotection after stroke[J]. Neurobiol Dis,2010,40(1):277-283.
[7] Zhao R,Guan DW,Zhang W,et al. Increased expressions and activations of apoptosis-related factors in cell signaling during incised skin wound healing in mice:a preliminary study for forensic wound age estimation[J]. Leg Med(Tokyo),2009,11(S1):S155-S160.
[8]杜宇,官大威,赵锐.皮肤切创愈合中caspase-3表达的免疫组化研究[J].法医学杂志,2004,20(1):1-3.
[9]路斌,赵锐,官大威,等.小鼠皮肤切创愈合过程中caspase-3的表达及其活性[J].法医学杂志,2007,23(3):161-163.
[10] Zhu D,Hattori H,Jo H,et al. Deactivation of phosphatidylinositol 3,4,5-trisphosphate/Akt signaling mediates neutrophil spontaneous death[J]. Proc Natl Acad Sci USA,2006,103(40):14836-14841.
[11] Knall C,Worthen GS,Johnson GL. Interleukin 8-stimulated phosphatidylinositol-3-kinase activity regulates the migration of human neutrophils independent of extracellular signal-regulated kinase and p38 mitogen-activated protein kinases[J]. Proc Natl Acad Sci USA,1997,94(7):3052-3057.
[12] Kuo DH,Lai YS,Lo CY,et al. Inhibitory effect of magnolol on TPA-induced skin inflammation and tumor promotion in mice[J]. J Agric Food Chem,2010,58(9):5777-5783.
[13] Sun M,Zhu M,Chen K,et al. TREM-2 promotes host resistance against Pseudomonas aeruginosa infection by suppressing corneal inflammation via a PI3K/Akt signaling pathway[J]. Invest Ophthalmol Vis Sci,2013,54(5):3451-3462.
[14] Moule SK,Welsh GI,Edgell NJ,et al. Regulation of protein kinase B and glycogen synthase kinase-3 by insulin and beta-adrenergic agonists in rat epididymal fat cells. Activation of protein kinase B by wortmannin-sensitive and -insensitive mechanisms[J]. J Biol Chem,1997,272(12):7713-7719.
[15] Vo VA,Lee JW,Kim JY,et al. Phosphorylation of Akt Mediates Anti-Inflammatory Activity of 1-p-Coumaroyl β-D-Glucoside Against Lipopolysaccharide-Induced Inflammation in RAW264.7 Cells[J]. Korean J Physiol Pharmacol,2014,18(1):79-86.
[16] Rocher C,Singla R,Singal PK,et al. Bone morphogenetic protein 7 polarizes THP-1 cells into M2 macrophages[J]. Can J Physiol Pharmacol,2012,90(7):947-951.
[17]范琰琰,官大威,王涛,等.小鼠皮肤切创愈合过程中纤维细胞募集和分化的时间依赖性[J].法医学杂志,2011,27(4):246-249.
[18] Kondo T,Ohshima T,Mori R,et al. Immunohistochemical detection of chemokines in human skin wounds and its application to wound age determination[J]. Int J Legal Med,2002,116(2):87-91.
[19] Yang T,Liang Y,Lin Q,et al. miR-29 mediates TGFβ1-induced extracellular matrix synthesis through activation of PI3K-AKT pathway in human lung fibroblasts[J]. J Cell Biochem,2013,114(6):1336-1342. [20] Lu Y,Azad N,Wang L,et al. Phosphatidylinositol-3-kinase/akt regulates bleomycin-induced fibroblast proliferation and collagen production[J]. Am J Respir Cell Mol Biol,2010,42(4):432-441.
(本文编辑:刘宁国)
Effects of PI3K/Akt Pathway in Wound Healing Process of Mice Skin
GAO Yan-ling1,2, LIU Chang-sheng3, ZHAO Rui1, WANG Lin-lin1, LI Shan-shan1, LIU Min1, ZHANG Miao1, JIANG Shu-kun1, TIAN Zhi-ling1, WANG Meng1, GUAN Da-wei1
(1. Department of Forensic Pathology, School of Forensic Medicine, China Medical University, Shenyang 110001, China; 2. Criminal Police Branch, Public Security Bureau of Suzhou, Suzhou 215000, China; 3. Department of Technology, People’s Procuratorate of Anshan, Anshan 114001, China)
Abstract:Objective To investigate the expressions and time-dependent changes of phosphatidylinositol-3-kinase(PI3K), phospho-P13K(p-PI3K), protein kinase B(PKB/Akt)and phospho-Akt(p-Akt)during wound healing process of mice skin. Methods The changes of PI3K, p-PI3K, Akt and p-Akt expression in skin wound were detected by immunohistochemistry, Western blotting and real-time PCR. Results Immunohistochemistry showed the expression of PI3K and p-Akt were observed in mononuclear and fibroblast after skin wound, and reached peak in reconstruction. The positive bands of PI3K, p-PI3K, Akt and p-Akt were observed in all time points of the wound healing process by Western blotting. The expression peak of p-PI3K and p-Akt showed in inflammation and proliferation; the expression peak of PI3K and Akt in reconstruction. Real-time PCR showed the expression peak of PI3K mRNA in inflammation and reconstruction and the peak of Akt mRNA in reconstruction. Conclusion During the wound healing process, the expressions of PI3K, Akt, p-PI3K and p-Akt show different changes with significant correlation to wound time. The expression of PI3K/Akt may be a valuable marker for wound time estimation. Key words:forensic pathology; wounds and injuries; skin; phosphatidylinositol 3-kinase; phospho-PI3K; protein kinase B; phospho-Akt; mice
收稿日期:(2014-05-23)
通信作者:官大威,男,博士,教授,博士研究生导师,主要从事法医病理学教学、科研和鉴定;E-mail:dwguan@mail.cmu.edu.cn
作者简介:高彦令(1987—),男,硕士研究生,主要从事法医病理学科研和教学;E-mail:gaoyanling_0116@126.com
基金项目:国家自然科学基金资助项目(81273342);鞍山市科学技术项目(2060499)
文章编号:1004-5619(2016)01-0007-06
中图分类号:DF795.1
文献标志码:A
doi:10.3969/j.issn.1004-5619.2016.01.002

