硅珠法提取生物检材DNA的影响因素
郑小婷,徐念来(.浙江省公安厅物证鉴定中心,浙江杭州30009;.杭州市公安局萧山分局,浙江杭州300)
硅珠法提取生物检材DNA的影响因素
郑小婷1,徐念来2
(1.浙江省公安厅物证鉴定中心,浙江杭州310009;2.杭州市公安局萧山分局,浙江杭州311200)
关键词:法医遗传学;DNA;硅珠法;生物检材
在酚-氯仿有机法、Chelex-100法、磁珠法及硅珠法几种DNA提取方法中,硅珠法在脱落细胞等微量生物检材以及骨骼、牙齿等疑难生物检材中的成功应用得到了很多学者的认可[1-3]。随着硅珠法的不断推广应用,有学者对传统的硅珠法进行了改良以提高其提取模板DNA的灵敏度[4],也有人通过实验证实加大检材量能够提高硅珠法在脱落细胞DNA中的提取浓度[5]。本研究系统地比较了硅珠量、硅珠悬浮时间以及悬浮方式对提取模板DNA质量的影响,以期用最佳的组合提取方法来提高硅珠法的提取回收量。
1材料与方法
1.1主要试剂及仪器
7500荧光实时定量PCR仪(美国AB公司),金属加热混匀仪(德国Eppendorf公司),Quantifiler®Duo DNA Quantification试剂盒(美国AB公司),DNA标准品9947A(10ng/μL,美国AB公司),15%硅珠悬液;裂解缓冲液(lysis buffer,美国Promega公司),70%冷乙醇溶液。
1.2样品制备
将对照品9947A(10 ng/μL)用无核酸酶水稀释为1ng/μL,采用1.5 mL离心管分装,每份100μL,共84份。并于每份稀释液内加入裂解缓冲液200μL,涡旋数秒混匀备用。
1.3方法
1.3.1硅珠量与悬浮时间的比较
取样本稀释液16份,编为A组、B组、C组和D组,每组4份,每份分别加入20、40、60、80μL硅珠悬液,然后涡旋数秒混匀,室温条件下分别置于金属加热混匀仪上连续振荡(900r/min),以保证硅珠微粒始终处于悬浮状态。每组的4份样本中硅珠微粒的悬浮时间依次为15、30、45和60min。悬浮时间结束后离心,并采用70%冷乙醇溶液洗涤2次,56℃挥干残余乙醇,用纯水洗脱结合在硅珠上的DNA,使DNA提取液终体积为30μL。上述实验共重复3次。
1.3.2悬浮方式与悬浮时间的比较
取样本稀释液12份,每份加入40 μL的硅珠悬液涡旋混匀后编为E组、F组和G组,每组4份。E组采用室温静置;F组采用室温金属加热混匀仪上振荡5 min(900 r/min)和静置5 min的间隔振荡悬浮方式;G组采用在室温状态下,在金属加热混匀仪上以900r/min的速度连续振荡的悬浮方式。每组4份样本中DNA与硅珠微粒的结合时间依次为15、30、45和60min。硅珠与DNA结合结束后离心,并采用70%冷乙醇溶液洗涤2次,56℃挥干残余乙醇,用纯水洗脱结合在硅珠上的DNA,使DNA提取液终体积为30μL。上述实验共重复3次。
1.4 DNA定量
参照7500荧光实时定量PCR仪操作手册,采用25 μL反应体系,其中混合物12.5 μL,引物10.5 μL,DNA模板2.0μL。
对7组共84份样本回收所得的DNA全部进行定量,采用7500 System SDS软件分析数据。DNA回收率以终体积为30 μL的DNA回收量浓度与DNA标准液无损耗浓度的比值进行计算。
2结 果
2.1硅珠量与悬浮时间的比较结果
如表1所示,在采用硅珠法提取模板DNA时,所加入的硅珠量、硅珠悬浮时间对提取到的最终DNA浓度有一定的影响。加入40μL硅珠悬液得到的DNA回收量最高,在加入相同硅珠量的情况下,硅珠与DNA的结合时间在15min所得到的DNA回收量最低,而在30min以上则无明显差异。
2.2悬浮方式与悬浮时间的比较结果
在4个不同的时间段,硅珠微粒处于悬浮状态比静置所得到的DNA回收量高(表2)。连续振荡后所得到的DNA回收量较间隔振荡高。
表1硅珠量与悬浮时间的比较 (n=3,±s,ng/μL)
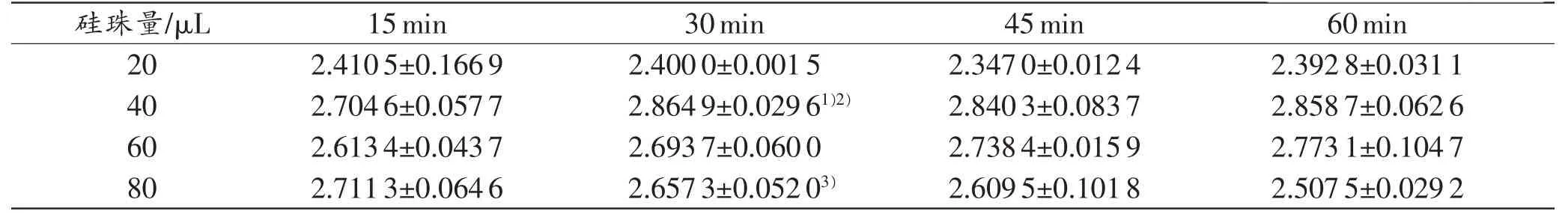
表1硅珠量与悬浮时间的比较 (n=3,±s,ng/μL)
注:1)与相同时间20μL硅珠量相比,P<0.05;2)与相同硅珠量15min悬浮时间相比,P<0.05;3)与相同时间40μL硅珠量相比,P<0.05
硅珠量/μL 15min 30min 45min 60min 20 2.4105±0.1669 2.4000±0.0015 2.3470±0.0124 2.3928±0.0311 40 2.7046±0.0577 2.8649±0.02961)2) 2.8403±0.0837 2.8587±0.0626 60 2.6134±0.0437 2.6937±0.0600 2.7384±0.0159 2.7731±0.1047 80 2.7113±0.0646 2.6573±0.05203) 2.6095±0.1018 2.5075±0.0292
表2悬浮方式与悬浮时间的比较 (n=3,±s,ng/μL)

表2悬浮方式与悬浮时间的比较 (n=3,±s,ng/μL)
注:1)与相同时间室温静置相比,P<0.05;2)与相同时间间隔振荡相比,P<0.05;3)与相同悬浮方式悬浮15min相比,P<0.05
悬浮方式 15min 30min 45min 60min室温静置 2.0688±0.1821 2.1538±0.1134 2.2365±0.0856 2.2523±0.0921间隔振荡 2.4972±0.0533 2.4846±0.0762 2.5857±0.0213 2.6843±0.0034连续振荡 2.7051±0.0021 2.8619±0.03141)2)3) 2.8427±0.0638 2.8613±0.0589
2.3 DNA回收量结果
按无损耗计算,100 μL质量浓度为1 ng/μL的DNA标准稀释液浓缩为30 μL后,其质量浓度应为3.3333ng/μL。采用三次重复实验的平均值计算改良硅珠法提取DNA的回收量,所有样本回收得到的DNA质量浓度最低为2.0688ng/μL,最高为2.8649ng/μL。其回收率处于62.06%~85.95%。
3讨 论
硅珠量、硅珠与DNA结合时间以及硅珠的悬浮方式是硅珠法提取DNA中的3个重要因素。有报道[2-3]称,加大硅珠量以及减少洗脱体系可提高硅珠法回收模板DNA的浓度。
表1显示,当加入的硅珠量不足时,延长结合时间并不能提高提取到的DNA的量;而当加入过饱和的硅珠量时,DNA与硅珠的结合率反而下降,这可能与过多的硅珠微粒之间竞争性争夺DNA,而使DNA与硅珠的结合变得不那么牢固,在洗涤的过程中部分DNA被损耗有关。因此,在采用硅珠法提取微量生物检材DNA的过程中,在加大检材量的同时,也应寻找最佳比例的硅珠量并适当地延长DNA与硅珠的结合时间。
表2结果表明,吸附过程中使硅珠处于悬浮状态可以提高DNA的回收量,而且随着悬浮时间的延长,这种提高的效果更显著。在日常案件检验中,经常提到并使用的是室温静置[4,6],而通过本试验发现,这种方式得到的DNA量是最低的,这可能与室温静置过程中硅珠微粒由于重力作用下沉而引起的与溶液中DNA不能充分结合有关。本试验采用了900r/min的振荡速度,既可以使硅珠微粒始终处于悬浮状态又不会使结合在硅珠上的DNA被剧烈的分子撞击而脱离硅珠微粒。连续振荡与间隔振荡所回收得到的DNA量差异具有统计学意义,而且间隔振荡对于法医工作者而言操作比较繁琐,因此在实际检案中建议采用连续振荡的悬浮方式。
硅珠法提取生物检材DNA的过程中,其提取DNA的回收率最低为62.06%,最高为85.95%,波动幅度较大。并且相比较于磁珠法,硅珠法在提取、纯化DNA时的损耗更大[7]。因此在采用硅珠法提取生物检材DNA时,更应注重提取过程中各个环节的优化。综上所述,在采用硅珠法提取微量生物检材DNA时,使用适当的硅珠量,采用连续振荡的悬浮方式,并适当延长DNA与硅珠的结合时间,可以提高模板DNA的浓度,从而相应地提高微量生物检材的检出率及成功率,更好地为打击犯罪服务。
参考文献:
[1]王林生,苏勇,顾林岗.硅珠法提取PCR模板DNA[J].中国法医学杂志,2000,15(1):36-37.
[2]刘雅诚,王静,严江伟,等.硅珠法提取骨组织DNA[J].中国法医学杂志,2002,17(1):38-40.
[3]周如华,周钱颖,沙轶,等.应用硅珠法提取陈旧骨骼DNA[J].中国法医学杂志,2006,21(5):296-297.
[4]董迎春,李诗柳,朱怡,等.改良硅珠法提取DNA的灵敏性及稳定性评价初探[J].中国法医学杂志,2015,30(1):59-61.
[5]姚建,贾东涛,张玉红,等.检材量对硅珠法提取脱落细胞DNA的影响[J].中国法医学杂志,2009,24(5):333-334.
[6]杨百全,李晨旭,付伟东,等.硅珠法在纯化污染检材中的应用[J].刑事技术,2003,(5):10-12.
[7]李佑英,叶家喜,朱琳,等.不同纯化浓缩方法对模板DNA回收量的影响研究[M]//法医遗传学进展与应用,北京:群众出版社,2008.
(本文编辑:李成涛)
·医疗损害·
收稿日期:(2015-04-03)
作者简介:郑小婷(1976—),女,硕士,副主任法医师,主要从事法医DNA分析技术应用和研究;E-mail:turlina@sina.com
文章编号:1004-5619(2016)01-0063-02
中图分类号:DF795.2
文献标志码:B
doi:10.3969/j.issn.1004-5619.2016.01.015

