Toll样受体9基因多态性与重症肌无力相关性研究
岳耀先,洪 宇,王淑霞,王 琦,张贤军,高 翔,张 栩,李海峰
Toll样受体9基因多态性与重症肌无力相关性研究
岳耀先,洪 宇,王淑霞,王 琦,张贤军,高 翔,张 栩,李海峰
[摘要]目的 探讨Toll样受体9(Toll-like receptor 9,TLR9)基因rs352140和rs187084位点多态性与重症肌无力(myasthenia gravis,MG)的相关性。方法 纳入109例MG患者和162例健康体检者。采用聚合酶链反应-限制性内切酶多态性方法对TLR9基因rs352140和rs187084位点分型,并在MG组与对照组、MG各亚组(性别、发病年龄、胸腺情况、最严重时Osserman分型、Oosterhuis评分和激素近期疗效)与对照组、MG各亚组之间比较两位点等位基因频率和共显性、加性、过显性遗传模型下基因型频率的差异。结果 TLR9基因rs352140和rs187084位点等位基因频率和共显性、加性、过显性遗传模型下的基因型频率在MG组与对照组、MG各亚组与对照组及MG各亚组之间差异无统计学意义(P>0.05)。结论 TLR9基因rs352140和rs187084位点多态性与重症肌无力的易感性、严重程度和激素疗效无相关性。
[关键词]重症肌无力;Toll样受体9;基因多态性
[作者单位]250012山东济南,山东大学齐鲁医院神经内科(岳耀先,李海峰);266003山东青岛,青岛大学附属医院神经内科(洪宇,王 琦,张贤军,高 翔,张 栩);252600山东临清,聊城市第二人民医院神经内科(王淑霞)
重症肌无力(myasthenia gravis,MG)是由乙酰胆碱受体抗体介导、T细胞依赖的自身免疫性疾病[1],目前认为其发病是遗传因素和环境因素共同作用的结果。Toll样受体9(Toll-like receptor 9,TLR9)是一种模式识别受体,可以识别细菌和病毒DNA中的非甲基化的胞嘧啶鸟嘌呤二核苷酸序列,激活固有免疫反应,并通过促进炎性介质释放和调节细胞因子网络,激活并调节获得性免疫反应[2]。近年研究证实,TLR9激活引起的级联反应可打破机体对自身抗原的免疫耐受,并促进自身免疫性疾病的发生、发展[3]。近年来,已对系统性红斑狼疮[4]、多发性硬化[5]、克罗恩病[6]等多种自身免疫性疾病患者进行了TLR9基因多态性研究,提示TLR9基因某些位点单核苷酸多态性(single nucleotide polymorphisms,SNPs)与这些疾病的发病相关。本研究通过聚合酶链反应-限制性内切酶多态性(polymerase chain reactionbased restriction fragment length polymorphism,PCRRFLP)方法比较MG患者和健康人群TLR9基因rs352140和rs187084位点多态性,并探索其与MG易感性、严重程度和糖皮质激素近期疗效的相关性。
1 资料与方法
1.1临床资料 2007年1月—2009年6月于青岛大学附属医院神经内科诊治的MG患者共109例,均符合MG的诊断标准[必备条件为典型的骨骼肌无力症状波动性、病态疲劳性、疲劳试验阳性和新斯的明试验阳性,支持条件为乙酰胆碱受体抗体阳性和(或)低频重复电刺激波幅递减>10%]。患者来自全国16个省,无MG家族史。对照组为随机选取健康体检者162例,排除慢性感染疾病和自身免疫性疾病。MG组与对照组均为汉族,组间及各组内人群均无亲缘关系。入组者均知情同意,且本研究获得医院伦理委员会同意。
1.2方法
1.2.1分组及评分 根据性别、发病年龄(<15岁、15~40岁和>40岁)[1]、胸腺情况、随访1年以上最重时Osserman分型[7](Ⅰ、Ⅱ、Ⅲ+Ⅳ型)和最重时的Oosterhuis评分[8](0~2分为轻型、3~5分为重型)将患者分成MG组、MG各亚组,健康体检者为对照组。研究发现70%的MG患者发病1年内发展到最重程度[9],故对总病程达1年以上者才进行最严重时Osserman分型和Oosterhuis评分的分析。需要行免疫治疗者采取统一治疗方案,先单独用中等剂量[相当于按体质量0.75~1.00 mg/(kg·d)泼尼松]激素治疗,使用重症肌无力定量评分量表于清晨未服溴吡斯的明时对患者进行绝对评分测量。疗效判断采用相对评分,即治疗前绝对评分与治疗后绝对评分之差除以治疗前绝对评分。激素近期疗效好是指用上述剂量正规治疗3个月,相对评分>50%且能稳定减量。纳入激素疗效分析的患者在激素治疗前6个月未使用过免疫抑制剂和激素,3个月内未使用过免疫球蛋白。本研究中rs352140位点的部分资料在前期已报道[10],作者补充报道rs187084位点的多态性,并对2个位点进行连锁不平衡及单倍型分析。
1.2.2基因分型 取乙二胺四乙酸抗凝静脉血0.5 mL,BioChain[博尔诚(北京)科技有限公司]DNA提取试剂盒提取DNA,应用PCR-RFLP技术进行基因分型,两位点引物及内切酶信息见表1。PCR条件94℃预变性5 min、94℃变性30 s、62℃退火1 min、72℃延伸1 min,共35个循环,72℃后延伸5 min,置4℃冰箱保存。酶切产物置8%聚丙烯酰胺凝胶以150 V电压电泳30 min,溴化乙锭染色后进行基因型鉴定。为确保分型结果准确性,MG组和对照组中分别选取25例样本,送上海天昊生物科技有限公司采用SNPscanTM高通量基因分型技术进行分型验证。
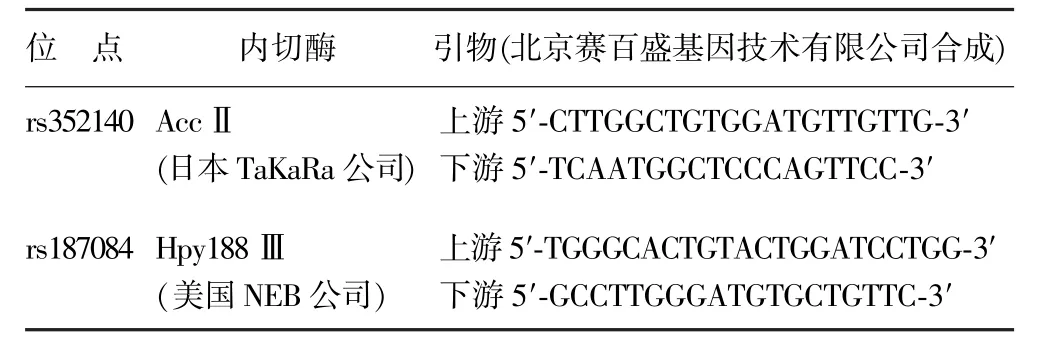
表1 rs352140和rs187084位点内切酶和引物
1.3统计学处理 用在线软件SNPstats[11]进行对照组哈迪-温伯格(Hardy-Weinberg)遗传平衡检验。应用SPSS 17.0软件,采用X2检验或费舍尔精确检验比较MG组与对照组、各MG亚组与对照组以及MG各亚组间最小等位基因频率(minor allele frequency,MAF)的差异,并计算共显性、加性和过显性遗传模型下基因型频率的差异(SNPstats),P<0.05为差异有统计学意义。用Haploview软件进行连锁不平衡和单倍型分析。激素疗效赋值为因变量建立Logistic回归模型,将可能的影响因素治疗前Osserman分型、治疗前Oosterhuis评分、治疗前病程、性别、发病年龄、胸腺情况和基因型进入Logistic回归模型。用PGA软件计算统计效力。
2 结果
2.1一般情况 两位点均分型成功者纳入分析,MG组106例,男性48例、女性58例,发病年龄1~81(33.8±19.8)岁;对照组158例,男性63例、女性95例,年龄17~75(49.9±22.1)岁(表2)。rs352140 和rs187084位点对照组基因型分布均符合Hardy-Weinberg遗传平衡(P>0.05)。质控分型结果与酶切实验结果相符。有胸腺影像学和(或)病理资料者共98例,分为不伴胸腺瘤组和伴胸腺瘤组。随访达1年以上且有详细资料的共95例,Osserman分型Ⅰ型、Ⅱ型和Ⅲ+Ⅳ型分别为28例、59例和8例;Oosterhuis评分0~2分和3~5分组分别为55例和40例。共74例纳入激素疗效分析(个别病例临床资料不全),疗效好58例,疗效差16例。
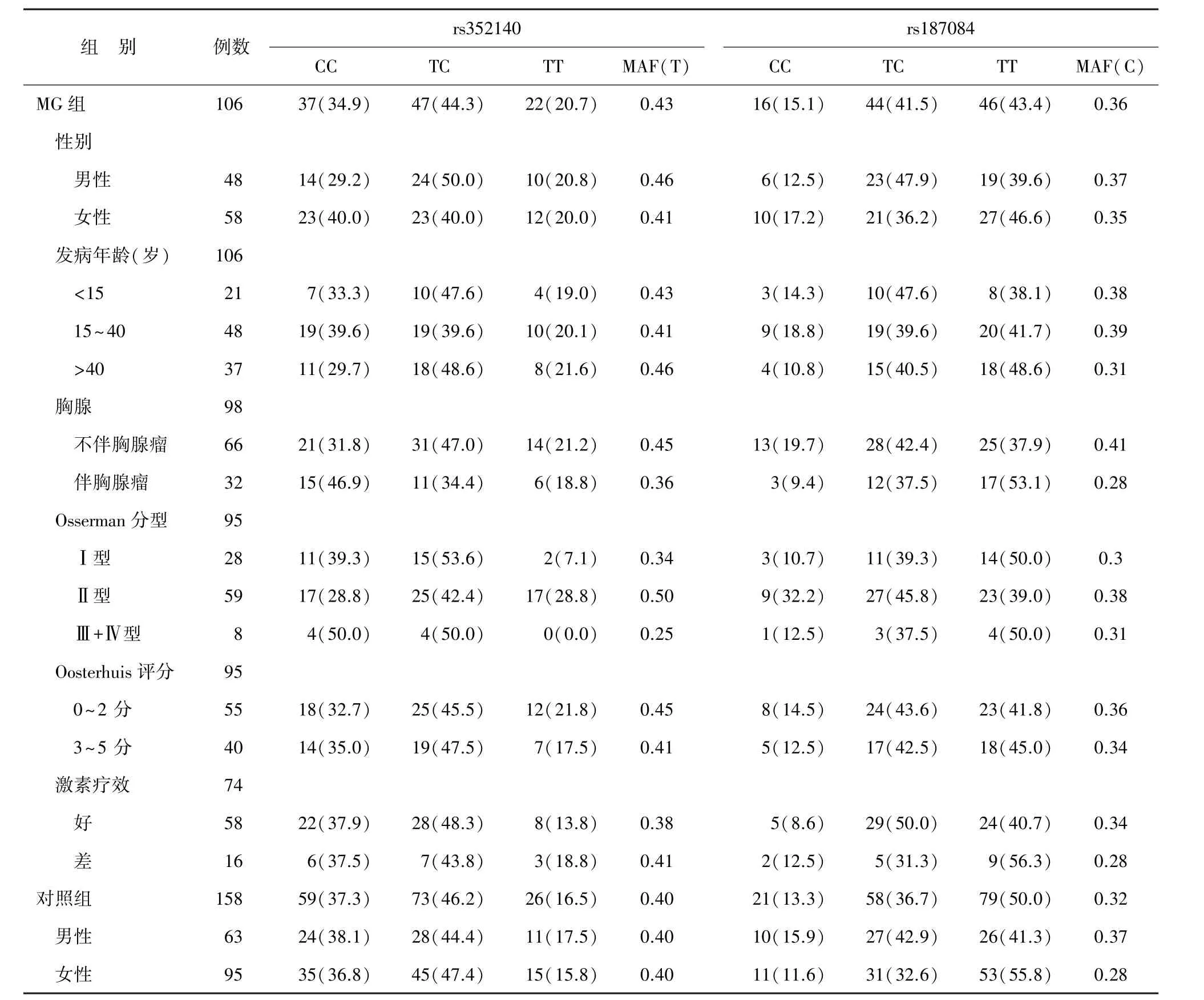
表2 MG组和对照组rs352140、rs187084基因型及等位基因频率分布[例(%)]
2.2等位基因和基因型频率 MG组与对照组等位基因频率的差异无统计学意义(P>0.05)。MG组与对照组在共显性、加性和过显性遗传模型下基因型频率差异无统计学意义(P>0.05)。见表2。
同性别MG组与对照组等位基因频率和共显性、加性、过显性遗传模型下基因型频率差异无统计学意义(P>0.05);MG各亚组间、MG各亚组与对照组等位基因频率和共显性、加性、过显性模型下基因型频率差异无统计学意义(P>0.05)。
2.3单倍型及连锁不平衡分析 连锁不平衡分析发现两位点间D′=0.83、r2=0.5。rs352140和rs187084共构建4种单倍型(表3),单倍型频率在MG组与对照组差异无统计学意义(P>0.05)。
2.4统计效力 本研究样本量对于发现MG组与对照组单个等位基因频率显著性差异(比值比的值至少为1.5)的统计效力达到70%(显著性水平0.05,双侧检验)。
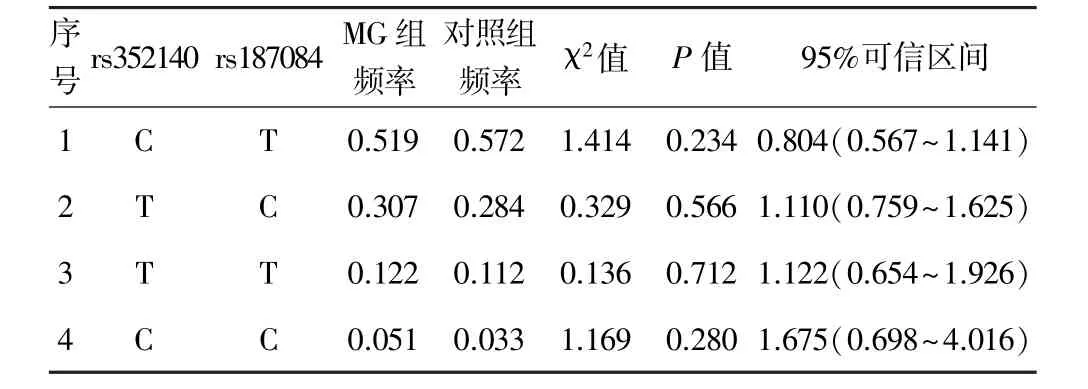
表3 MG组与对照组单倍型频率(rs352140-rs187084顺序)
2.5激素疗效影响因素 不同疗效患者间等位基因频率和共显性、加性、过显性遗传模型下基因型频率差异无统计学意义(P>0.05)。单因素分析发现治疗前的Osserman分型(Ⅰ型、Ⅱ型、Ⅲ+Ⅲ型)及是否伴有胸腺瘤在不同疗效组的差异有统计学意义(P= 0.002及P<0.001);但性别、发病年龄、治疗前Oosterhuis评分差异无统计学意义(P>0.05);激素疗效好组和疗效差组治疗前病程中位数分别为3.0个月和5.5个月,四分位数间距分别为10.3个月和11.0个月,两者比较差异无统计学意义(P>0.05)。见表4。
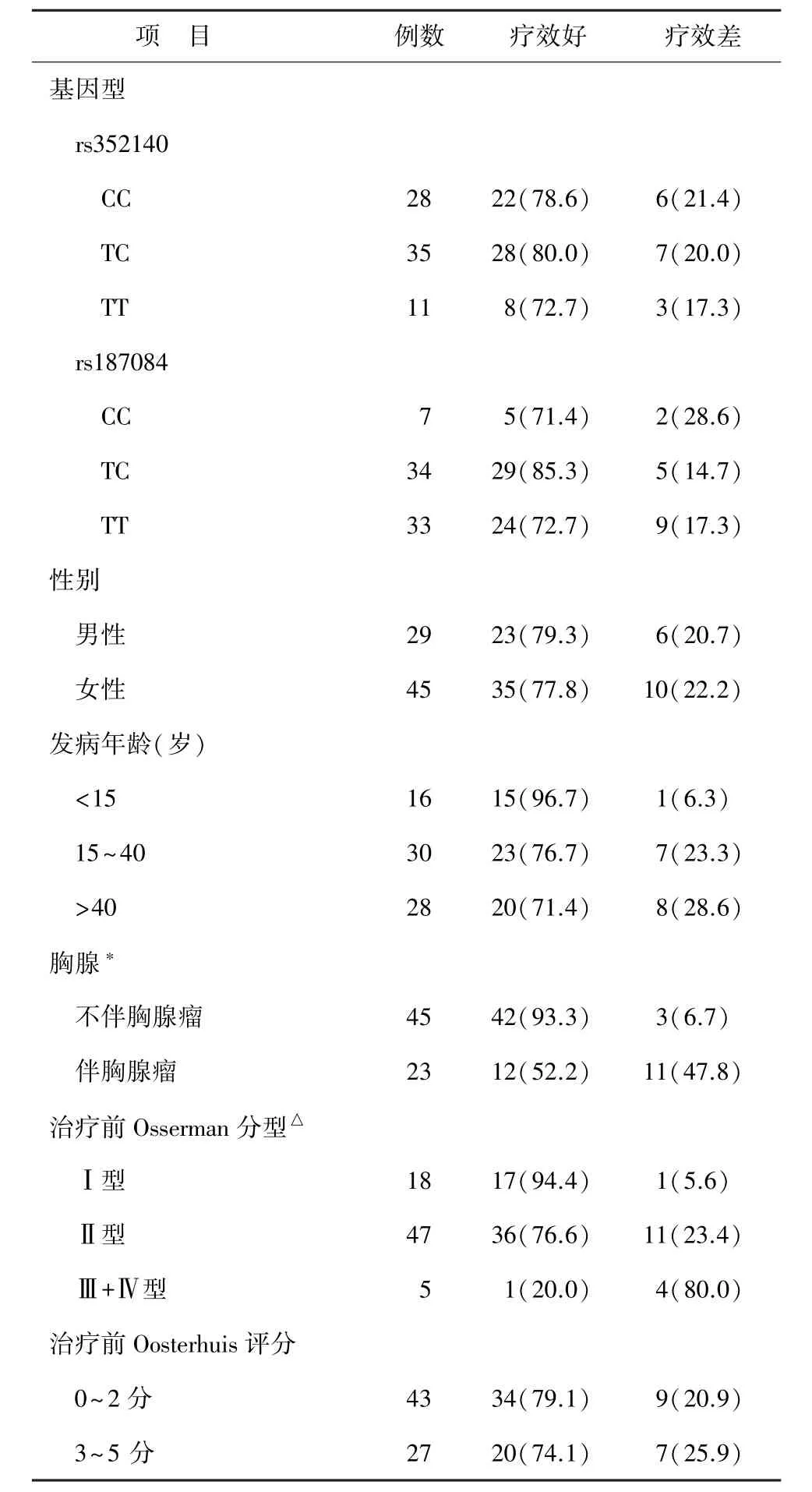
表4 MG患者基因型、临床特征与激素疗效关系[例(%)]
Logisitc回归模型未发现激素疗效与两位点基因型相关(P>0.05),但发现合并胸腺瘤是激素短期疗效差的危险因素(P<0.01)。
3 讨论
TLR9是TLR家族的第9个成员,其受体存在于细胞内,能够识别细菌、病毒DNA保守的GPG结构,激活后可以启动固有免疫,诱导炎症反应,并调节特异性免疫[2]。TLR受体家族在自身免疫性疾病的发病机制中起重要作用。TLR9受体可通过髓样分化因子88和肿瘤坏死因子受体相关因子-6途径激活干扰素调节因子-7,促进α-干扰素分泌,诱导特异性免疫反应,激活自身反应性淋巴细胞,诱发或加重自身免疫性疾病[11]。研究发现部分MG患者胸腺中存在病毒感染的证据[12-14],病毒感染可能是诱发MG的重要因素[15],而合并感染也可诱发和加重MG的临床症状,因此能够识别病毒DNA胞嘧啶鸟嘌呤二核苷酸结构的TLR9可能在MG发病中发挥作用。人TLR9基因定位于3p21.3,长度5 kb,包括2个外显子,第2个外显子是其主要的编码区[16]。Tao等[17]于2007年首次发现亚洲人群中TLR9基因rs352139位点多态性同系统性红斑狼疮的易感性相关。Lee 等[4]对系统性红斑狼疮与TLR受体基因的相关性研究进行荟萃分析,提示TLR7和TLR9基因多态性同亚洲人群的系统性红斑狼疮发病风险相关。Liao 等[18]发现rs352140和rs187084两位点与男性Graves眼病的易感性相关,在男性Graves眼病患者中,携带rs352140 T和rs187084 C等位基因频率显著高于对照组。Etem等[19]发现rs187084 T等位基因可能是类风湿性关节炎的一个危险因素,病例组中携带TT纯合子的频率明显高于健康对照组。在人类基因组单体型图数据库汉族人群数据中,rs352140和rs187084位点作为标签覆盖了整个基因区域,因此这2个位点在TLR9基因的常见位点(MAF>0.05)中具有一定的代表性。rs187084位于启动子区,rs352140位于第2个外显子区,其多态性可能影响TLR9的功能,进而参与自身免疫性疾病的发病过程。
本研究对照组中两位点的基因型和等位基因分布均符合Hardy-Weinberg平衡。两位点基因型频率与PubMed数据库链接的基因图数据中的中国汉族人群数据相近。连锁不平衡分析发现两位点间(D′= 0.83、r2=0.50)具有较强连锁不平衡,也与人类基因组单体型图数据库一致。MG组与对照组等位基因频率和基因型频率差异无统计学意义(P>0.05),单倍型的频率差异也无统计学意义(P>0.05)。MG各亚组与对照组以及MG各亚组间等位基因频率和基因型频率差异无统计学意义(P>0.05),提示2个位点的多态性可能与MG的易感性及严重程度无关。单因素分析中未发现rs352140和rs187084与激素近期疗效相关,但发现伴胸腺瘤及治疗前Osserman分型与疗效存在相关性。进一步行Logistic回归发现伴胸腺瘤为激素近期疗效差的独立危险因素,与临床所见[1]相符。
综上,本研究未发现TLR9基因rs352140和rs187084位点多态性与MG的易感性、严重程度和激素短期疗效存在相关性。
【参考文献】
[1]Meriggioli MN,Sanders DB.Autoimmune myasthenia gravis:emerging clinical and biological heterogeneity[J].Lancet Neurol,2009,8(5):475-490.
[2]Iwasaki A,Medzhitov R.Toll-like receptor control of the adaptive immune responses[J].Nat Immunol,2004,5(10): 987-995.
[3]Ichikawa HT,Williams LP,Segal BM.Activation of APCs through CD40 or Toll-like receptor 9 overcomes tolerance and precipitates autoimmune disease[J].J Immunol,2002,169(5):2781-2787.
[4]Lee YH,Lee HS,Choi SJ,et al.Associations between TLR polymorphisms and systemic lupus erythematosus:asystematic review and meta-analysis[J].Clin Exp Rheumatol,2012,30(2):262-265.
[5]Ji X,Wang Y,Huang G,et al.TLR3c.1377,TLR9-1486,and TLR9 2848 gene polymorphisms and multiple sclerosis[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2010,35 (2):116-122.
[6]Hong J,Leung E,Fraser AG,et al.TLR2,TLR4 and TLR9 polymorphisms and Crohn's disease in a New Zealand Caucasian cohort[J].JGastroenterol Hepatol,2007,22(11): 1760-1766.
[7]Osserman KE,Genkins G.Studies inmyasthenia gravis:review of a twenty-year experience in over 1200 patients [J].Mt Sinai JMed,1971,38(6):497-537.
[8]Skeie GO,Pandey JP,Aarli JA,et al.TNFA and TNFB polymorphisms in myasthenia gravis[J].Arch Neurol,1999,56(4):457-461.
[9]Grob D,Brunner N,Namba T,et al.Lifetime course ofmyasthenia gravis[J].Muscle Nerve,2008,37(2):141-149.
[10]王淑霞,李海峰,孙亮,等.TLR9基因rs352140位点多态性与重症肌无力的关系[J].中国神经免疫学和神经病学杂志,2010,17(3):183-187.
[11]SoléX,GuinóE,Valls J,et al.SNPStats:a web tool for the analysis of association studies[J].Bioinformatics,2006,22 (15):1928-1929.
[12]Marshak-Rothstein A.Toll-like receptors in systemic autoimmune disease[J].Nat Rev Immunol,2006,6(11):823-835.
[13]Cavalcante P,Maggi L,Colleoni L,et al.Inflammation and epstein-barr virus infection are common features ofmyasthenia gravis thymus:possible roles in pathogenesis[J]. Autoimmune Dis,2011,2011:213092.
[14]Cavalcante P,Barberis M,Cannone M,et al.Detection of poliovirus-infected macrophages in thymus of patientswith myasthenia gravis[J].Neurology,2010,74(14):1118-1126.
[15]Deitiker P,Ashizawa T,AtassiMZ.Antigenmimicry in autoimmune disease.Can immune responses tomicrobial antigens thatmimic acetylcholine receptor act as initial triggers of Myasthenia gravis?[J].Hum Immunol,2000,61 (3):255-265.
[16]Du X,Poltorak A,Wei Y,et al.Three novel mammalian toll-like receptors:gene structure,expression,and evolution[J].Eur Cytokine Netw,2000,11(3):362-371.
[17]Tao K,Fujii M,Tsukumo S,et al.Genetic variations of Toll-like receptor 9 predispose to systemic lupus erythematosus in Japanese population[J].Ann Rheum Dis,2007,66 (7):905-909.
[18]LiaoWL,Chen RH,Lin HJ,et al.Toll-like receptor gene polymorphisms are associated with susceptibility to Graves' ophthalmopathy in Taiwan males[J].BMC Med Genet,2010,11:154.
[19]Etem EO,Elyas H,Ozgocmen S,et al.The investigation of toll-like receptor 3,9 and 10 gene polymorphisms in Turkish rheumatoid arthritis patients[J].Rheumatol Int,2011,31(10):1369-1374.
·资 讯·
Correlation between Toll-like receptor 9 gene polymorphism and m yasthenia gravis
YUE Yaoxian1,HONG Yu2,WANG Shuxia3,WANG Qi2,ZHANG Xianjun2,GAO Xiang2,ZHANG Xu2,LIHaifeng1
(1.Department of Neurology,Qilu Hospital of Shandong University,Jinan Shandong 250012,China;
2.Department of Neurology,Affiliated Hospital of Qingdao University,Qingdao Shandong 266003,China;3.Department of Neurology,the Second People's Hospital of Liaocheng,Linqing Shandong 252600,China)
[Abstract]Objective To investigate the correlation between Toll-like receptor 9(TLR9) polymorphism and the susceptibility,severity and short-term effect of glucocorticoid in myasthenia gravis(MG)patients.M ethods One hundred and nine MG patients and 162 healthy controls in Han Chinese population were enrolled.Subgroupswere divided by gender,onset age,thymoma status,Osserman type,Oosterhuis score and short-term effect of glucocorticoid.Rs352140 and rs187084 were genotyped by polymerase chain reaction-based restriction fragment length polymorphism(PCR-RFLP)method.Allele frequencies and genotype frequencies(under codominant,logadditive and over-dominantmode of inheritance)were compared between MG/control group,MG subgroups/control group and each pairs of MG subgroups.Results In rs352140 and rs187084,there were no significant differences in allele frequencies and genotype frequencies(under codominant,log-additive and over-dominant mode of inheritance)among MG/control group,MG subgroups/control group and MG subgroups(P>0.05).Conclusion No correlation was found between rs352140 and rs187084 polymorphisms and the susceptibility,severity and short-term effectof glucocorticoid in myasthenia gravis patients.
[Key words]Myasthenia gravis;Toll like receptor 9(TLR9);Gene polymorphism
(收稿日期:2015-12-18 本文编辑:徐海琴)
[通讯作者]李海峰,E-mail:drlhf@163.com
[基金项目]国家自然科学基金(81070963);山东省自然科学基金资助(ZR2010HM019)
doi:10.3969/j.issn.2095-3097.2016.01.005
[中图分类号]R746.1;Q343.1
[文献标志码]B
[文章编号]2095-3097(2016)01-0019-05

