纤维素高效降解菌群构建及产酶底物优化
李文哲,朱巧银,范金霞,丁清华,李 翯(东北农业大学工程学院,哈尔滨 150030)
纤维素高效降解菌群构建及产酶底物优化
李文哲,朱巧银,范金霞,丁清华,李翯
(东北农业大学工程学院,哈尔滨150030)
摘要:为促进堆肥腐熟、缩短堆肥周期,通过平板初筛及酶活测定,从腐烂竹子、玉米秸秆中获得4株酶活性较高纤维素降解菌并混合培养,得到理想组合Cro-2/Bam-Q/Bam-3/Bam-1,其内切葡聚糖酶(CX)、外切葡糖酶(C1)、β-外切葡萄糖苷酶(CB)及纤维素全酶(FPA)活性分别为12.54、14.65、7.71、11.98 U,均高于单一菌株酶活性。对混合菌群产酶底物优化结果表明,当沼渣与水稻秸秆1∶1混合,麸皮为氮源时,可有效提高混合菌群产酶活性。
关键词:沼渣;纤维素降解菌;酶活;混合菌群
李文哲,朱巧银,范金霞,等.纤维素高效降解菌群构建及产酶底物优化[J].东北农业大学学报, 2016, 47(1): 81-86. Li Wenzhe, Zhu Qiaoyin, Fan Jinxia, et al. Construction of microbial community with high cellulose-degrading capacity and optimization of fermentation substrate[J]. Journal of Northeast Agricultural University, 2016, 47(1): 81-86. (in Chinese with English abstract)
农作物秸秆纤维素含量高,纤维素分子质量大,一般由1 400~10 000个葡萄糖分子组成,呈直线排列,分子间以牢固化学健连接,性质稳定,实际应用中难于降解。因此,筛选纤维素降解能力高菌株,提高纤维素酶产生菌产酶活性,实现木质纤维素类物质快速降解受到关注[1-4]。目前纤维素分解菌研究广泛,微生物主要以真菌及部分细菌为主[5-7]。
本研究提出采用沼渣液与农作物秸秆混合堆肥,既可解决沼液沼渣肥料化,又可避免沼气工程排放沼渣液造成二次污染。通过平板初筛从腐烂竹子、玉米秸秆中筛选出纤维素降解真菌,通过测定纤维素酶活方法复筛,将获得降解纤维素能力较强菌株混合培养,构建纤维素产酶活性较强混合菌群,并优化发酵底物。
1 材料与方法
1.1材料
1.1.1菌株来源
腐烂竹子、玉米秸秆。
1.1.2沼渣及作物秸秆
沼渣取自东北农业大学工程学院沼气中试实验室,为牛粪厌氧发酵剩余物。5 000 r·min-1离心3 min,去除上清液将沉淀物45℃下低温烘干,烘干后粉碎过0.2 mm筛。玉米秸秆、水稻秸秆取自本校试验田,自然风干,粉碎过0.2 mm筛。
1.2培养基
富集培养基:1.4 g(NH4)2SO4,2.0 g KH2PO4,0.3 g MgSO4·7H2O,0.3 g CaCl2,1 g沼渣,加入1 L蒸馏水。
分离培养基:PDA(马铃薯葡萄糖琼脂)称取26.0 g,溶解于1 000 mL蒸馏水中,加热使之完全溶解,分装,121℃高压灭菌15 min备用。
种子液培养基:PD(马铃薯葡萄糖水)称取38.0 g,加入1 000 mL蒸馏水中,分装于150 mL三角瓶,121℃高压灭菌20 min待用。
Mandels营养液:1.4 g(NH4)2SO4,2 g KH2PO4,0.3 g尿素,0.3 g MgSO4·7H2O,0.3 g CaCl2溶于1 L蒸馏水。
液体产酶培养基:50 mL Madels营养液中加入1 g沼渣,121℃灭菌20 min。
固体产酶培养基:4 g沼渣,加入10 mL Madels营养液,121℃,灭菌20 min。
1.3方法
1.3.1菌种富集
称量腐烂玉米秸秆、竹子各10.0 g,置于200 mL富集培养基中,28℃,120 r·min-1恒温培养7 d,吸取10 mL培养液加入新富集培养基中,连续富集3代。
1.3.2菌株初筛
将富集3代后培养液接种在PDA培养基上分离纯化,28℃恒温培养3~5 d,得到不同单个真菌菌落,再接种到斜面培养基中保存。
1.3.3纤维素酶活性测定
采用DNS法测定纤维素酶活性,纤维素酶活力单位定义为55℃、pH 5.0条件下,以每分钟催化底物水解生成1 μmol葡萄糖糖所需酶量定义为一个酶活力单位U。
1.3.3.1酶液制备
按5%接种比例,将种子液接种到发酵培养基中,25℃、120 r·min-1培养4 d。
液体培养:将发酵液移入离心管中,3 000 r·min-1离心10 min,取上清液作为酶液。
固体培养:发酵结束后,加入30 mL乙酸-乙酸钠缓冲液(pH 5.0),25℃恒温震荡30 min,剩余步骤与液体培养相同。
1.3.3.2酶活性测定
①内切型葡聚糖酶(Cx)[8]:以1.5 mL 0.5%用0.2 mol·L-1pH 5.0乙酸-乙酸钠缓冲液配制CMCNa为底物,加入1 mL酶液,55℃水浴保温30 min,加2.5 mL DNS终止反应,摇匀,沸水浴10 min,冷水浴10 min,用蒸馏水稀释到适合浓度,混匀在540 nm下测定吸光度。2.5 mL DNS加1.5 mL蒸馏水作空白对照。
②外切型葡聚糖酶(C1)[9]:以1.5 mL 0.5%用0.2 mol·L-1pH 5.0乙酸-乙酸钠缓冲液配制微晶纤维素为底物,55℃保温60 min,其余同CMCase。
③β-葡萄糖苷酶活(CB)[10]:以1.5 mL 0.5%用0.2 mol·L-1pH 5.0乙酸-乙酸钠缓冲液配制水杨素为底物,其余同Cx。
④滤纸酶活(FPA)[11]:将50 mg滤纸浸入1.5 mL乙酸-乙酸钠缓冲液中,后加入1 mL酶液,50℃水浴条件下反应60 min,加入2.5 mL DNS试剂终止反应,沸水浴10 min,冷水浴10 min,用蒸馏水稀释到适合浓度,混匀在540 nm下测定吸光度。用2.5 mL DNS加1.5 mL蒸馏水作空白对照。
按如下公式计算纤维素酶活力。
纤维素酶活力(U·g-1)=r×Df×1 000/180v/t
式中,r-通过OD540值从标准曲线上查得与葡萄糖标准溶液相对应浓度(μg·mL-1);v-反应酶液体积;t-反应时间;Df-稀释倍数。
1.3.4菌株复筛
将初筛得到菌株接种到PD培养基中,28℃、120 r·min-1恒温培养96 h获得种子液,按照5%接种量接种到液体培养基中,28℃、120 r·min-1恒温培养96 h,分别测定Cx酶活、C1酶活、CB酶活及FPA酶活,筛选出产酶活性较高菌株。
1.3.5菌株混合培养
将复筛获得产酶活性较高菌株混合培养,各组合中菌株均按照1∶1比例分别接种于液体和固体产酶培养基中,通过测定Cx酶活、C1酶活、CB酶活及FPA酶活优选出产酶活性最高混合菌群及适宜培养基。
1.3.5.1高效降解纤维素菌群优选
将复筛获得产酶活性较高株真菌均按照1∶1混合培养,得到9种组合方案:1(Cro-2/Bam-Q/ Bam-3/Bam-1);2(Cro-2、Bam-Q、Bam-3);3 (Bam-Q、Bam-3、Bam-1);4(Cro-2、Bam-3、Bam-1);5(Cro-2、Bam-Q)6(Bam-Q、Bam-3);7(Bam-3、Bam-1);8(Cro-2、Bam-3);9 (Cro-2、Bam-1)。将以上9种组合分别接种到液体、固体培养基中,液体培养,25℃、120 r·min-1恒温培养4 d;固体培养,25℃恒温培养4 d,摇动1次·d-1,测定酶活。
1.3.5.2氮源优选
去除Mandels营养液中含氮试剂,分别向培养基中加入0.4 g麸皮、豆粕、玉米粉、黄豆粉、尿素、硝酸铵、硫酸铵、硝酸钠作为氮源,25℃恒温培养4 d,摇动2~3次·d-1,发酵结束后测定酶活。
2结果与分析
2.1菌株初筛
将腐烂玉米秸秆、竹子在富集培养基中连续富集3代,再通过PDA培养基分离纯化,共得到真菌11株,将其接种到斜面培养基中,28℃恒温培养96 h,保存于4℃冰箱中。
2.2菌株复筛
纤维素酶是纤维素水解酶总称[12-14],研究表明,纤维素酶为内切型葡聚糖酶、外切型葡聚糖酶、β-葡萄糖苷酶组成。滤纸酶活表征纤维素酶系总酶活力,反映各组分酶协同作用[15]。
本研究通过测定以上4种酶活性,作为优选降解纤维能力较强菌株依据。将分离所得11株真菌接种到液体培养基中,培养4 d后测定酶活,结果见表1。
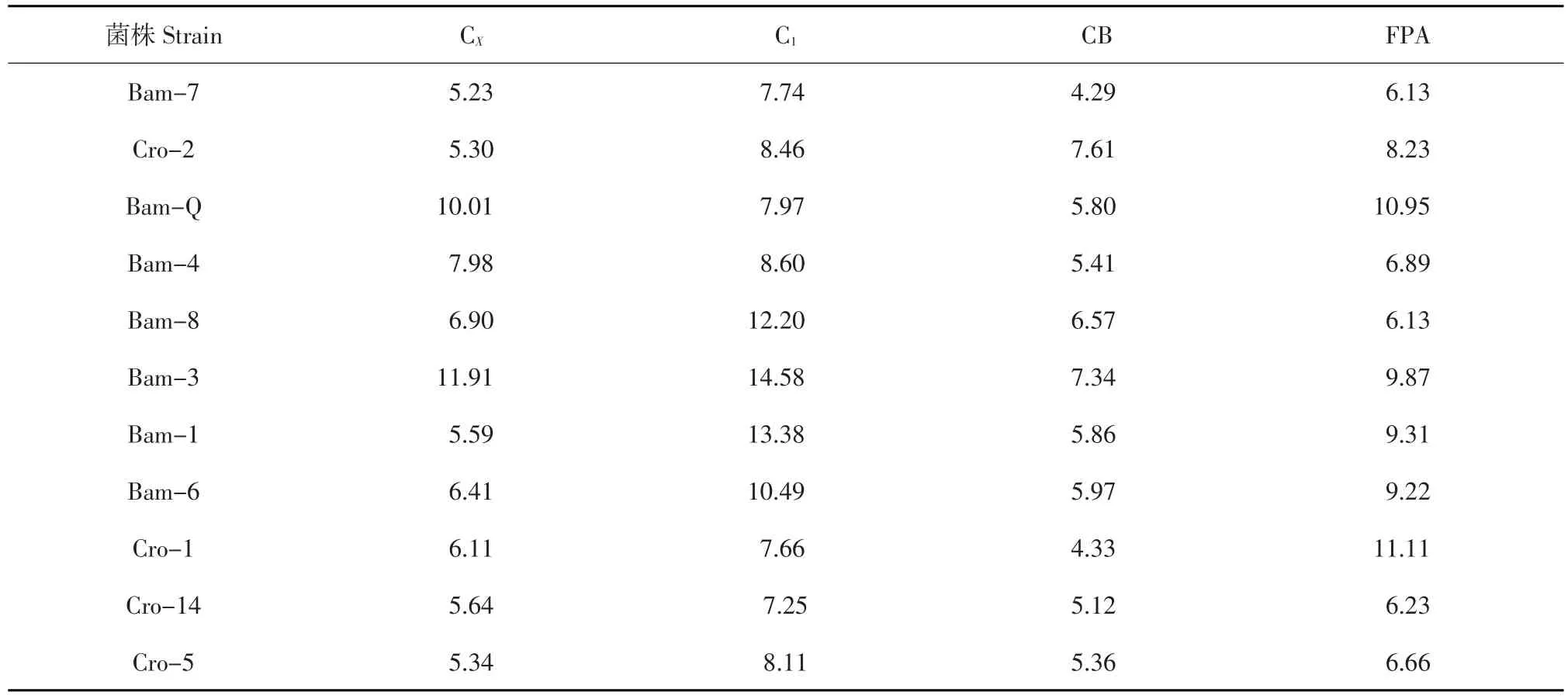
表1不同菌株酶活力测定结果Table1 Result of enzyme activity of different strains (U)
由表1可知,Bam-Q和Bam-3 CX酶活性较高;Bam-3 C1酶活最高,Bam-1和Bam-6次之;Cro-2 CB酶活性最高,Bam-3略低于Cro-2;综合酶活性Bam-1最高。经4种不同纤维素酶活性综合评定Cro-2、Bom-Q、Bom-3、Bom-1为纤维素降解降解能力较高菌株。
由表1可知,不同菌株同种纤维素酶活不同,而同菌株不同纤维素酶活存在差异性。因此,提高菌株对纤维素降解能力需各种酶协同作用,这也是单一菌株降解纤维素效率较低主要原因[16]。
2.3高效降解纤维素菌群优选
发酵结束后,各组合酶活性测定结果见表2~3。
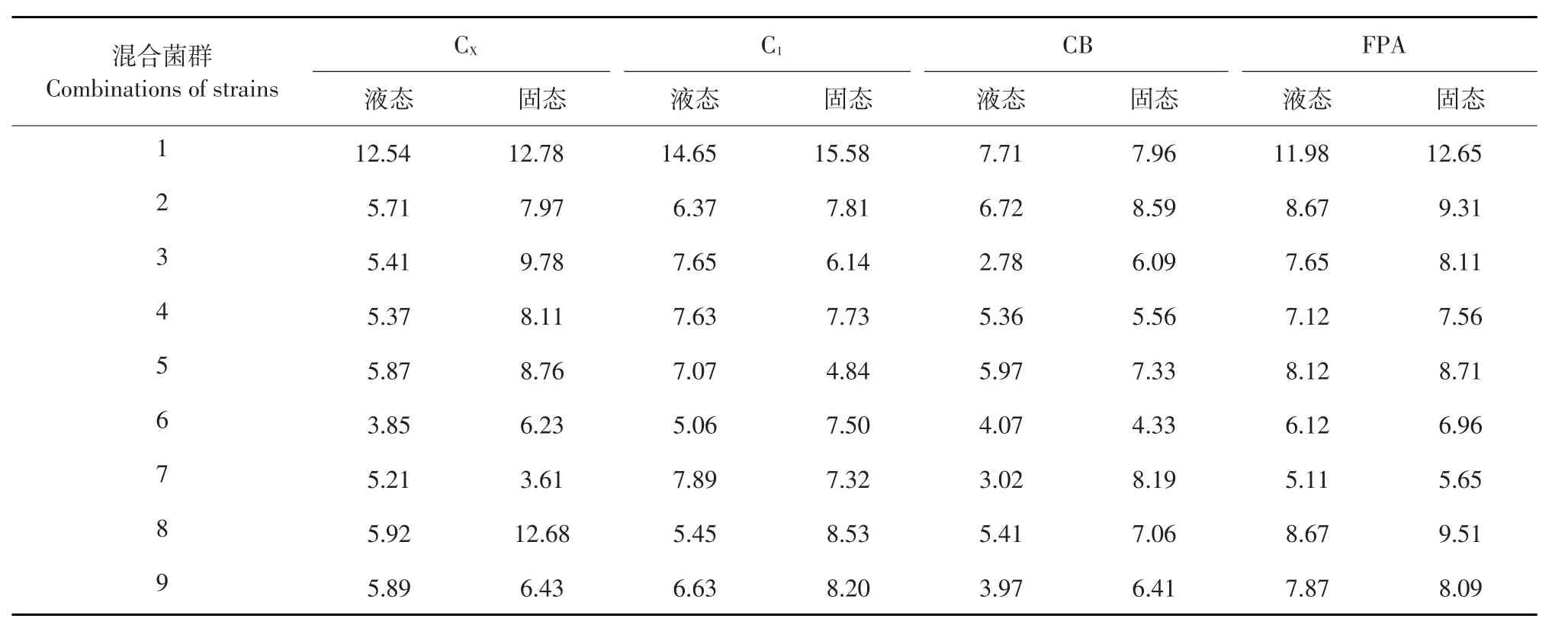
表2不同混合菌群酶活性Table 2 Enzyme activity of different cellulose-degrading strains (U)
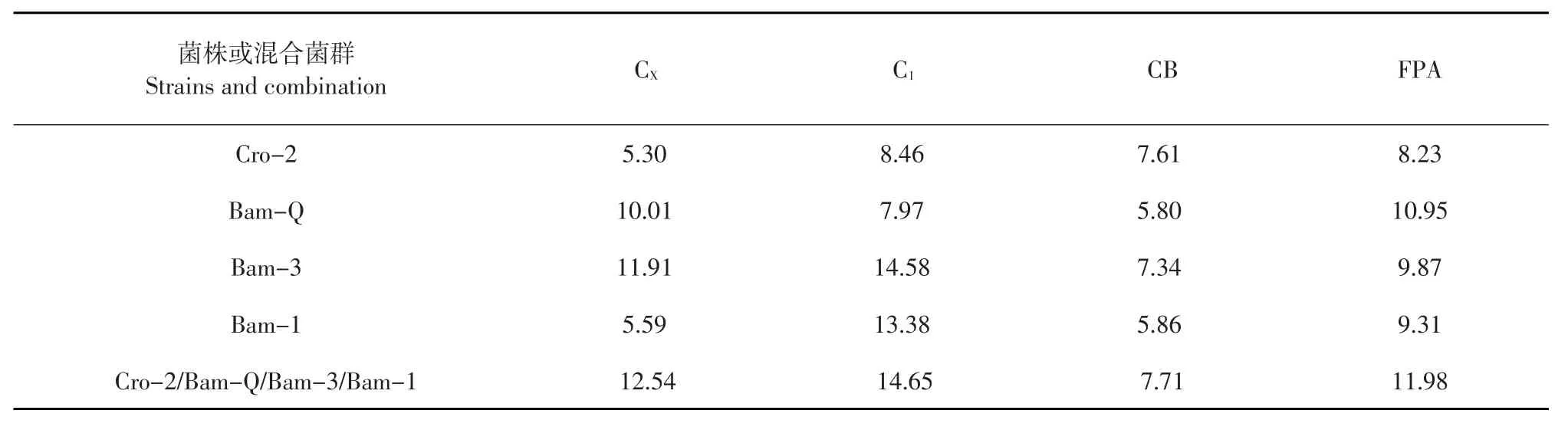
表3单一菌株与混合菌群酶活性比较Table 3 Comparison of the enzyme activity of cellulose-degrading strains and combination (U)
由表2~3可知,液体或固体培养基中,当Cro-2、Bam-Q、Bam-3、Bam-1四株真菌按照1∶1∶1∶1比例时,4种纤维素酶活性均最高,且均高于单一菌种产酶活性。原因是:组合培养能利用不同菌株不同作用效果差异互补,酶系比例协调,提高发液体培养产酶能力[17]。Bam-Q和Bam-3单独培养时,酶活性较高,但将其混合培养,在所有组合中酶活性最低,酶活大幅低于其单独培养,可能是由于Bam-Q和Bam-3混合培养时,产生拮抗作用,抑制产酶。对于同一种组合液体培养和固体培养,固体培养产酶活性高于液体培养。这是由于固体培养营养物质浓度高,碳源、氮源及沼渣中含有微生物生长所需微量元素充足,促进菌株生长繁殖,提高产酶量。
2.4碳源优选
将沼渣、玉米秸秆、水稻秸秆单一及按1∶1比例混合作为发酵底物,将Cro-2、Bam-Q、Bam-3、Bam-1按1∶1∶1∶1比例接种于固体培养基,研究不同底物对混合菌群产酶影响。纤维素酶活性测定结果见表4。
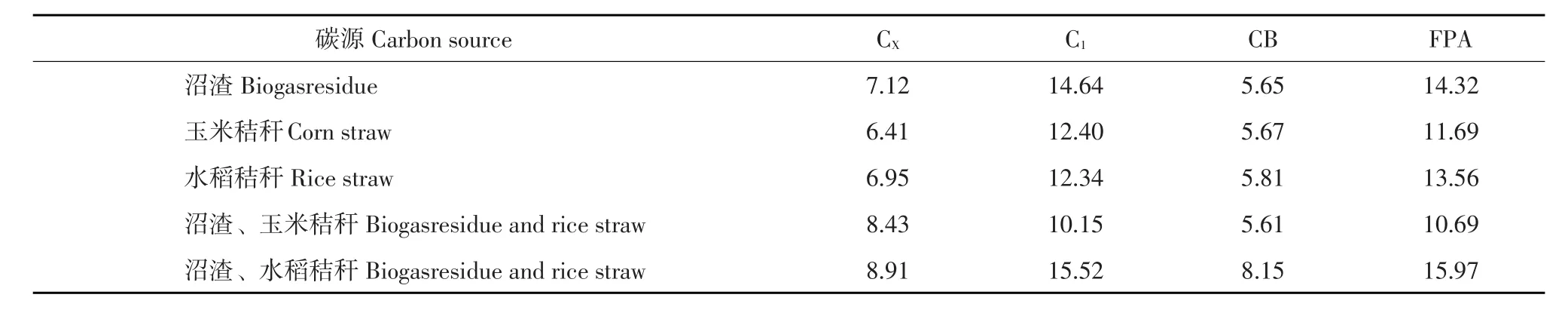
表4不同碳源对产酶影响Table 4 Effect of various carbon source on cellulase production (U)
纤维素酶是诱导酶,底物不同微生物产纤维素酶活性不同[18]。农作物秸秆及沼渣中含有大量纤维素,对纤维素酶产生诱导作用。碳源在微生物繁殖过程中起决定性作用,碳源在满足微生物生长及产酶条件下,才能产生更多纤维素酶,促进纤维素分解。由表4可知,当采用单一碳源发酵时,沼渣作为碳源CX酶活性最高,玉米秸秆作为碳源CB酶活性最高,水稻秸秆C1与FPA酶活性均最高。这是由于不同碳源诱导作用不同,同一种碳源不同纤维酶活性不同,不同碳源同一种纤维
素酶活性存在差异。当沼渣与水稻秸秆1∶1混合时,4种纤维素酶活均最高。
2.5氮源优选
发酵结束后测定酶活结果见表5。
氮源种类和性质是影响酶活力和产量重要因素,氮源通过影响酶蛋白前体形成,调控酶合成[19]。本试验采用4种有机氮源和4种无机氮源研究其对酶活力影响。由表5可知,麸皮作为氮源时,CX、CB、FPA酶活性均最高,黄豆粉作为氮源时,C1酶活最高。
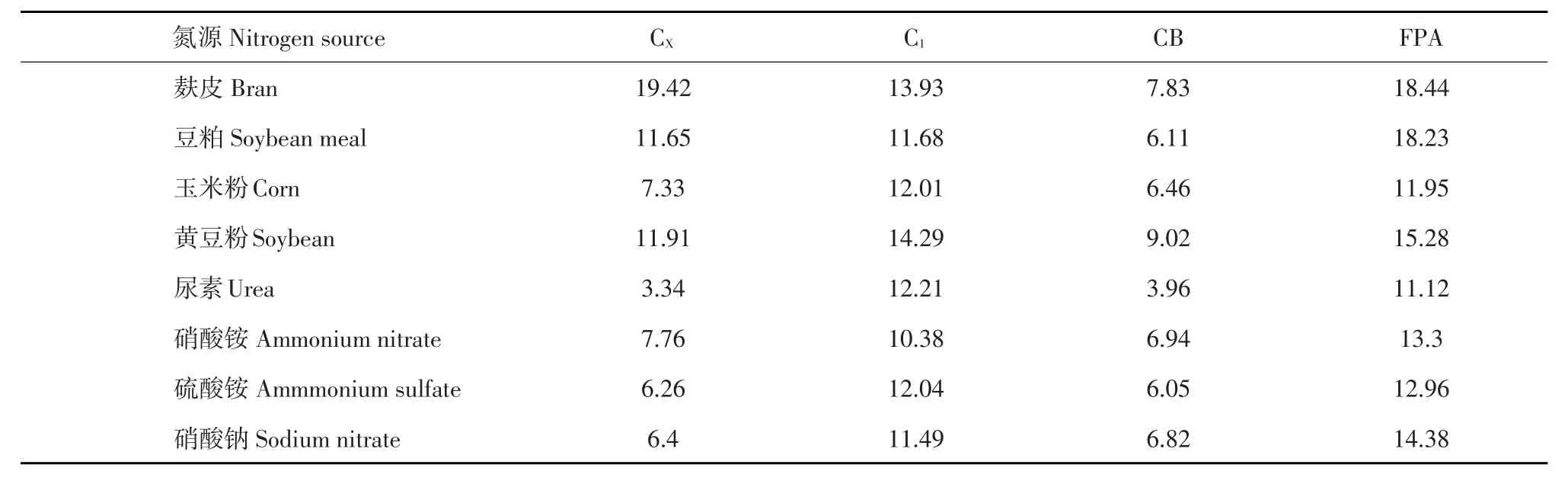
表5不同氮源对产酶影响Table 5 Effect of different nitrogen source on cellulase production (U)
3讨论
牛粪厌氧发酵剩余物主要成分是纤维素,沼渣与玉米秸秆混合堆肥,纤维素含量较高,制约堆肥腐熟。添加纤维素降解能力较强的微生物菌剂可促进纤维素降解,加快堆肥进程。但纤维素结构复杂,纤维素降解须由多种酶协同完成,单一菌种对纤维素降解效果不理想,通过四株菌组合培养,获得高效混合菌群,其Cx、C1、CB、FPA酶活与单一菌种比较均有提高。
碳源和氮源对微生物产酶活性影响显著。本试验采用玉米秸秆、水稻秸秆和沼渣为碳源,作物秸秆纤维素含量是制约堆肥腐熟主要因素,而沼渣中营养成分丰富,包含大量微生物生长重要营养元素。使用单一碳源时,产酶活性沼渣>水稻秸秆>玉米秸秆,将沼渣分别与水稻秸秆、玉米秸秆按1∶1混合添加到培养基中,以水稻秸秆与沼渣按照1∶1混合时,产酶活性提高,可能因沼渣与玉米秸秆按1∶1混合所含营养成分适合B混合菌群生长且含有适合菌群产酶因子。
氮源优选酶活性测定结果表明,不同氮源对不同纤维素酶活表现产酶活性差异显著,同种氮源,对不同纤维素酶酶活性影响差异显著。有机氮源产酶活性优于无机氮源,原因是有机氮成分复杂,能为微生物生长提供氮源,包含糖类、淀粉等易分解有机物和氨基酸、微量元素等微生物生长所需营养成分,在发酵初期,促进菌株生长与繁殖。
4结论
a.从腐烂竹子和玉米秸秆中分离出11株产纤维素酶真菌,通过酶活性测定,筛选出Cro-2、Bam-Q、Bam-3、Bam-1 4株降解纤维素能力较强菌株。
b.将4株菌株组合培养,通过酶活性比较综合评定,获得产酶活性最高混合菌群,Cro-2、Bam-Q、Bam-3、Bam-1按1∶1∶1∶1混合。
c.将混合菌群接种到以沼渣和水稻秸秆按1∶1混合,麸皮作为氮源发酵底物培养基中,产酶活性得到有效提高,CX、C1、β-Gase、FPA酶活性分别为19.42、13.93、7.83、18.44 U。
[参考文献]
[ 1 ]唐景春.生物质废弃物堆肥过程与调控[M].北京:中国环境科学出版社, 2010.
[ 2 ]陈洪章,李佐虎.纤维素原料微生物与生物量全利用[J].化工科技市场, 2001(5): 17-20.
[ 3 ]齐云,袁月祥,陈飞,等.一组纤维素分解菌分离、筛选及其产酶条件研究[J].天然产物研究与开发, 2003, 15(6): 235-237.
[ 4 ]高榕,邓迎达.高生产效率纤维素酶菌株初筛方法研究[J].纤维素科学与技术, 2004, 12(3): 20-24.
[ 5 ] Shafique S, Bajwa R, Shafique S. Cellulase biosynthesis by select⁃ed Trichodema specie[J]. Pak J Bo, 2009, 41(2) : 907-916.
[ 6 ] Sridevi A, Narasimha G, Reddy B R. Production of Cellulase by Aspergillus niger on natural and pretreated lingo cellulosic wastes [J]. The Internet Journal of Microbiology, 2009(7): 1-8.
[ 7 ] Singh R, Varma A J, Laxman A S, et al. Hydrolysis of cellulose de⁃rived from steam exploded bagasse by Penicillium cellulases: Com⁃parison with commercial cellulase.[J]. Bioresource Technology, 2009, 100(24) : 6679- 6681.
[ 8 ] Mandels M, Sternberg D. Recent advances in cellulose technology [J]. Ferment Techno, 1976, 54(4): 267-286.
[ 9 ]楚春雪,李多川,郭润芳.一株嗜热毛壳菌β-葡萄糖苷酶的分离纯化及特性[J].菌物学报, 2004, 23(3): 397-402.
[10]高榕,邓迎达.高生产效率纤维素酶菌株初筛方法研究[J].纤维素科学与技术, 2004, 12(3): 20-24.
[11] Mandelsm, Andreottir, Roche C. Measurement of saccharifying cellulase[J]. Biotechnol Bioeng Symp, 1976(6): 21-23. .
[12] Ghose T K. Bioconversion of cellulosic substances into chemicals, energy and microbia1 protein[M]. New Delhi: IIT, 1978.
[13] Gerrit B, Pettersson B. Extracellar enzyme system utilized by the fungus for the breakdown of cellulose[J]. Eur J Biochem, 1985, 146: 301-308.
[14] Wood T M. Purification and some properties of a (1, 4)-B-D-glu⁃can glucohydrolase associated with the cellulose[J]. Biochem J, 1968, 109: 217-227.
[15]黄艳,覃拥灵,凌敏,等.不同碳源诱导康氏木霉产纤维素酶研究[J].中国酿造, 2008(8): 41-44.
[16]卢月霞,尹会兰,黄慧敏,等.纤维素酶产生菌筛选及其相互作用研究[J].河南农业科学, 2010(1): 59-62.
[17]裴宇航.降解秸秆微生物菌种筛选及高效菌群构建[D].天津:天津理工大学, 2012.
[18]黄晓梅,杨谦,陈秀玲,等.秸秆降解菌株诱变选育及发酵条件研究[J].哈尔滨工业大学学报, 2011,43 (2): 60-65.
[19] Acharya P B, Acharya D K, Modi H A. Op-timization for cellu⁃lase production by Aspergillus niger using saw dust as substrate [J]. Afr J Bio-technol, 2008, 22(7): 4147 -4152.
Construction of microbial community with high cellulose-degrading capacity and optimization of fermentation substrate
LI Wenzhe, ZHU Qiaoyin, FAN Jinxia, DING Qinghua, LI He(School of Engineering, Northeast Agricultural University, Harbin 150030, China)
Abstract:In order to promote maturity of the compost, shorten the composting period, therefore, four strains with high cellulose degradation capacity were isolated from rotten bamboo and corn straw. The strains were mixed cultivation, the results showed that Cro-2/Bam-Q/Bam-3/Bam-1were the best community. And the highest activity of Cx, C1, CB and FPA of community was12.54, 14.65, 7.71, 11.98 U, respectively, all the findings illustrated that the cellulose degradation capacity of community was more effective than any single strain. Studied effect of various fermentation substrates on cellulase production which was showed when the renewal was mixed with rice straw 1:1, bran as nitrogen source, could effectively improve the mixture producing enzyme activity.
Key words:biogas residue; cellulose-degrading microorganism; enzyme activity; microbial community
作者简介:李文哲(1955-),男,教授,博士,研究方向为生物质转化及利用。E-mail: liwenzhe9@163.com
基金项目:“十二五”国家科技支撑计划资助项目(2011BAD15B04)
收稿日期:2015-04-19
中图分类号:S182
文献标志码:A
文章编号:1005-9369(2016)01-0081-06

