大豆细菌性斑点病抗性品种和种质资源筛选
陈庆山,于仁敬,辛大伟,孟 辉,邹佳男,魏 巍,林美静,付 营,刘 洋,刘丽敏,刘春燕,蒋洪蔚(.东北农业大学农学院,哈尔滨 50030;.黑龙江省农垦科研育种中心,哈尔滨 50090)
大豆细菌性斑点病抗性品种和种质资源筛选
陈庆山1,于仁敬1,辛大伟1,孟辉1,邹佳男1,魏巍1,林美静1,付营1,刘洋1,刘丽敏1,刘春燕2,蒋洪蔚2
(1.东北农业大学农学院,哈尔滨150030;2.黑龙江省农垦科研育种中心,哈尔滨150090)
摘要:近年我国东北大豆产区细菌性斑点病发生严重,影响大豆品质和产量。采用室内高压喷雾接种法,利用分离的假单胞杆菌Psgneau001菌株接种黑龙江省主栽品种211份和东北大豆核心种质192份材料,进行抗性鉴定。结果表明,黑龙江省主栽品种抗性材料占34%,感病材料占51%,中间材料占15%;东北大豆核心种质抗性材料占57%,感病材料占26%,中间材料占17%。试验所获抗病种质资源可为大豆抗病育种提供优质候选材料。
关键词:细菌性斑点病;大豆;抗性鉴定;种质资源
陈庆山,于仁敬,辛大伟,等.大豆细菌性斑点病抗性品种和种质资源筛选[J].东北农业大学学报, 2016, 47(1): 1-8.
Chen Qingshan, Yu Renjing, Xin Dawei, et al. Identification of soybean cultivars and lines for resistance and germplasm screening to bacterial blight[J]. Journal of Northeast Agricultural University, 2016, 47(1): 1-8. (in Chinese with English abstract)
大豆是一年生草本豆科植物,喜温、耐阴,是我国重要粮油兼用作物[1]。大豆细菌性斑点病由丁香假单胞菌大豆致病变种(Pseudomonas syringae pv. glycinea (Psg)引起[2],是一种大豆常见细菌性病害。大豆细菌性斑点病,可侵染大豆叶片、叶柄、茎和豆荚,但主要使叶片受损。早期呈现多边形透明水渍病斑,后期黄色至淡黄色斑,褐斑在中间,由褪绿斑晕圈环绕,病叶易脱落。美国因细菌性病害造成的大豆减产可达4%~40%[3-4]。我国病害主要分布于东北、黄淮流域各大豆主产区,北方大豆种植区域病害重于南方。目前全基因组测序的丁香假单胞菌大豆致病变种有Psg race 4、Psg B076[5]。近年来随大豆细菌性斑点病加剧,越来越多的假单胞菌被分离鉴定,其致病机理研究也在逐步深入。
国外抗病大豆品种有P.I.68708,Flambeau,Norchief,P.I.189968[6],Avery[7],耐病品种有Williams79,感病品种有Harosoy、Acme、P. I. 132207、Pershing[2]。国内张佳环等认为绥农7号、合丰31、黑农31、吉农1号、吉农4号表现为抗病[8]。孙永吉等认为吉林2号、吉林7号、延农7号、黑农9号、黑农25、东农5号、合丰15、合丰18、铁丰18、铁丰20表现为抗病[9]。张淑珍等认为吉林2号、吉林7号、吉林35、黑农25、铁丰18、铁丰20、九丰4号、九丰5号、黑河9号、合丰15、东农42表现为抗病[10]。目前研究者鉴定结果差异较大,大豆品种表现为抗病或感病是病原菌与大豆相互作用的结果。如果来自于病原物的无毒基因(Avr gene)编码与大豆特异性相互作用的激发子,被相应R基因产物识别并诱导寄主防卫反应,使大豆产生对病原物侵染抗性,表现小种与品种特异互作的不亲和性(抗病)。Avr基因失活或缺乏,则表现小种与品种互作亲和性(感病)[11]。丁香假单胞菌HopZ能抑制拟南芥免疫反应,引起植株感病[12];菜豆中将抗细菌性斑点病基因定位在Psy1和Psy2上[13]。
目前大豆细菌性斑点病抗病性评价接种方法主要有高压喷雾法[8-9]、针刺法[14]、高压喷雾-涂板调查法[15]。我国细菌性斑点病抗性鉴定方法及抗性资源筛选结果尚无系统报道,抗病资源不足,因此种质资源抗细菌性斑点病研究,对大豆抗病育种具有重要意义。本试验采用涂板调查法,鉴定东北地区403份大豆品种,以期为抗病育种及分子生物学试验提供可靠理论依据。
1 材料与方法
1.1材料
1.1.1供试菌株
供试菌株采自佳木斯大豆发病叶片,经分离、纯化和柯赫氏法则[16]鉴定菌株为Psgneau001。
1.1.2供试大豆品种
目前国内外尚无标准的大豆细菌性斑点病抗性鉴定的抗感品种对照,因此抗性鉴定选用的对照品种为黑龙江省农垦科研育种中心筛选的抗病品种野生豆ZYD00006和感病品种绥农14。鉴定的种质资源分别为东北大豆核心种质192份材料及黑龙江省主栽品种211份材料。
1.2方法
1.2.1接种方法
将病原菌Psgneau001置于KB液体培养基220 r·min-1,28℃培养过夜。3 000 r·min-1室温离心10 min,去除上清,10 mmol·L-1MgCl2重悬菌体,并检测OD600吸光值(1 OD约为5×108cfu·mL-1),计算细菌浓度,将菌液稀释至1×105cfu·mL-1,加入Silwet L-77至终浓度为0.05%,混匀,准备高压喷射侵染。
每个品种设置5次重复,播种于育苗钵中,放置光照培养箱内,16 h光照,8 h黑暗,24℃培养18 d,至第1片三出复叶完全展开。同时种植感病对照绥农14和抗病对照野生豆ZYD00006。取长势相近第1片三出复叶,利用电动高压喷枪,从叶片背面,避开主叶脉,将菌液喷射入叶片中,以接种处叶片区域湿润为标准,呈水渍状。避免过度接种,损伤叶片。
1.2.2病情统计方法
接种后4 d,用打孔器取等量三片叶碟,300 μL 10 mmol·L-1MgCl2中充分研磨,稀释适当倍数,涂布于50 μg·mL-1羧苄青霉素KB固体培养基,培养2 d后,统计平板细菌数量,比较细菌生长情况。以野生豆ZYD00006和绥农14平均菌落个数为对照,进行成对t测验。
接种后12 d,统计叶片发病情况。以叶片为单位按0~4级调查发病情况:0级-全株无病斑;1 级-接菌植株与正常植株无异,褐色斑点和褪绿面积占叶片总面积10%以下;2级-接菌叶片明显出现褪绿和褐色斑点,发病面积占叶片总面积10%~25%;3级-病斑面积占叶片总面积25%~ 60%;4级-病斑面积占叶片总面积60%~80%,叶片枯黄脱落。结合菌落个数和接种12 d后叶片发病情况,判断大豆品种抗感情况。
1.2.3数据分析
数据采用SPSS 19.0统计软件进行统计分析。
2结果与分析
2.1高压喷雾-涂板调查法与叶片发病情况比较分析
利用高压喷雾法接种不同大豆品种,4 d后涂板调查,统计平均菌落个数,12 d后观察叶片发病情况。
图1为抗病品种抗线4号、感病品种绥农32、中间材料吉农22、绥农14以及ZYD00006平板菌落个数对比,绥农32菌落数明显多于感病对照绥农14、抗病对照ZYD00006、抗病品种抗线4号以及中间材料吉农22。图2为接种12 d后叶片发病情况对比,12 d后绥农32叶片发病明显重于其他4份材料,抗病品种抗线4号和ZYD00006三出复叶无明显病斑,平均菌落个数与大豆叶片发病情况紧密相关。
2.2黑龙江省主栽品种抗性筛选
黑龙江省主栽品种抗病材料共72份见表1,主要有黑河15、合丰50、嫩丰15、东农48、绥农8号、东农42、抗线4号、绥农2号、东农45、吉育97等。中间材料共31份,主要有吉农22、黑农52、垦农2号、黑河23和32等。感病材料共有108份,主要有绥农30、北豆16、合丰54、合丰40、绥农32、绥农28、垦农28、北豆3号、垦豆28、绥农22等。
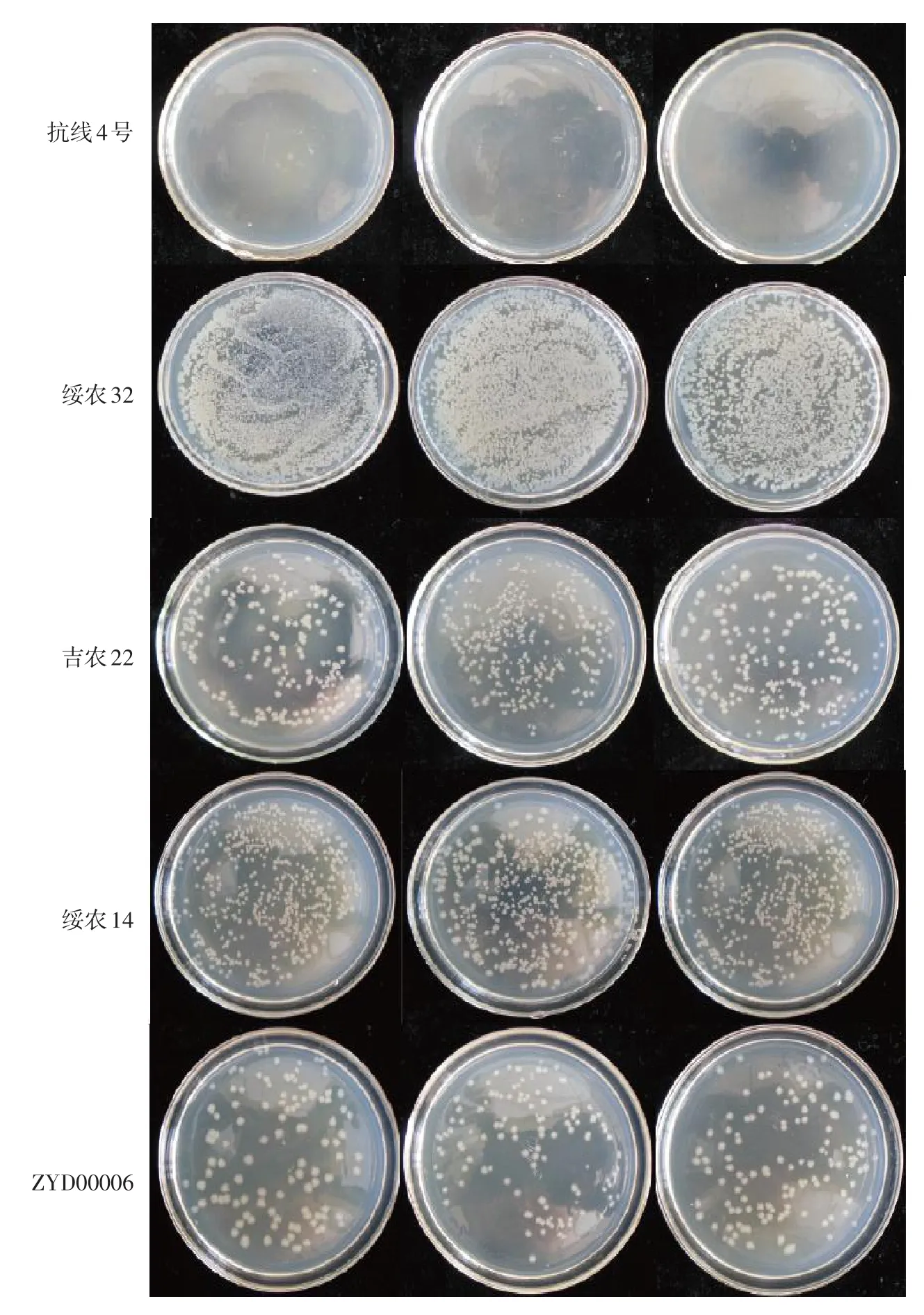
图1不同品种接菌4 d后取样涂板菌落个数对比Fig. 1 Comparison of colony number on plate culture among different varieties after inoculated 4 d

图2接种Psgneau001 0和12 d叶片发病情况Fig. 2 Leaf symptom after inoculated Psgneau001 0 and 12 d
表1黑龙江省大豆主栽品种抗性材料Table 1 Resistant materials of Heilongjiang Province soybean main varieties
抗感品种间菌落个数差异较大,图3为不同品种平均菌落数散点图,平均菌落数最大值为4 000个,最小值为1个,菌落数主要分布在0~1 000个区间内。
图4为黑龙江省主栽品种抗感比例,抗性材料占34%,感病材料占51%,中间材料占15%。
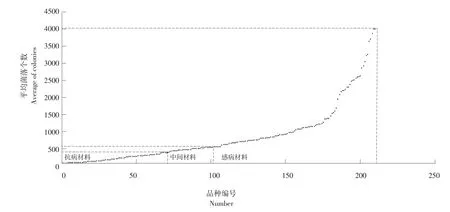
图3黑龙江省大豆主栽品种平均菌落数散点图Fig. 3 Scatter diagram with colonies number of Heilongjiang Province soybean main varieties
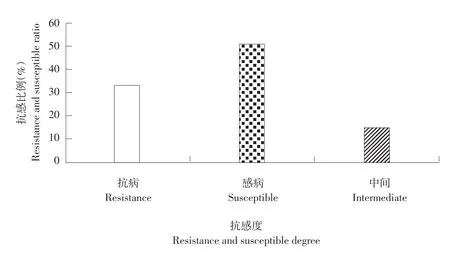
图4黑龙江省大豆主栽品种抗性比例Fig. 4 Resistant ratio of Heilongjiang Province soybean main varieties to soybean bacterial spot disease
2.2东北大豆核心种质抗性筛选
东北大豆核心种质抗病材料共110份见表2,主要有黑河27、黑河19、绥农1号、大粒黑豆、黑交01-1778、Hodgson、抗线2号、黄宝珠、嘟噜豆、L68-560。中间材料共33份,主要有黑河13、黑河29、北丰9号、黑河11和六十天还仓等。感病材料共49份,主要有黑农37、石大1号、薄地高、吉育93、吉育57、T295H、L65-237、L61-1069、L67-225、Nattosan等。抗感品种间菌落个数差异较大,图5为不同品种平均菌落数散点图,平均菌落数最大值为4 189个,最小值为1个,菌落数主要分布在0~1 000个区间内。东北大豆核心种质抗感比例见图6,抗性材料占57%,感病材料占26%,中间材料占17%。
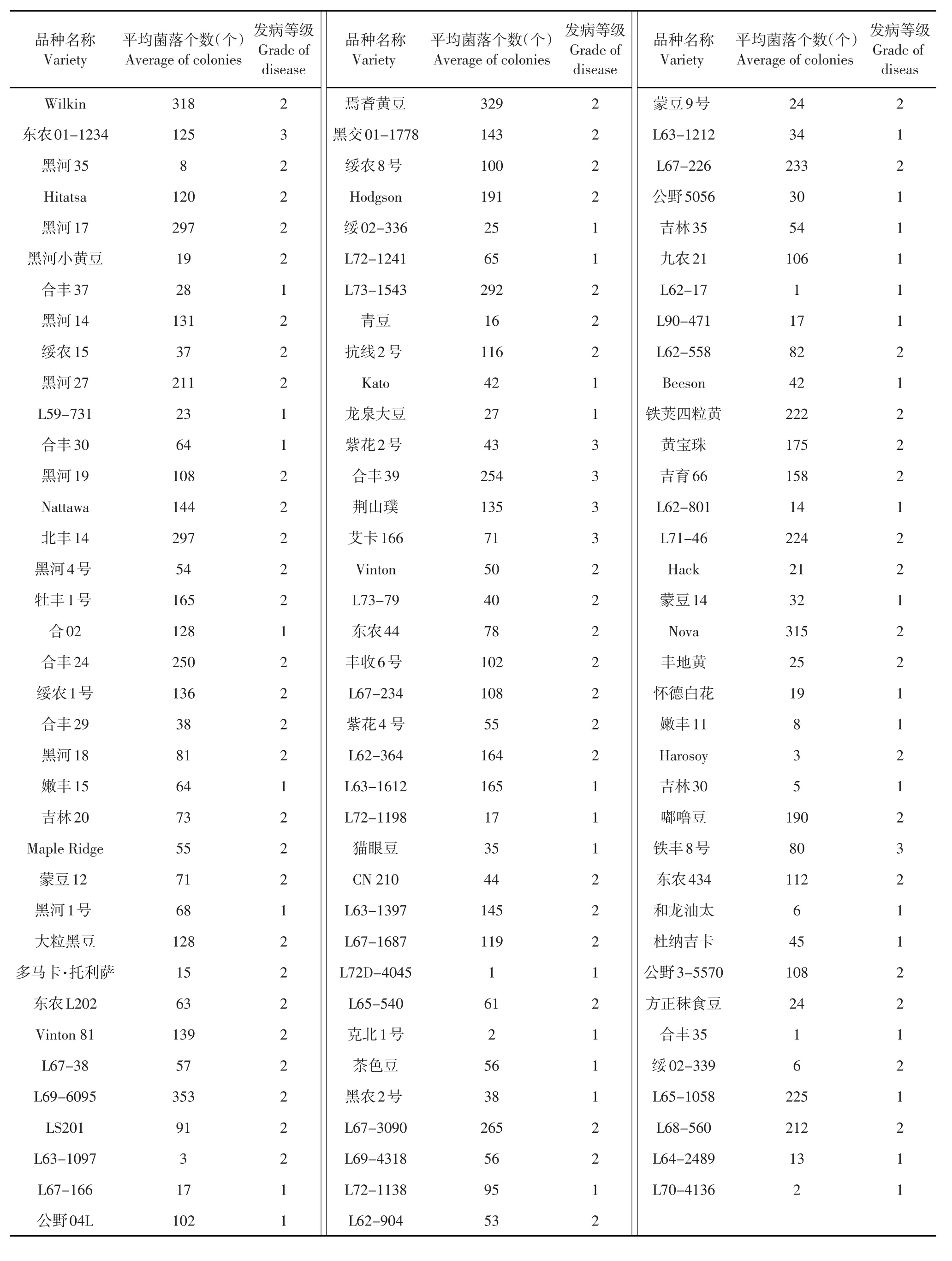
表2东北大豆核心种质抗性材料Table 2 Resistant variety of Northeast soybean core collection
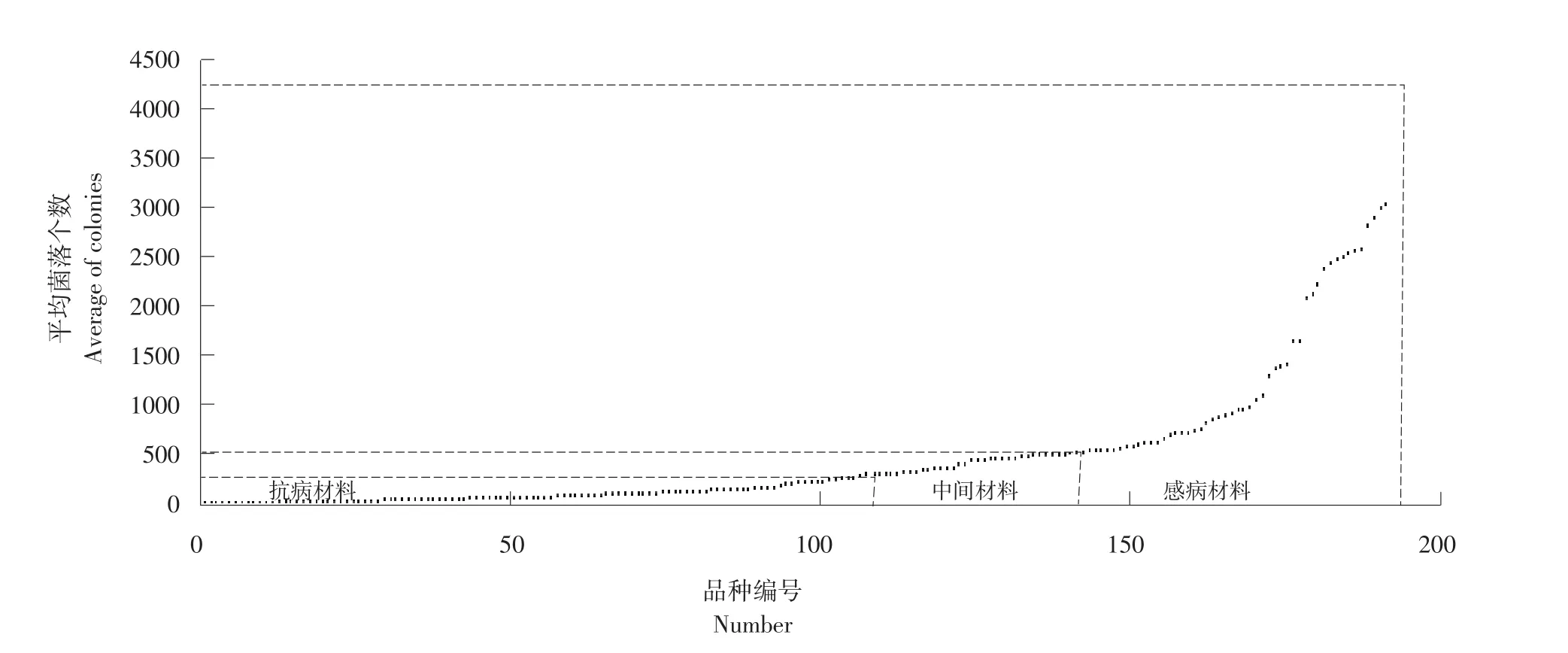
图5东北大豆核心种质平均菌落数散点图Fig. 5 Scatter diagram with colonies number of Northeast soybean core collection
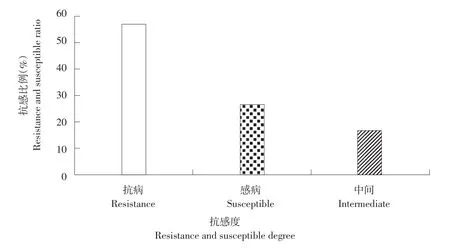
图6东北大豆核心种质抗性比例Fig. 6 Resistant ratio of Northeast soybean core collection to soybean bacterial spot disease
3讨论与结论
目前细菌性斑点病抗性鉴定方法主要有高压喷雾法[8-9]、针刺法[14]、高压喷雾-涂板调查法[15]。针刺法和室内高压喷雾法是相对简单快速的室内鉴定幼苗接菌方法,但无法量化确定大豆品种是否抗病,仅以视觉分类标准判断。室外高压喷雾法是在病害流行年份,大面积初筛的简单便捷方法,可作为室内精确鉴定的初期准备,但无法准确判断抗感品种,因田间环境条件变化较大,气象温度等均不稳定,可能因年份、生态地区不同存在较大差异。高压喷雾-涂板调查法可通过接菌4 d后单位面积内病原菌数目,再结合12 d后叶片发病情况判断大豆品种抗感情况,相对于其他方法更准确、可靠。
不同品种资源对接种假单胞菌后的反应表型区别明显,一方面可能是假单胞菌遗传背景影响宿主专一性,如III型效应因子等信号分子;另一方面可能是不同大豆品种间遗传背景不同,对假单胞菌选择性不同,如存在不同识别基因和抗性基因等。
通过黑龙江省主栽品种和东北大豆核心种质抗性鉴定发现,我国东北地区存在丰富抗性资源。东北大豆核心种质内抗性材料比例高于黑龙江省主栽品种,感病资源比例明显少于黑龙江省主栽品种,可能由于东北大豆核心种质具有广泛遗传基础,包含一些野生资源和国外资源。大豆核心种质是以最小样本代表资源的最大遗传多样性,为种质资源研究利用提供便利,因此评价核心种质在各类性状上的遗传多样性对明确其遗传变异代表性和应用潜力具有重要意义。东北大豆核心种质中绥农14、绥农10、吉林30、北丰11、黑河18等常用作亲本材料,其中绥农14为感病材料,绥农10、北丰11为中间材料,吉林30、黑河18为抗病材料。利用抗性品种不断回交,改良现有农艺性状优良的感病品种,根据与目标性状紧密连锁的DNA分子标记对目标性状间接选择,在早期世代即能对目标基因转移准确、稳定选择,克服隐性基因再利用时识别困难,提高育种效率,获得农艺性状优良的抗病品种[17]。
[参考文献]
[ 1 ]王浩,王绍东,李远明,等.高效固氮大豆根瘤菌株的筛选研究[J].东北农业大学学报, 2014, 45(3): 15-19.
[ 2 ] Keen N T, Buzzell R I. New resistance genes in soybean against Pseudomonas syringae pv. glycinea: evidence that one of them in⁃teracts with a bacterial elicitor[J]. Theoretical & Applied Genet⁃ics, 1991, 81(1) : 133-138.
[ 3 ] Cross J E, Kennedy B W, Lambert J W, et al. Pathogenic races of the bacterial blight pathogen of soybeans, Pseudomonas glycinea [J]. Plant Disease Reporter, 1966, 50(8): 557-560.
[ 4 ] Chiku K, Tsunemi K, Yamamoto M, et al. Defects in D-Rhamno⁃syl residue biosynthetic genes affect lipopolysaccharide structure motilityand cell-surface hydrophobicity in Pseudomonas syringae pathovar glycinea Race4[J]. Bioscience Biotechnology and Bio⁃chemistry, 2013, 77(3): 505-510.
[ 5 ] Qi M, Wang D, Bradley C A, et al. Genome sequence analyses of Pseudomonas savastanoi pv. glycinea and subtractive hybridiza⁃tion-based comparative genomics with nine pseudomonads[J]. PLoS One, 2011, 6(1): e16451.
[ 6 ] Mukherjee D, Lambert J W, Cooper R L, et al. Inheritance of resis⁃tance to bacterial blight (Pseudomonas glycinea Coerper) in soy⁃beans (Glycine max L. )[J]. Crop Science, 1966, 6(4): 324-326.
[ 7 ] Wrather J A, Kendig S R, Anand S C, et al. Effects of tillage, culti⁃var, and planting date on percentage of soybean leaves with symp⁃toms of sudden death syndrome[J]. Plant disease, 1995, 79(6): 560-562.
[ 8 ]张佳环,高洁.大豆品种对大豆细菌性斑点病的抗性鉴定[J].大豆科学, 2000, 19(2): 180-183.
[ 9 ]孙永吉,刘宗麟,刘玉芝.大豆品种资源抗细菌斑点病鉴定与评价[J].大豆科学, 1939, 8(2): 110-115.
[10]张淑珍,徐鹏飞,吴俊江,等.黑龙江省大豆品种对细菌性斑点病的田间抗病性调查及室内接种鉴定分析[J].东北农业大学学报, 2006, 37(5): 588-591.
[11] Aguilera S, De la Torre-Zavala S, Hernández-Flores J L, et al. Expression of the gene for resistance to phaseoloto- xin (argK) de⁃pends on the activity of genes phtABC in Pseudomonas syringae pv. phaseolicola[J]. PloS one, 2012, 7(10): e46815.
[12] Lewis J D, Wilton M, Mott G A, et al. Immunomodulation by the Pseudomonas syringae HopZ type III effector family in Arabi⁃dopsis[J]. PLoS One, 2014, 9(12): e116152.
[13] Fondevilla S, Martín-Sanz A, Satovic Z, et al. Identification of quantitative trait loci involved in resistance to Pseudomonas syrin⁃gae pv. syringae in pea (Pisum sativum L. ) [J]. Euphytica, 2012, 186(3): 805-812.
[14]刘亚光,马超,冯蕾,等.几种化学诱抗剂对大豆细菌性斑点病诱导抗性的研究[J].中国油料作物学报, 2008, 30(1): 116-118.
[15] Wang J, Shine M B, Gao Q M, et al. Enhanced Disease Suscepti⁃bility1 mediates pathogen resistance and virulence function of a bacterial effector in soybean[J]. Plant physiology, 2014, 165(3): 1269-1284.
[16] Koch R. The etiology of anthrax, based on the ontogenesis of Ba⁃cillus anthracis [J]. Cohns Beitrage zur Biologie der Pflanzen, 1876, 2(2): 277-310.
[17]赵雪,韩英鹏,李海燕,等.大豆主要品质性状资源评价及分子标记分析[J].东北农业大学学报, 2014, 45(5): 1-7.
Identification of soybean cultivars and lines for resistance and germplasm screening to bacterial blight
CHEN Qingshan1, YU Renjing1, XIN Dawei1, MENG Hui1, ZOU Jianan1, WEI Wei1, LIN Meijing1, FU Ying1, LIU Yang1, LIU Limin1, LIU Chunyan2, JIANG Hongwei2(1. School of Agriculture, Northeast Agricultural University, Harbin 150030, China; 2. Land Reclamation Research and Breeding Centre of Heilongjiang, Harbin 150090, China)
Abstract:In recent years, the Pseudomonas syringae pv. glycinea induced disease of soybean had serious damage effect on the soybean quality and yield. High pressure spraying method was used to inject the soybean with Psgneau001, Pseudomonas syringaepv. glycinea, isolated by our lab, then 211 cultivars of Heilongjiang Province and 192 Northeast soybean core gemplasm were identified. The resistance phenotype showed that 34% resistance, 51% sensitivity, and 15% intermediate in 211 cultivars. The resistant phenotype in Northeast soybean germplasm was 57% resistance, 26% sensitivity, and 17% intermediate. The identified germplasm materials supply a valuable foundation for disease resistant breeding.
Key words:Pseudomonassyringaepv. glycinea; soybean; resistance identification; germplasm
作者简介:陈庆山(1973-),男,教授,博士,博士生导师,研究方向为大豆生物技术。E-mail: qshchen@126.com
基金项目:国家自然科学基金项目(31271747, 31471516)
收稿日期:2015-07-22
中图分类号:S565.1;S435.651
文献标志码:A
文章编号:1005-9369(2016)01-0001-08

