濒危植物崂山百合根围AM真菌分布特征
李 伟,孙龙燕,2,张翠萍,徐 萌,郭绍霞,2*(.青岛农业大学园林与林学院,山东 青岛 26609;2.青岛农业大学菌根生物技术研究所,山东 青岛 26609)
濒危植物崂山百合根围AM真菌分布特征
李伟1,孙龙燕1,2,张翠萍1,徐萌1,郭绍霞1,2*
(1.青岛农业大学园林与林学院,山东青岛266109;2.青岛农业大学菌根生物技术研究所,山东青岛266109)
摘要:为探明崂山百合种群密度降低过程中根围丛枝菌根(AM)真菌空间分布特征,2014年10月从崂山3个土层采集崂山百合及伴生植物玉竹(Polygonatum odoratum)根围土壤样品,分离鉴定AM真菌种类、测定菌根发育状况和孢子密度、分析AM真菌分布及其与种群密度、土壤因子(土壤有机碳、pH、碱解氮、速效磷等)相关性。从崂山百合根围分离AM真菌4属14种,玉竹根围分离3属11种。崂山百合分布于10~20 cm土层内,根系侵染率随种群密度增大而增加;大密度种群样地玉竹菌根侵染率显著高于小密度种群。崂山百合种群密度对其根系丛枝定殖率无显著影响。10~20 cm、20~30 cm土层崂山百合和0~10 cm、10~20 cm土层玉竹根系泡囊定殖率随各种群密度增大而降低。30~40 cm土层崂山百合、10~20 cm土层玉竹菌丝定殖率随高种群密度增大而增加。种群密度对崂山百合和玉竹根围孢子密度有显著影响。10~20 cm和20~30 cm土层崂山百合根围总球囊霉素含量随崂山百合种群密度增大而降低。10~20 cm和20~30 cm土层酸性磷酸酶和脲酶含量随崂山百合种群密度增大而提高。
关键词:AM真菌;崂山百合;濒危植物;土壤因子;空间分布
李伟,孙龙燕,张翠萍,等.濒危植物崂山百合根围AM真菌分布特征[J].东北农业大学学报, 2016, 47(1): 30-37.
Li Wei, Sun Longyan, Zhang Cuiping, et al. Distribution characteristic of arbuscular mycorrhizal fungi in the rhizosphere of endangered Lilium tsingtauense plants[J]. Journal of Northeast Agricultural University, 2016, 47(1): 30-37. (in Chinese with English abstract)
丛枝菌根(Arbuscular mycorrhiza,AM)真菌广泛分布于各种生态系统中,由于不同生态环境中气候类型、土壤类型、植被类型、植物多样性和物种丰富度差异,AM真菌丰富度、种群频度和多度、侵染、产孢及其生理效应不同[1]。AM真菌寄主范围广泛,除少量植物如莎草科、苋科、灯心草科、藜科、石竹科等20余科植物不能或不易形成AM菌根外,绝大多数植物均能不同程度受其侵染。据报道,大部分农作物包括粮食、蔬菜、果树、药用植物、花卉等均能与AM真菌形成良好共生关系[2]。研究发现,AM真菌各属在野生状态植物根区出现率均高于栽培植物,但不同种在野生寄主根区出现情况不同[2]。
由AM真菌产生的含金属离子球囊霉素相关土壤蛋白主要存在于AM真菌孢子壁层结构和菌丝体中,对维护AM真菌本身生物及生理功能非常重要[3]。球囊霉素相关土壤蛋白可随菌丝和孢子降解进入土壤,成为土壤有机源,其独特的黏附能力能提高土壤抗侵蚀能力和团粒结构稳定性,促进土壤恢复[4]。对球囊霉素相关土壤蛋白研究可进一步明确AM真菌在维持土壤结构、促进营养物质循环中的作用。
崂山百合(Lilium tsingtauense)又名青岛百合,集中分布于青岛崂山风景区一带,是崂山特有植物,分布范围狭窄,对生长条件要求高;自然条件下,结实率低及人为破坏,种群密度逐渐降低,已被列入国家第二批稀有濒危植物名录。本研究以当地植物群落优势种玉竹(Polygonatum odo⁃ratum)为对照,通过对崂山百合和玉竹根围土壤样品采集和对比分析,研究崂山百合在种群密度缩小过程中AM真菌空间分布及其与土壤因子相关性,进一步阐明珍稀濒危植物、丛枝菌根和土壤环境三者关系,为利用AM真菌资源促进珍稀濒危植物保护提供依据。
1 材料与方法
1.1研究区域概况
崂山位于青岛市东部崂山区,海拔高度810 m,植物覆盖率40%,温带季风气候,四季分明,光资源充足,热资源较丰富,湿润温和,年平均气温12.1℃,月平均相对湿度72%,土壤多为棕壤土。植物群落优势种主要有玉竹(Polygonatum odo⁃ratum)、菝葜(Smilax china)、山樱花(Cerasus serru⁃lata)、小米空木(Stephanandra incisa)、鼠李(Rham⁃nus davurica)、郁李(Cerasus japonica)、地榆(San⁃guisorba officinalis)、三桠乌药(Lindera obtusiloba)等,其中玉竹、菝葜属百合科植物。
1.2样品采集
2014年10月,选取崂山百合种群密度不同样地(长6 m,宽5 m)在生长良好的崂山百合(崂山百合属球根花卉,采集到的鳞茎直径在5~8 cm,根系着生在鳞茎茎盘处)及群落优势种玉竹根围分10~ 20、20~30、30~40 cm 3个土层采集土样和根样,每个土样和根样重约1 kg,重复3次。记录采样海拔高度、经度、纬度和根围环境等并编号(见表1)。
将土样装入隔热性能良好塑料袋密封带回实验室,过2 mm筛,作土壤理化成分、球囊霉素相关土壤蛋白和AM真菌孢子密度测定;样品过筛后收集根样切成1 cm根段,用于AM真菌定殖率和侵染率测定。
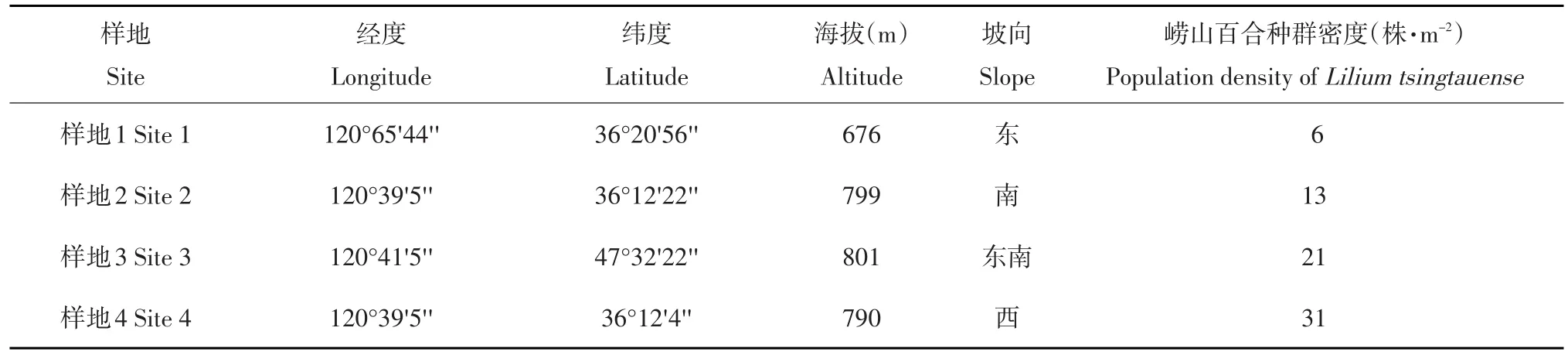
表1样地概况Table 1 Status of the sampling site
1.3试验方法
运用染色镜检法测定植物根系侵染率[5],每个处理重复3次,将根段切成0.5~1.0 cm小段放入试管中,加入10% KOH溶液,90℃水浴锅中15~20 min。去掉碱液后自来水轻轻冲洗根系3次,加入2% HCl溶液酸化5 min。去掉酸液后加入0.1%酸性品红乳酸甘油染色液(乳酸875 mL,甘油63 mL,蒸馏水63 mL,酸性品红0.1 g),室温下过夜。乳酸分色后即可镜检。于Olympus(BX51,日本)显微镜下观察测定AM真菌侵染状况。
计算公式如下[6]:
侵染率(%)=Σ(0×根段数+10%×根段数+20%×根段数+…+100%×根段数)/观察总根段数;
定殖率(%)=(AM真菌侵染根段数/检查总根段数)×100%。
每份土样中取20 g风干土,用湿筛倾析-蔗糖离心法分离AM真菌孢子[7]。体视显微镜下记录孢子数量,以每100 g风干土中含孢量计为孢子密度。
土壤有机碳测定采用重铬酸钾氧化法,土壤pH测定采用电位法,土壤碱解氮采用碱解扩散法,土壤速效磷测定采用碳酸氢钠-钼锑抗比色法[8]。
球囊霉素相关土壤蛋白[易提取球囊霉素(EEG)、总球囊霉素(TEG)]按Wright[9]和Janos[10]等方法测定。①易提取球囊霉素(EEG)测定:取1 g风干土于试管中,加入20 mmol·L-1(pH 7.0)柠檬酸钠浸提剂8 mL,103 kPa,121℃条件下连续提取90 min,10 000 g离心6 min,收集上清液。②总球囊霉素(TEG)测定:取1 g风干土于试管中,加入50 mmol·L-1(pH 8.0)柠檬酸钠浸提剂8 mL,103 kPa、121℃条件下连续提取60 min,再重复提取2次;10 000 g离心5 min,收集上清液。分别吸取上清液0.5 mL,加入5 mL考马斯亮蓝G-250染色剂,595 nm波长下比色。牛血清蛋白标液考马斯亮蓝法显色,绘制标准曲线,计算球囊霉素含量。
土壤磷酸酶测定采用改进的Tabatabai和Brimner方法[11],其活性以每克风干土培养1 h催化PNPP分解产生对硝基苯酚毫克数(mg)表示;土壤脲酶测定采用改进Hoffmann和Teicher比色法[12]。
1.4数据处理
数据经Excel 2013处理后,利用SPSS 19.0、Canoco 4.5软件进行方差、相关性、差异性等分析。
2结果与分析
2.1 AM真菌空间分布
由表2~3可知,10~20 cm土层崂山百合根系侵染率随种群密度增大而增加;玉竹根系侵染率种群密度大样地显著高于种群密度小样地(P<0.05)。随崂山百合种群密度增大,10~20 cm土层崂山百合根系侵染率分别为43.5%、46.1%、46.3%、49.4%,种群密度最大样地显著高于其他样地。
由表2~3可知,种群密度对崂山百合根系丛枝定殖率无显著影响(P<0.05);玉竹根系丛枝定殖率随种群密度增大而提高,种群密度最大样地显著高于种群密度最小的样地。崂山百合10~20 cm、20~30 cm土层和玉竹0~10 cm、10~20 cm土层根系泡囊定殖率随种群密度增大而降低,种群密度最大样地显著低于种群密度最小样地(P<0.05)。
由表2~3可知,10~20 cm和20~30 cm土层崂山百合根系菌丝定殖率为100%,30~40 cm土层菌丝定殖率随种群密度增大而增加,种群密度最大样地显著高于种群密度最小样地(P<0.05);10~ 20 cm土层玉竹根系菌丝定殖率种群密度大样地显著高于种群密度小样地(P<0.05)。
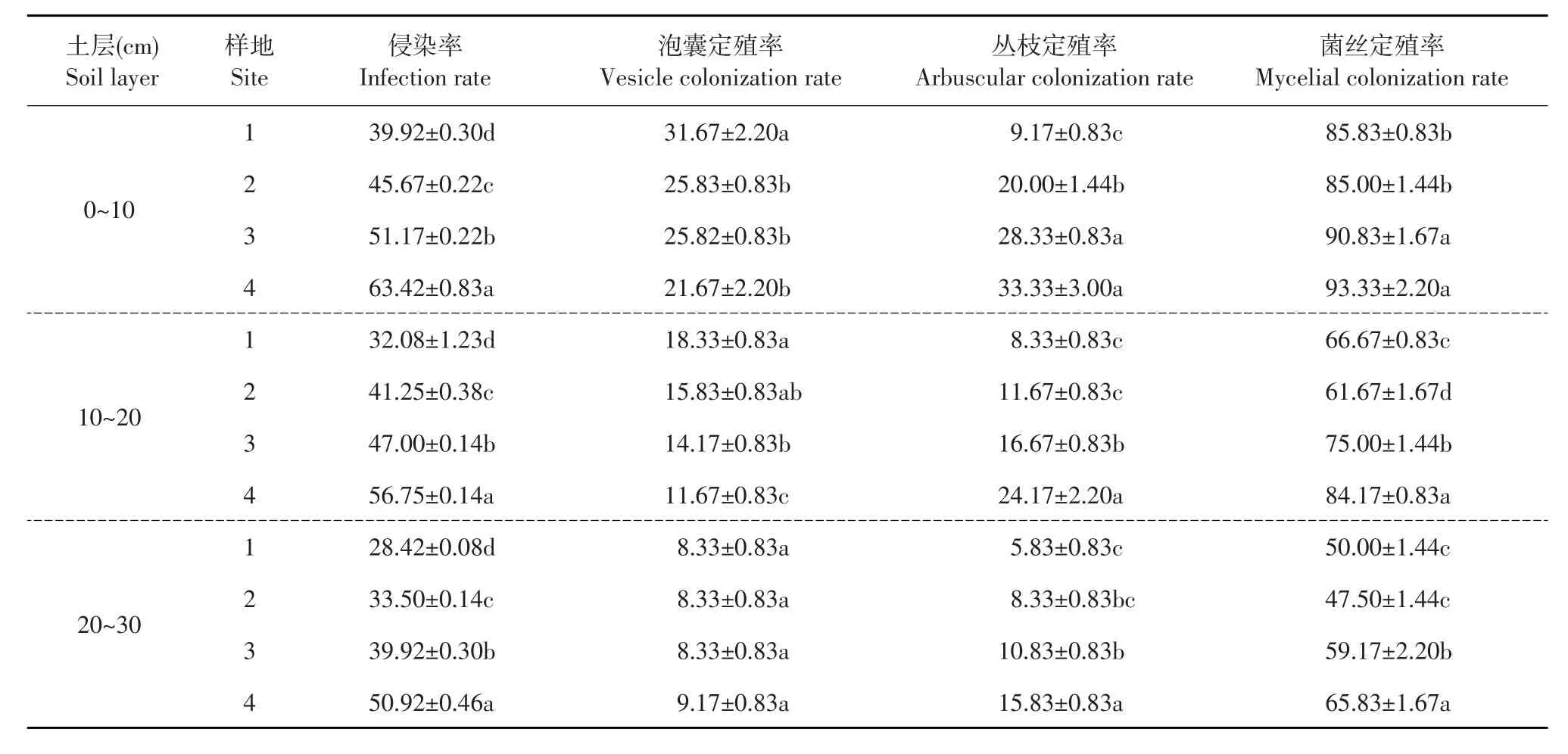
表2 AM真菌对玉竹菌根侵染率和定殖率影响Table 2 Effects of the infection rate and colonization rate of AM fungi on the rhizosphere of Polygonatum odoratum (%)
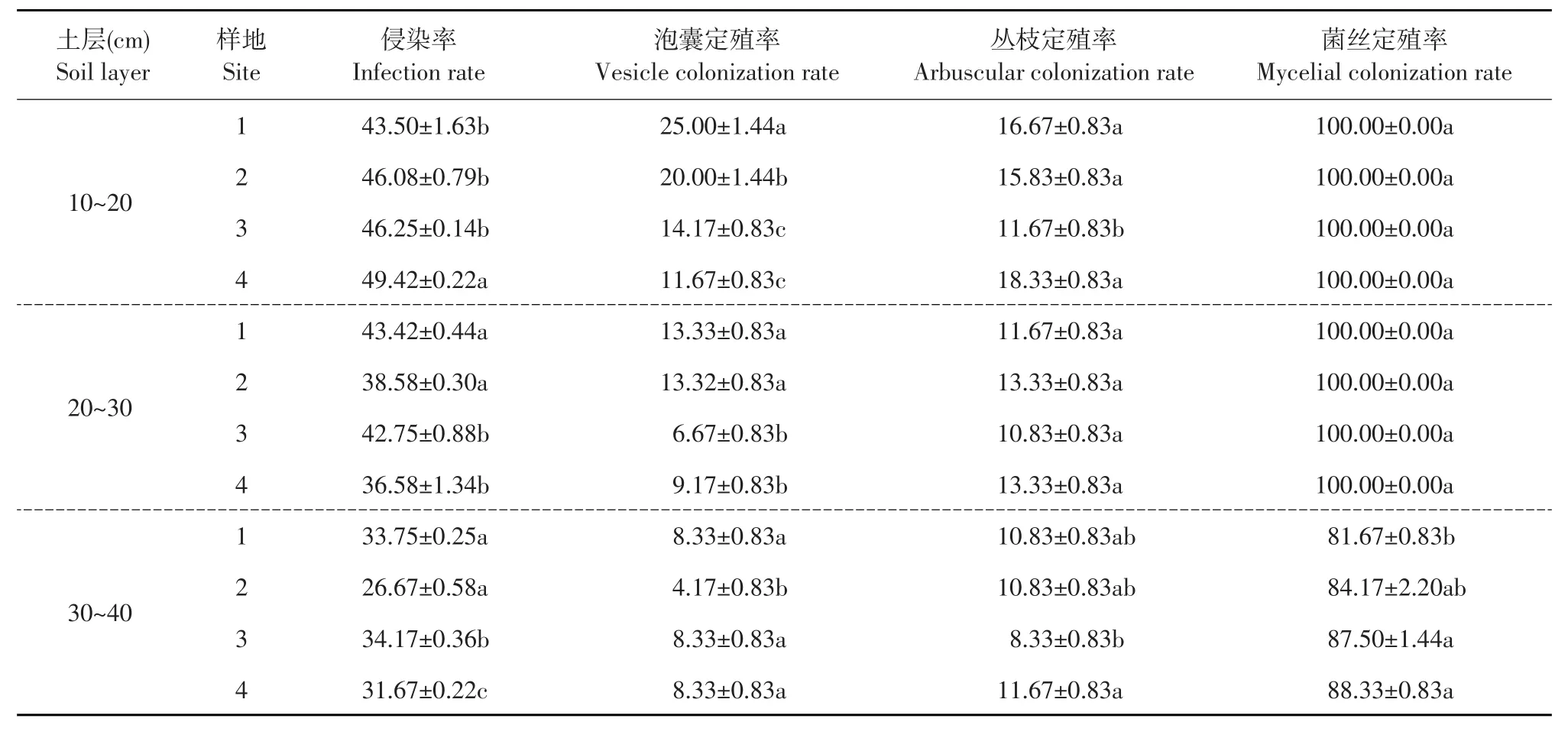
表3 AM真菌对崂山百合菌根侵染率和定殖率影响Table 3 Effects of the infection rate and colonization rate of AM fungi on the rhizosphere of Lilium tsingtauense(%)
2.2崂山百合、群落优势种根围AM真菌种类及孢子密度
崂山百合根围分离出4属14种AM真菌,其中球囊霉属8种,即幼套球囊霉(Glomus etunica⁃tum)、摩西球囊霉(Glomus mosseae)、地表球囊霉(Glomus versiforme)、黑球囊霉(Glomus malanospo⁃ rum)、地球囊霉(Glomus geosporum)、根内球囊霉(Glomus intraradices)、聚丛球囊霉(Glomus aggrega⁃tum)、疣突球囊酶(Glomus verruculosum);无梗囊霉属(Acaulospora)3种,即松蜜无梗囊霉(Acaulos⁃pora thomii)、光壁无梗囊霉(Acaulospora laevis)、蜜色无梗囊霉(Acaulospora mellea);巨孢囊霉属(Gigaspora)1种,即微白巨孢囊霉(Gigaspora albi⁃da);盾巨孢囊霉属(Scutellospora)2种,即美丽盾巨孢囊霉(Scutellospora calospora)、吉尔莫盾巨孢囊霉(Scutellospora gilmorei)。
玉竹根围分离出3属11种AM真菌,其中球囊霉属5种,即摩西球囊霉、网状球囊霉(Glomus reticulatum)、长孢球囊霉(Glomus dolichosporum)、幼套球囊霉(Glomus etunicatum)、双球型囊霉;无梗囊霉属(Acaulospora)4种,即双网无梗囊霉(Acaulospora bireticulata)、光壁无梗囊霉、蜜色无梗囊霉(Acaulospora mellea)、波状无梗囊霉(Acau⁃ lospora undulata);巨孢囊霉属2种,即微白巨孢囊霉、极大巨孢囊霉(Gigaspora gigantean)。
种群密度大小对崂山百合和玉竹根围孢子密度有显著影响(P<0.05)。崂山百合在10~20 cm土层、玉竹在0~10 cm土层孢子密度随种群密度增大而显著提高(P<0.05)。种群密度最大样地崂山百合在10~20 cm土层孢子密度最高,为229个·100 g-1土(见图1)。
2.3崂山百合根围球囊霉素相关土壤蛋白和土壤因子空间分布
结果见表4。
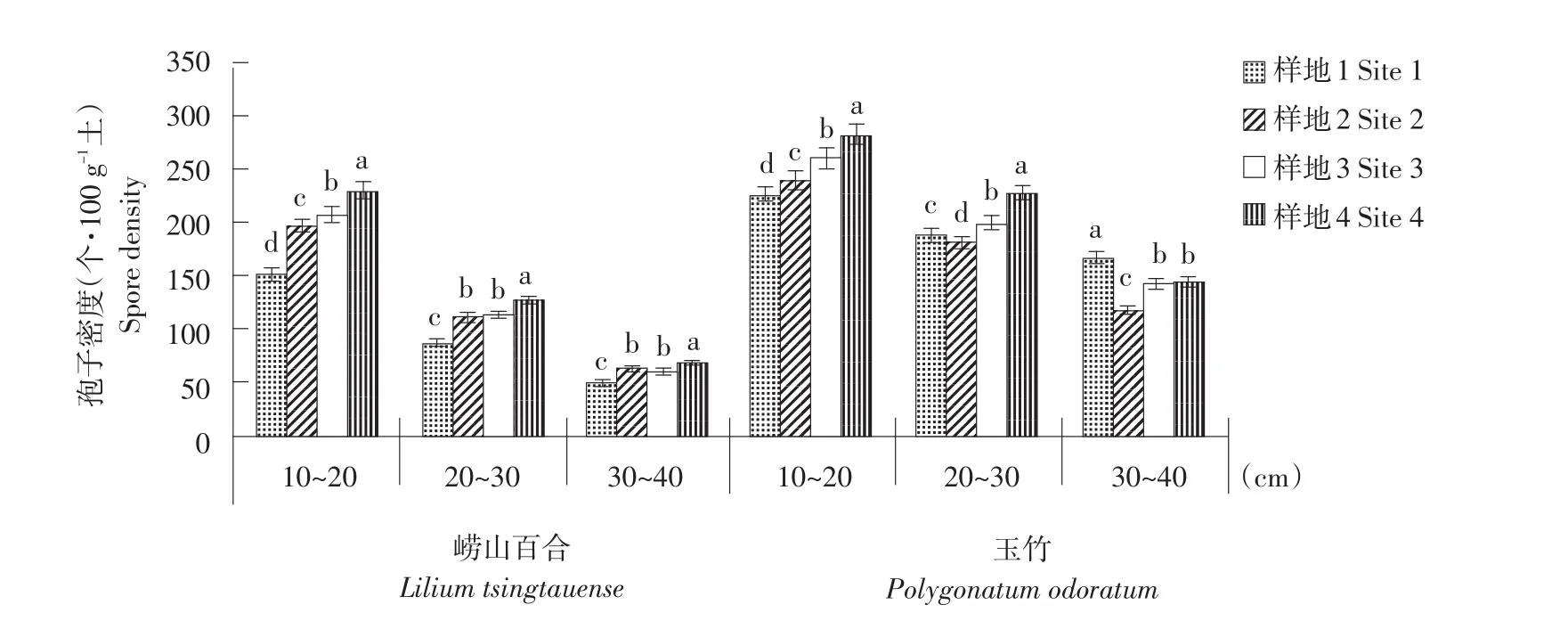
图1崂山百合和玉竹植物根围AM真菌孢子密度Fig. 1 Spore density of arbuscular mycorrhizal fungi in the rhizosphere of Lilium tsingtauense and Polygonatum odoratum
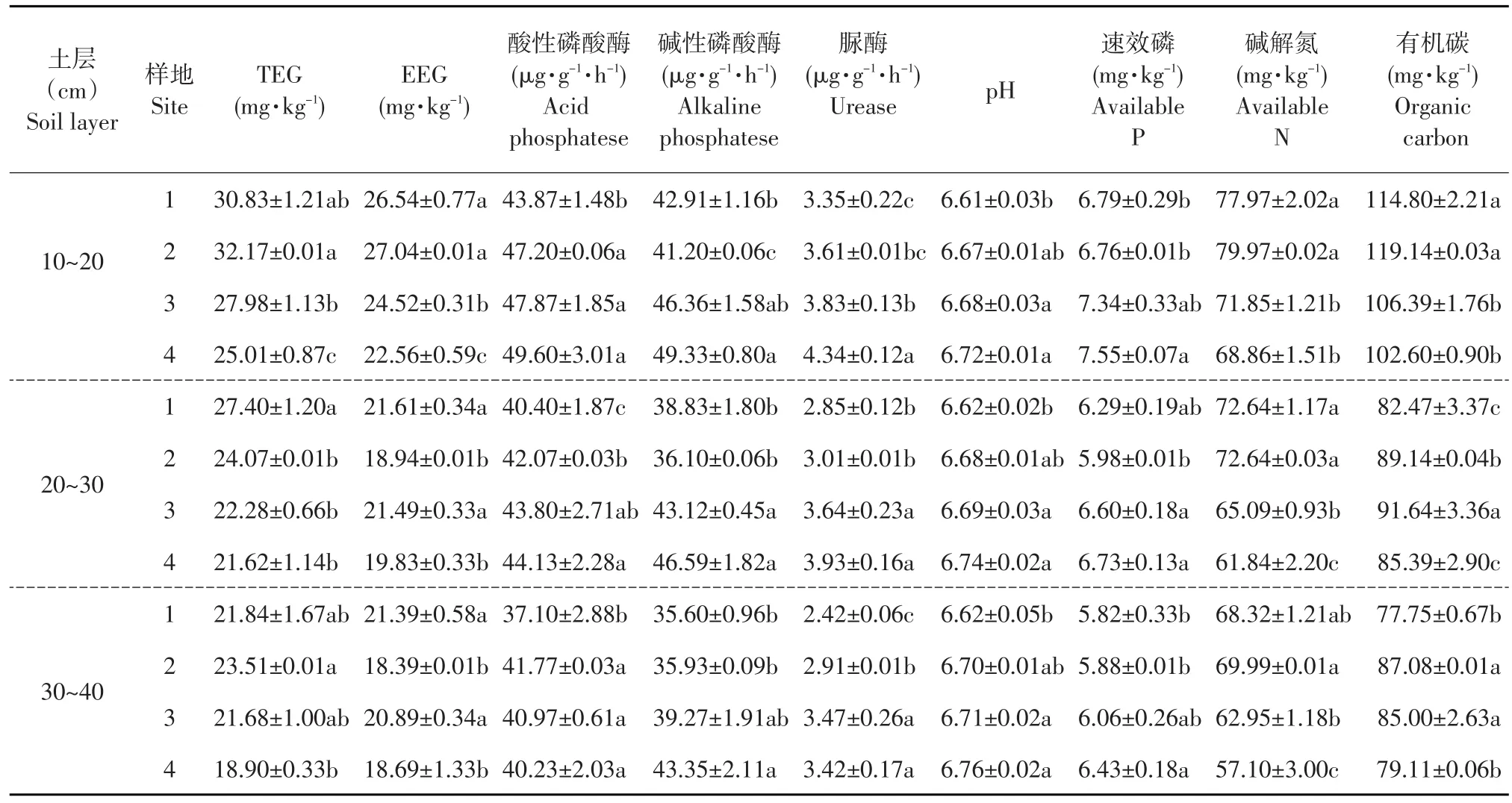
表4崂山百合根围土壤因子和球囊霉素相关土壤蛋白空间分布Table 4 Spatial distribution of soil factors and glomalin in the rhizosphere of Lilium tsingtauense
由表4可知,崂山百合根围10~20 cm和20~30 cm土层TEG含量随种群密度增大而降低,其中10~20 cm土层TEG含量最高,随种群密度增大,分别为30.83、32.17、27.98和25.01 mg·kg-1。酸性磷酸酶和脲酶含量在10~20 cm和20~30 cm土层随种群密度增大而提高,10~20 cm土层酸性磷酸酶含量最高,种群密度最大样地酸性磷酸酶含量比种群密度最小样地高5.73 mg·kg-1。速效磷和碱性磷酸酶在30~40 cm土层随种群密度增大而提高,其中10~20 cm土层种群密度最大样地速效磷和碱性磷酸酶含量最高,分别为7.55和49.60 mg·kg-1。崂山百合根围pH随种群密度增大而提高,种群密度最大样地30~40 cm土层pH最高,为6.76;种群密度最小样地10~20 cm土层pH最小,为6.61。
2.4环境因子对崂山百合根围AM真菌群落组成影响与相关性
选取的9个环境因子对崂山百合AM真菌群落组成均有一定程度影响(见图2)。
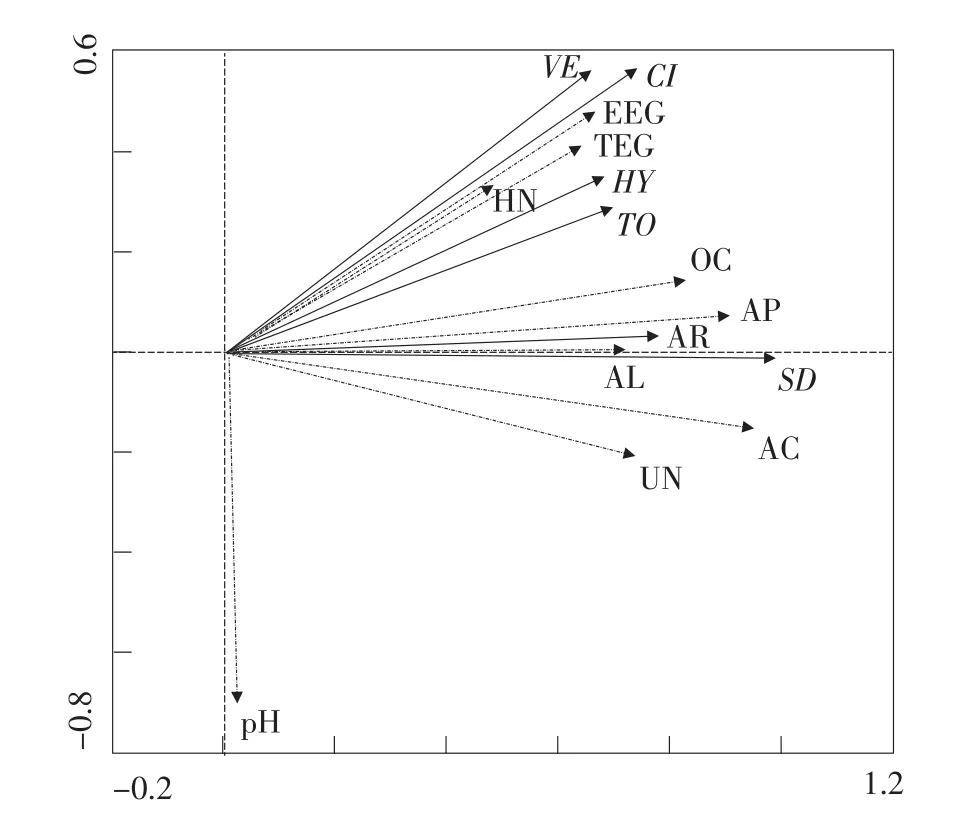
SD-孢子密度, UN-脲酶;AC-酸性磷酸酶;AL-碱性磷酸酶;OC-有机碳;AP-速效磷;HN-碱解氮;TO-总定殖率;CI-侵染率;HY-菌丝定殖率;VE-泡囊定殖率;AR-丛枝定殖率;TEG-总球囊霉素;EEG-易提取球囊霉素SD-Spore density; UN-Urease; AC-Acid phosphatese; AL-Alkaline phosphatese; OC-Organic carbon; AP-Available P; HN-Alkali hydrolysable nitrogen; TO-Total colonization rate; CI-Infection intensity; HY-Hypha colonization rate; VE-Vesicle colonization rate; AR-Arbuscular colonization rate; TEG-Total extractable glomain; EEG -Easy extractable glomain图2环境因子与AM真菌群落组成的RDA二维排序Fig. 2 RDA ordination diagram of the analysis of environmental factors and community composition of AM fungi
由图2可知,其中土壤酸性磷酸酶含量影响最大,碱性磷酸酶影响较小。AM真菌孢子密度与环境因子呈正相关(P<0.05),其中与速效磷、酸性磷酸酶呈极显著正相关(P<0.01),相关系数分别为0.905、0.953。AM真菌侵染率、泡囊定殖率、丛枝定殖率、菌丝定殖率与环境因子(除pH外)呈正相关(P<0.05)。AM真菌侵染率、泡囊定殖率、丛枝定殖率、总定殖率与有机碳、碱解氮、EEG、TEG呈正相关(P<0.05)。TEG、EEG与pH呈负相关,与其他环境因子呈正相关;其中TEG与碱解氮呈极显著正相关(P<0.01),相关系数为0.932。
3讨论与结论
AM真菌广泛存在于各生态系统中,但因生态因子(海拔、气候因子、土壤因子和寄主植物)不同造成AM真菌多样性差异。AM真菌孢子密度和定殖程度受样地气候条件、土壤微环境、寄主植物生长和AM真菌生物学特性等多种机制综合影响,表现出明显时空异质性[13]。种群密度越大群落组成越丰富。反之越贫乏。本研究从崂山百合、玉竹根围共分离出4属14种、3属11种,种类比较丰富,与该区域人为因素影响较小、气候适宜、植被丰富有关[13]。
土壤球囊霉素相关土壤蛋白来源于AM真菌,降解周期较长,环境因子会影响其积累和组成。短期内,土壤球囊霉素相关土壤蛋白含量变化也对生态扰动产生响应,受到大气CO2浓度、土壤温度、耕作方式等影响。土壤球囊霉素相关土壤蛋白是土壤有机氮、碳主要来源,其黏附力有利于土壤结构稳定,是AM真菌对植物生长环境的适应与调整[14]。崂山百合土壤球囊霉素相关土壤蛋白含量随土层深度增加而减少,TEG含量21.36~ 32.42 mg·kg-1,占有机碳比例为27.0%~27.3%;EEG含量16.24~27.30 mg·kg-1,占有机碳比例为20.5%~22.7%。
大量研究表明,AM真菌侵染和分布可能更多依赖环境而非共生植物[15]。土壤酶在土壤物质循环和能量转化过程中起重要作用,其活性反映土壤营养循环过程速率,是反映土壤生产力和土壤微生物活性指标。相关性分析表明,AM真菌定殖率、孢子密度与土壤养分及土壤酶活性有密切联系[16-17],AM真菌孢子密度、丛枝定殖率与脲酶活性呈显著正相关(P<0.05),土壤酸性磷酸酶活性与AM真菌孢子密度呈显著正相关(P<0.05);但也有研究显示,接种AM真菌降低酸性磷酸酶活性(P> 0.05)[18]。本研究表明,崂山百合根围AM真菌孢子密度、泡囊定殖率、丛枝定殖率与土壤酸性磷酸酶、碱性磷酸酶、脲酶呈正相关;种群密度对崂山百合根围AM真菌孢子密度有显著影响;10~ 20 cm土层崂山百合根系AM真菌侵染率随种群密度增大而增加;10~20 cm、20~30 cm土层酸性磷酸酶和脲酶含量随种群密度增大而提高。
AM真菌泡囊定殖率与土壤速效磷呈正相关,一定范围内磷含量会促进菌根真菌生长发育,超过一定磷水平,则开始抑制生长。中国北方碱性土壤磷普遍缺乏,AM真菌能促进植物对磷吸收。因为AM真菌侵染植物后,与植物幼根形成吸收共同体,促进植物对磷吸收。AM真菌可刺激菌丝际磷细菌和真菌繁殖,溶解更多磷为植物利用[19]。因此,AM真菌增强植物根系对磷吸收,促进植物生长发育,AM真菌侵染[19]。本研究发现崂山百合根围AM真菌泡囊定殖率与速效磷呈正相关;10~ 20 cm、20~30 cm土层崂山百合根泡囊定殖率随种群密度增大而降低。
AM真菌最高定殖率常伴随有较高孢子密度[20],而Siguenzal等研究却发现,当AM真菌孢子密度较高时,定殖率较低[21],二者之间不存在相关性。本试验表明,崂山百合AM真菌最高定殖率并不伴随最大孢子密度,说明AM真菌定殖率与孢子密度间无严格对应关系,这可能与植物生长、产孢特性以及土壤营养物质有效性等有关[20-21];另外植物根系常交错生长,寄主植物根围孢子也可能来自其他植物,导致AM真菌孢子密度与定殖状况不一致。
一定范围内有机碳提高,对AM真菌菌根发育和菌丝生长均有促进作用。本试验土壤有机碳主要提高AM真菌泡囊和菌丝定殖率;AM真菌与植物共生,能吸收铵态氮、硝态氮、一些氨基酸和复杂有机氮素,吸收的氮素在根外菌丝中转化为精氨酸运输到根内菌丝,进一步转化为NH4+后参与植物氮素代谢[22]。AM真菌与植物共生后对侧根侵染会影响寄主根系代谢活动,促使丛枝菌根分泌磷酸酶,或通过根外菌丝分泌磷酸酶,加速有机磷矿化过程,样地低磷刺激能诱导并促使磷酸酶活性增加,磷酸酶活性提高进而改变土壤磷素状况,增强植物对磷吸收[23]。因而,土壤因子影响AM真菌对寄主根系侵染和定殖,AM真菌与植物共生改善土壤有效成分和土壤肥力,提高植物对营养物质吸收利用,增强抗逆性。本研究表明,崂山百合根围AM真菌侵染率、定殖率与有机碳呈正相关。
崂山百合能与AM真菌形成良好共生关系,AM真菌孢子密度和定殖率随种群密度而变化,表现一定相关性;环境因子直接影响AM真菌定殖程度和丰富度;崂山百合根围土壤球囊霉素相关土壤蛋白含量较高,是土壤有机碳重要来源和组成部分。研究珍稀濒危植物与AM真菌共生关系,筛选适合土壤-植物-菌根最佳组合优势菌种,可为充分利用土壤AM真菌资源,促进珍稀濒危植被恢复和生态重建提供依据。
[参考文献]
[ 1 ]王发园,刘润进.黄河三角洲盐碱土壤中AM真菌的初步调查[J].生物多样性, 2001, 9(4): 389-392.
[ 2 ]刘润进,李晓林.丛枝菌根及其应用[M].北京:科学出版社, 2000.
[ 3 ] Driver D, Holben W E, Rillig M C. Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi[J]. Soil Biology and Biochemistry, 2005, 37(1): 101-106.
[ 4 ] Rillig M C, Wright S F, Eviner V T. Therole of arbuscular mycor⁃rhizal fungi and glomalin in soil aggregation: comparing effects of five plant species[J]. Plant and Soil, 2002, 238(2): 325-333.
[ 5 ]刘润进,陈应龙.菌根学[M].北京:科学出版社, 2007: 376-388.
[ 6 ] Phillips J M, Hayman D S. Improved procedures for clearing groots and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55: 158-161.
[ 7 ] Ianson D C, Allen M F. The effects of soil texture on extraction of vesicular arbuscular mycorrhizal spores from arid soils[J]. Mycolo⁃gia, 1986, 78(2): 164-168.
[ 8 ]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社, 1999: 325-336.
[ 9 ] Wright S F, Upadhyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorhizal fungi[J]. Plant and Soil, 1998, 198(1): 97-107.
[10] Janos D P, Garamszegi S, Beltran B. Glomalin extraction and mea⁃surement[J]. Soil Biochemistry, 2008, 40(3): 728-739.
[11]宋勇春,冯固,李晓林.泡囊丛枝菌根对红三叶草根际土壤磷酸酶活性的影响[J].应用与环境生物学报, 2000, 6(2): 171-175. [12]周礼恺.土壤酶学[M].北京:科学出版社, 1987: 267-286.
[13]王发园,刘润进,林先贵,等.几种生态环境中AM真菌多样性比较研究[J].生态学报, 2003, 23(12): 2666-2667.
[14] Rillig M C, Hernandez G Y, Newton P C D. Arbuscular mycorrhi⁃zae respond to elevated atmospheric CO2after long-term expo⁃sure: Evidence from a CO2spring in New Zealand supports the re⁃source balance model[J]. Ecology Letters, 2000, 3(6): 475-478
[15]鲍士旦.土壤农化分析[M].北京:中国农业出版社, 2003: 203-287.
[16] Shan B Q, He X L, Bai C M. Distribution of arbuscular mycorrhi⁃zal fungi and soil enzyme activites in the rhizosphere of artemisia ordosicain desert[J]. Acta Ecologica Sinica, 2009, 29(6): 3044-3051.
[17] He X L, Yang L, Tang H L, etal. Effect on arbuscular mycorrhizal fungi of cloned Phragmites communis[J]. Progress in Natural Sci⁃ ence, 2007, 17(7): 978-986.
[18]白春明,贺学礼,山宝琴.漠境沙打旺根围AM真菌与土壤酶活性的关系[J].西北农林科技大学学报:自然科学版, 2009, 39 (1): 84-90.
[19]曹栋贤,赵金莉.药用植物白芷根际AM真菌与土壤因子调查[J].华北农学报, 2007, 22(增): 47-50.
[20] Fontrnla S, Godoy R, Rosso P, Havrylenko M. Root associations in Austrocedrus forests and seasonal dynamics of arbuscular my⁃corrhias[J]. Mycorrhiza, 1998, 8(1): 29-33.
[21] Siguenzal C, Espejel I, Allen E B. Seasonality of mycorrhizae in coastal sand dunes of Baja California[J]. Mycorrhiza, 1996, 6(2): 151-157.
[22]李侠,张俊伶.丛枝菌根真菌对氮素的吸收作用和机制[J].山西大同大学学报:自然科学版, 2008, 24(6): 75-78.
[23] Bai C M, He X L, Tang H L, Shan B Q, Zhao L L. Spatial distribu⁃tion of arbuscular mycorrhizal fungi, glomalin and soil enzymes under the canopy of Astragalus adsurgens Pall, in the Mu Us sand⁃land, China[J]. Soil Biology and Biochemistry, 2009, 41: 941-947.
Distribution characteristic of arbuscular mycorrhizal fungi in the rhizosphere of endangered Liliumtsingtauense plants
LI Wei1, SUN Longyan1,2, ZHANG Cuiping1, XU Meng1, GUO Shaoxiao1,2(1. School of Landscape and Forestry, Qingdao Agricultural University, Qingdao Shandong 266109, China; 2. Institute of Mycorrhizal Biotechnology, Qingdao Agricultural University, Qingdao Shandong 266109, China)
Abstract:To estimate the spatial distribution of arbuscular mycorrhiza (AM) fungi in the rhizosphere of L. tsingtauense with the process of reducing population density, we collected soil samples from the rhizosphere of L. tsingtauense and the dominant species (Polygonatum odoratum) of plants community in Laoshan in October 2014 to isolated and identify AM fungal spores, to determine their population density, and soil factors. The results showed that there were 14 species in four genera, and 11 species in three genera of AM fungi identified in the rhizosphere of L. tsingtauense, and P. odoratum, respectively. The root colonization rate increased with the increasing of the population density of L. tsingtauense in 10-20 cm soilbook=1,ebook=36layer. The root colonization percentage of large population density sample of P. odoratum was significantly higher than small sample population density. The population density had no significant effect on arbuscular colonization on L. tsingtauense root, but the vesicle colonization decreased with the increasing of population density in 10-20 and 20-30 cm soil layer and P. odoratum in 0-10 and 10-20 cm soil layer. The hypha colonization percentage of L. tsingtauense increased along with the increasing of population density in 30-40 cm soil layer and P. odoratumin 10-20 cm soil layer. The population density had a significant effect on spore density in the rhizosphere of the tested plants. The contents of total extractable glomalin in the rhizosphere of L. tsingtauense decreased as the L. tsingtauense population density increased. Acid phosphatase and urease increased with the increasing of L. tsingtauensepopulation density in 10-20 and 20-30 cm soil layer.
Key words:AM fungi; Liliumtsingtauense; endangered plant; soil factor; spatial distribution
*通讯作者:郭绍霞,教授,博士,研究方向为菌根生理生态和观赏园艺。E-mail: gsx2309@126.com
作者简介:李伟(1983-),男,讲师,博士,研究方向为园林植物遗传资源与育种。E-mail: zcpliwei@163.com
基金项目:青岛市科技计划基础研究项目[12-1-4-5-(4)-jch]
收稿日期:2015-09-20
中图分类号:S682.2+9
文献标志码:A
文章编号:1005-9369(2016)01-0030-08

