内含肽融合标签介导的人乙醛脱氢酶2基因原核表达
刘向宇,尹杰超,李景鹏(东北农业大学生命科学学院,哈尔滨 150030)
内含肽融合标签介导的人乙醛脱氢酶2基因原核表达
刘向宇,尹杰超,李景鹏*
(东北农业大学生命科学学院,哈尔滨150030)
摘要:为获得高活性重组人乙醛脱氢酶2(ALDH2)重组蛋白,研究通过PCR获得ALDH2基因,先后构建克隆和表达载体pGEM-ALDH2和pTYB11-ALDH2。转化的阳性重组菌经IPTG诱导,SDS-PAGE显示融合蛋白获得大量表达。通过正交试验对表达条件优化设计,结果表明,诱导OD值0.3,30℃,IPTG浓度1.0 mmol·L-1,诱导表达4 h为最优表达条件。由于融合蛋白以包涵体形式存在,经变性、复性,使用IMPACTTM-CN蛋白纯化系统,经内含肽标签蛋白自裂解洗脱、纯化,获得仅含有几个载体氨基酸的ALDH2蛋白,蛋白浓度为0.045 mg·mL-1。纯化的ALDH2蛋白比活力为462 U·mg-1。
关键词:人乙醛脱氢酶2;内含肽;重组表达;包涵体;IMPACTTM-CN蛋白纯化系统
刘向宇,尹杰超,李景鹏.内含肽融合标签介导的人乙醛脱氢酶2基因原核表达[J].东北农业大学学报, 2016, 47(1): 38-44.
Liu Xiangyu, Yin Jiechao, Li Jingpeng. Expression of recombinant human aldehyde dehydrogenase 2 by using intein induced expression system[J]. Journal of Northeast Agricultural University, 2016, 47(1): 38-44. (in Chinese with English abstract)
乙醛脱氢酶(Aldehyde dehydrogenase, ALDH)是人体内乙醇脱氢酶系重要组成部分,和乙醇脱氢酶(Alcohol dehydrogenase,ADH)一起,共同催化乙醇在人体内分解代谢[1]。乙醛脱氢酶2(AL⁃DH2)将乙醛转化为乙酸,最终分解为二氧化碳和水,是目前已知的代谢乙醛催化效率最高的限速酶[2]。ALDH2基因具有高度遗传多态性,中国和其他亚洲国家中,35%~40%个体缺乏ALDH2,更易发生酒精中毒[3]。高活性外源乙醛脱氢酶的补充可弥补内源性乙醛脱氢酶不足,商品化ALDH2主要从动物肝脏和胰腺中分离、提取,价格较高,难以大规模生产[4]。获得高活力的ALDH2成为研究热点。通过将ALDH2基因融合到pET32a中,黄娟等在大肠杆菌中表达重组ALDH2蛋白,呈包涵体形式表达[5];Gross等通过构建pT7-7-ALDH2等多种重组表达载体,五种ALDH基因在大肠杆菌BL21宿主菌中获得高效表达,发现重组ALDH2蛋白对乙醛催化活性最高[6]。Yao等通过大肠杆菌表达酵母源ALDH重组蛋白,比天然分离蛋白酶活性高4倍[7]。黄锟等研究发现,毕赤酵母胞内表达重组ALDH2蛋白酶活比毕赤酵母分泌表达重组蛋白高近3倍[8-9]。李青松等采用昆虫细胞表达系统sf9高效表达人ALDH2及其突变基因型重组蛋白,发现二者对乙醛催化活性差异显著[10]。但限于如蛋白表达过程容易降解、蛋白表达浓度低、重组蛋白较难纯化、融合蛋白标签较大或重组蛋白酶活性较低等因素,ALDH2重组蛋白获得需新技术支持。
本研究将ALDH2基因融合到N-末端含有内含肽和几丁质结合域的双功能标签处,用表达载体pTYB11在原核表达宿主E.coli ER2566中表达AL⁃DH2蛋白,优化表达条件,以期得到活性AL⁃DH2,为ALDH2应用和基础研究奠定物质基础。
1 材料与方法
1.1材料
1.1.1菌种与质粒
大肠杆菌E.coil JM109由东北农业大学生物制药实验室保存。E.coil ER2566和表达载体pTYB11购自NEB公司。克隆载体pGEM-T购自Promega公司。
1.1.2主要试剂
M-MLV逆转录酶购自Promega公司;Trizol购自MIC公司;LA Taq DNA聚合酶,Eco RⅠ、XhoⅠ、T4DNA连接酶、IPTG、DEPC购自TaKaRa公司;过硫酸铵、DTT、丙烯酰胺、甲叉双丙烯酰胺、TEMED购自Amersham Pharmacia Biotech公司。IMPACTTM-CN蛋白纯化系统购自NEB公司。Bradford法蛋白质浓度测定试剂盒购自碧云天生物技术有限公司。β-烟酰胺腺嘌呤二核苷酸(β-NAD)购自Gibco公司。
1.2方法
1.2.1人乙醛脱氢酶基因克隆
根据GenBank数据库人ALDH2基因序列(No. JF432260),运用Primer 5.0软件设计一对扩增引物,上游引物P1(25 bp):5' GAATTCTCAGCCGC CGCCACCCAGG 3'(下划线处为Eco RⅠ识别位点);下游引物P2(27 bp):5' CTCGAGTTATGAG TTCTTCTGAGGCAC 3'(下划线处为XhoⅠ识别位点),由上海生工生物工程技术服务有限公司合成。Trizol试剂抽提流产胎儿肝组织总RNA,以Oligo dT(18)为引物,反转录合成cDNA。利用ALDH2基因特异引物PCR扩增,反应条件为:94℃预变性5 min,94℃1 min,63℃1 min,72℃2 min,35个循环后,72℃再延伸10 min。PCR产物经0.8%琼脂糖凝胶电泳,观察扩增片段长度。
1.2.2原核表达载体构建与鉴定
DNA纯化试剂盒回收PCR产物,再将其克隆至pGEM-T载体,构建克隆载体pGEM-ALDH2,转化入E. coli JM109感受态细胞,经酶切鉴定阳性重组后,由上海英骏(Invitrogen)生物技术有限公司测序。自重组克隆载体pGEM-ALDH2用Eco RⅠ和XhoⅠ切下ALDH2序列片段,电泳回收目的片段并连接至经相应酶处理的原核表达载体pTYB11,构建重组表达载体pTYB11-ALDH2,转化入E. coli ER2566感受态细胞。重组质粒作酶切鉴定及DNA测序验证。
1.2.3融合蛋白诱导表达
挑取阳性重组菌ER2566-pTYB11-ALDH2单菌落接种含100 μg·mL-1氨苄青霉素的LB培养基,37℃振荡培养过夜,次日以1∶100扩配,37℃继续培养至培养液OD600达0.3,加入IPTG至终浓度为1.0 mmol·L-1,30℃诱导培养4 h,收集菌体,重悬于PBS(pH 7.4),以煮沸裂解法破裂菌体作
SDS-PAGE分析,鉴定表达产物。
1.2.4融合蛋白最佳表达条件确立
采用正交方式对重组ALDH2诱导表达条件优化。参考文献[11]方法,选择4因素3水平,进行正交试验(见表1)。
根据表1,设计9组试验,诱导表达后,收集菌体,煮沸法裂解细菌,菌体蛋白作SDS-PAGE分析。利用Sage Creation影像分析系统对电泳凝胶结果分析,获得目的蛋白占全菌蛋白百分含量,确定最佳诱导表达条件。
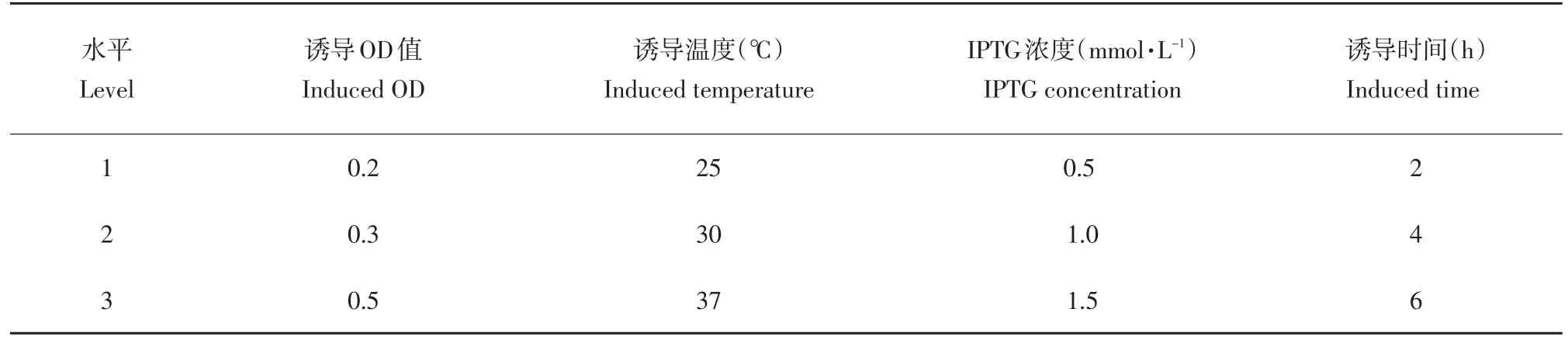
表1因素水平设计Table 1 Design of the levels and factors
1.2.5 Western Blot分析
将pTYB11空载体诱导蛋白和重组ALDH2融合蛋白按常规方法进行SDS-PAGE,转膜,5%脱脂乳的封闭液37℃封闭2 h,弃去封闭液,PBST洗涤3次,每次10 min。一抗使用Anti-Chitin抗体(兔源),4℃孵育过夜,用无磷酸盐缓冲液洗涤3次,每次10 min。二抗为HRP标记的羊抗兔IgG,37℃孵育1 h。弃去二抗,无磷酸盐缓冲液洗涤3次,每次10 min。加入显色底物,暗室曝光,观察目的条带。
1.2.6融合蛋白纯化及定量
1.2.6.1包涵体溶解
首先将分析以包涵体形式表达的目的蛋白进行包涵体提取和溶解。重组阳性菌按照最佳诱导表达条件诱导后,离心收集菌体。称菌体湿重,每克菌体加入3 mL细胞裂解缓冲液Ⅰ,重悬菌体,加入4 μL 100 mmol·L-1PMSF,加入溶菌酶至终浓度1 mg·mL-1,搅动20 min,加入4 mg脱氧胆酸,继续搅动20 min,加入20 μL 1 mg·mL-1DNase I,37℃放置30 min。细胞裂解液4℃12 000 r·min-1离心15 min。弃上清,将每份沉淀重悬在100 μL含0.1 mmol·L-1PMSF(现用现加)的包涵体溶解缓冲液Ⅰ中,于室温放置1 h。向悬液中加入9倍体积包涵体溶解缓冲液Ⅱ,KOH将pH维持在10.7,于室温放置30 min。HCl将pH调至8.0,室温下至少放置30 min。于室温以12 000 r·min-1离心15 min,将沉淀重悬于100 μL去离子水中。
1.2.6.2融合蛋白复性
按1∶10比例向包涵体溶解液中缓慢加入含2 mmol·L-1还原型谷胱甘肽和0.2 mmol·L-1氧化型谷胱甘肽复性缓冲液,室温孵育2 h;PBS(pH 8.0)4℃透析过夜。
1.2.6.3融合蛋白纯化
先将纯化柱用10个柱床体积的Column Buffer 4℃平衡过夜,然后将复性蛋白溶液缓慢加入已平衡的纯化柱中。融合蛋白纯化过程参照IM⁃PACTTM-CN蛋白纯化系统说明书。
1.2.6.4纯化融合蛋白浓缩
聚乙二醇(PEG)8000对纯化后融合蛋白浓缩,用于活性鉴定。
1.2.6.5纯化融合蛋白定量
按照Bradford法蛋白质浓度测定试剂盒说明书测定浓缩融合蛋白含量。
1.2.7重组酶活力检测
由于NADH、NAD+分别在340和260 nm处有最大吸收峰,对以NAD+为辅酶的各种脱氢酶类,均可通过测定光吸收值在340 nm处变化,定量测定反应酶活性。酶活体系:1 mol·L-1Tris- HCl buffer(pH 8. 0)20 μL,20 mmol·L-1β-烟酰胺腺嘌呤二核苷酸(β-NAD)20 μL,100 mmol·L-1乙醛13.3 μL,3 mol·L-1KCl 6.7 μL,1 mol·L-1β-巯基乙醇2 μL,酶液5 μL。加水133 μL调整终体积为200 μL。将每分钟内OD340发生0.001数量变化定义为一个活力单位(U)。
2结果与分析
2.1克隆载体和表达载体构建与鉴定
从人胎肝组织经RT-PCR扩增,获得约1 500 bp特异性基因片段,与预期目的基因片段相符(见图1A)。扩增产物经凝胶回收连接到pGEM-T载体,重组质粒pGEM-T-ALDH2经Eco RⅠ、XhoⅠ双酶切,琼脂糖凝胶电泳可见约1 500 bp特异性条带(见图1B)。经DNA序列分析,表明克隆载体构建成功。将阳性质粒pGEM-T-ALDH2双酶切后获得含有黏性末端的片段,凝胶回收后连接pTYB11载体。重组质粒pTYB11-ALDH2经酶切鉴定(见图1C)和测序分析,表明表达载体构建成功。
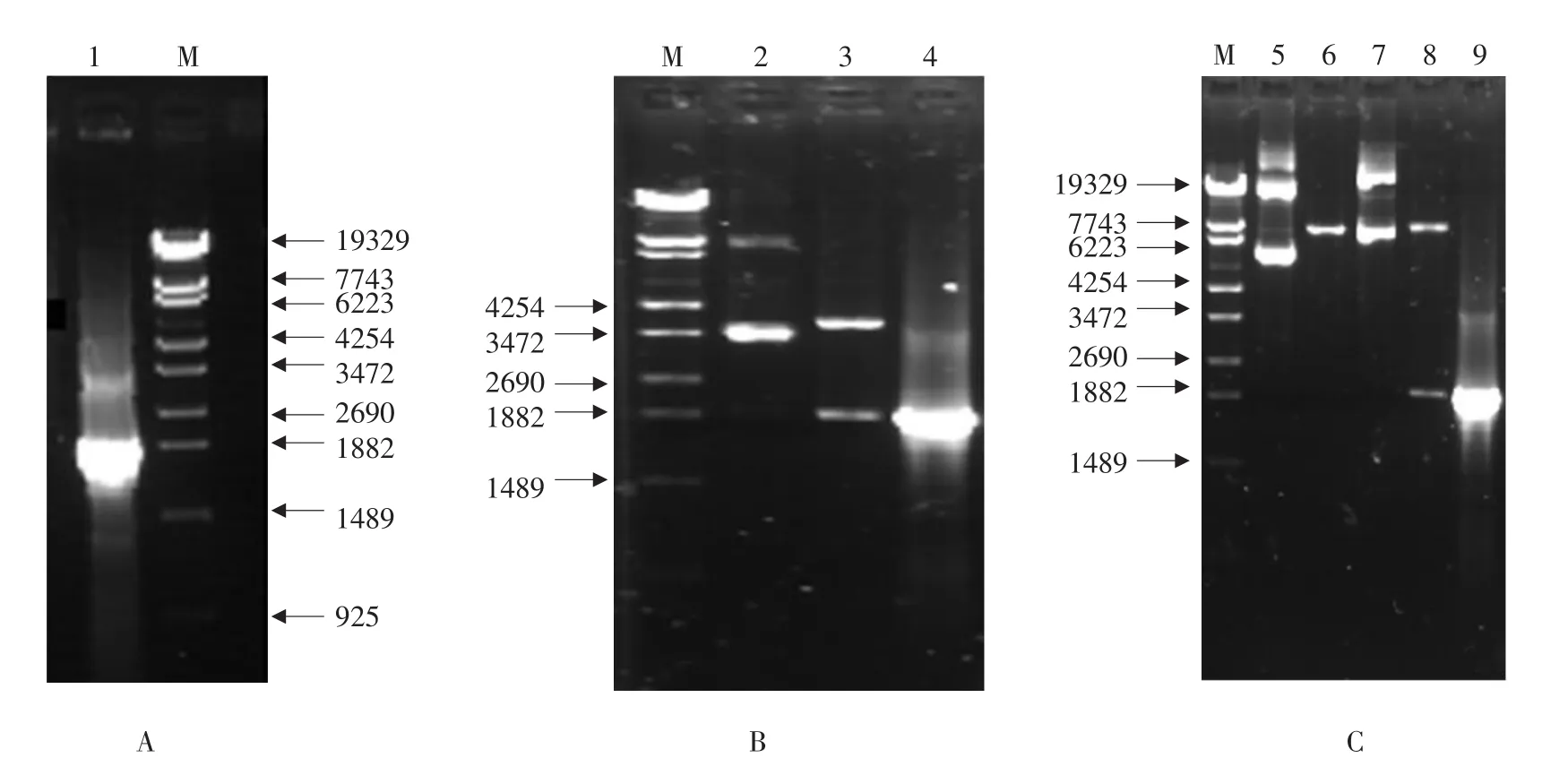
M-DNA分子质量标准;1-ALDH2基因PCR产物;2-重组质粒pGEM-T-ALDH2电泳条带;3-pGEM-T-ALDH2的Eco RⅠ和XhoⅠ双酶切产物;4-pGEM-T-ALDH2 PCR产物;5-pTYB11空载体质粒;6-pTYB11的Eco RⅠ和XhoⅠ双酶切产物;7-重组质粒pTYB11-ALDH2;8-pTYB11-ALDH2的Eco RⅠ和XhoⅠ双酶切产物;9-pTYB11-ALDH2 PCR产物M-DNA MW Standard Marker; 1-PCR product of ALDH2 gene; 2-The vector pGEM-T-ALDH2; 3-Product from pGEM-T-AL⁃DH2 digested by Eco RⅠand XhoⅠ; 4-PCR product of ALDH2 gene from the plasimads pGEM-T-ALDH2; 5-The vector pTYB11; 6-Product from pTYB11 digested by Eco RⅠand XhoⅠ; 7-The vector pTYB11-ALDH2; 8-Product from pTYB11-ALDH2 digested by Eco RⅠand XhoⅠ; 9-PCR product of ALDH2 gene from the plasimads pTYB11-ALDH2图1重组克隆载体pGEM-T-ALDH2和表达载体pTYB11-ALDH2构建和鉴定Fig. 1 Construction and identification of the recombinant plasmids pGEM-T-ALDH2 and pTYB11-ALDH2
2.2重组蛋白诱导表达和表达条件优化
将构建的阳性重组质粒导入大肠杆菌ER2566诱导表达,30℃诱导培养4 h后收集菌体,经SDS-PAGE分析,对照菌ER2566-pTYB11表达出55 ku标签蛋白,构建的重组菌ER2566-pTYB11-ALDH2表达约110 ku重组蛋白,与理论值相符,表明成功在大肠杆菌系统中表达Chitin-ALDH2融合蛋白(见图2A)。
通过正交试验(见表2),SDS-PAGE分析最佳菌体浓度、诱导时间、温度和IPTG浓度,4个影响因素中,影响目的蛋白在宿主细胞表达的主次因素为C>B>D>A,最优因素水平组合为A2B2C2D2,即诱导OD值0.3,诱导温度30℃,IPTG浓度1.0 mmol·L-1,诱导时间4 h。采用此组合进行验证试验,诱导表达目的蛋白浓度占总蛋白的19.16%。
2.3 Western Blot检测
利用Anti-Chitin抗体进行Western Blot检测,结果如图2B显示,对照菌表达分子质量为55 ku Chitin标签蛋白,阳性菌在250和98 ku间有一条明显的特异性显色反应带,分子质量约110 ku,两种蛋白比较发现,阳性菌表达分子质量约55 ku目的蛋白,与预期结果相符。
2.4目的蛋白纯化
几丁质(Chitin)纯化柱纯化,目的蛋白从Chi⁃tin-ALDH2融合蛋白中裂解出来,获得分子质量约为55 ku的重组ALDH2,与目的蛋白相符,如图2C所示。经Bradford法定量浓缩的纯化蛋白质量浓度为0.045 mg·mL-1。
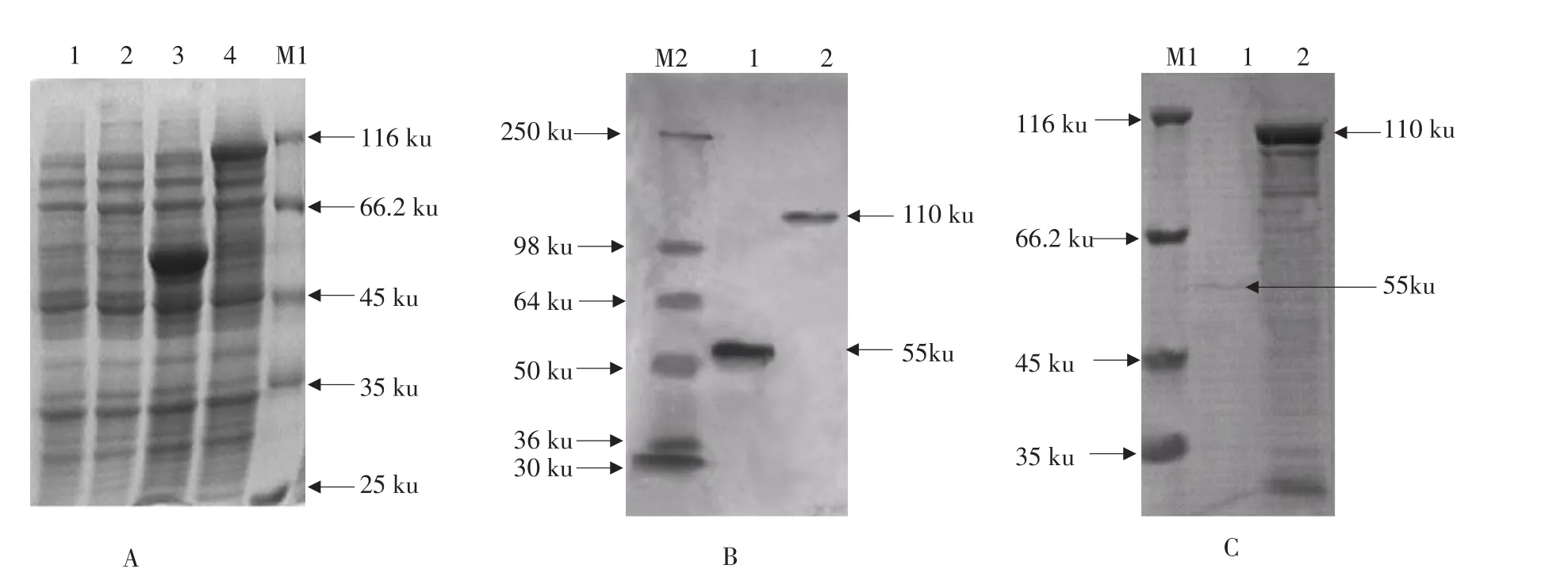
A-重组蛋白ALDH2表达。M1-蛋白质分子质量标准;1-对照菌ER2566-pTYB11诱导前;2-阳性重组菌ER2566-pTYB11-ALDH2诱导前;3-空载体诱导后菌体总蛋白;4-重组菌诱导后菌体总蛋白B-融合蛋白Western Blot鉴定。M2-蛋白质分子质量标准;1-Chitin标签蛋白;2-ALDH2融合蛋白C-融合蛋白纯化。M1-蛋白质分子质量标准;1-纯化的重组蛋白ALDH2;2-ER2566-pTYB11-ALDH2包涵体A-Expression of recombinant ALDH2. M1-Protein molecular weight marker; 1-Control bacteria non-induced; 2-Non-in⁃duced positive bacteria; 3-Protein from induced ER2566-pTYB11; 4-Protein from induced ER2566-pTYB11-ALDH2B-Western Blot analysis of fusion protein. M2-Protein molecular weight marker; 1-Protein chitin; 2-Recombinant fusion protein ALDH2C-Purification of fusion protein. M1-Protein molecular weight marker; 1-Purified protein ALDH2 after cleavage; 2-Inclusion body of the ER2566-pTYB11-ALDH2图2融合蛋白ALDH2表达、鉴定和纯化Fig. 2 Expression, identification and purification of fusion protein ALDH2

表2正交试验结果分析Table 2 Result analysis of orthogonal experiment
2.5重组酶活性检测
酶活测定体系中,反应总体积为0.2 mL,加入酶体积为5 μL,每分钟读取1次OD340,以OD340对反应时间作图(见图3)。计算获得反应初始阶段(前5 min)的OD340变化约为-0.013 min-1,取其绝对值,即ΔOD340=0.013 min-1。每毫升酶液活性为20.8 U,纯化ALDH2比活力为462 U·mg-1。
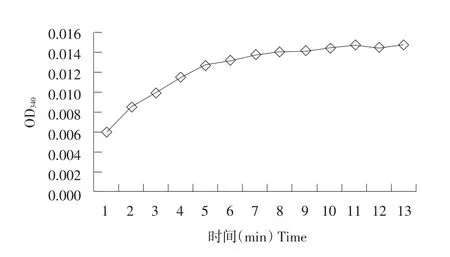
图3重组蛋白ALDH2酶活性吸光曲线Fig. 3 Activity-absorbency of recombinant protein ALDH2
3讨论与结论
人乙醛脱氢酶2是人体代谢乙醇的关键酶,催化乙醛与乙酸间转化反应,在细胞解毒和分子生物学及相关疾病检测方面也多有应用[12]。由于天然ALDH2来源限制,通过微生物发酵表达高活性、高纯度重组ALDH2蛋白引起关注。毕赤酵母表达系统具有蛋白翻译后修饰和易于上清表达特点,陈瑞等通过摇瓶发酵表达以毕赤酵母GS115为表达宿主菌,以质粒pPIC9K为载体重组ALDH2蛋白,发酵上清蛋白表达量为8.40 mg·L-1,比酶活为11.35 mU·mL-1[13]。黄锟等利用毕赤酵母分泌表达ALDH2时,由于酵母生长周期较长,得到目的蛋白活性最高仅达0.115 U·mL-1[8]。赵锦等通过毕赤酵母分泌表达ALDH2蛋白时,表达过程中蛋白降解并失活严重,只有低于28℃才有活性,因此胞内表达人ALDH2蛋白,酶活比分泌表达的重组蛋白高近3倍,为0.315 U·mL-1[9]。基于大肠杆菌表达系统、易操作性和价格低廉等因素,孙莉等通过融合SUMO蛋白标签在较低的诱导温度(16℃)下实现ALDH2可溶性表达,但未测定酶活性[14]。黄娟等通过构建重组表达载体pET32a- ALDH2,以包涵体形式表达目的蛋白,经包涵体变性、复性和纯化,获得77 μg·mL-1纯化蛋白,酶活性达到1.449 U·mL-1。但pET32a标签含有大肠杆菌TrxA基因编码的109个氨基酸的硫氧还蛋白,与ALDH2蛋白一起融合表达无法去除[5]。
因此,本研究在国内首次利用内含肽原核表达系统表达ALDH2蛋白,结合IMPACTTM-CN蛋白纯化系统,使ALDH2蛋白仅冗余简单的几个载体氨基酸,纯化后重组蛋白与天然蛋白一致,最大限度降低标签蛋白对目的蛋白活性影响。pTYB11载体构建通过诱导产生具有自我剪切活性的蛋白质元件内含肽,其C端有多克隆位点,使目的蛋白融合于内含肽之后;内含肽含有几丁质结合域(CBD),利用几丁质作为亲和层析介质,可方便分离融合蛋白。当有巯基存在时,内含肽自我剪切活性将融合蛋白与靶蛋白间的连接键切断,经洗脱,释放出目的蛋白[15]。成熟人ALDH2蛋白分子质量约55 ku,原核表达载体pTYB11-ALDH2诱导后表达的融合蛋白约110 ku,经内含肽自我剪切后的纯化蛋白约55 ku,与预测一致。因此,通过内含肽融合表达系统及自我剪切机制,本研究成功获得与天然ALDH2蛋白相似的重组蛋白。按照经典酶活性测定方法,获得20.8 U·mL-1高活性纯化蛋白。
大肠杆菌表达重组目的蛋白影响因素主要有培养基组成和培养条件,后者包括菌种种龄、接种量、诱导剂浓度、诱导时间、诱导时机和温度等。通过统计学方法可从众多因素中筛选出重要影响因素[16-17]。本文采用多因素交叉设计试验优化重组大肠杆菌诱导表达条件,筛选出诱导表达最优化组合,使重组蛋白表达浓度占总蛋白的19.16%,实现ALDH2融合蛋白高效表达。虽然优化多种表达条件,ALDH2融合蛋白表达仍以包涵体形式存在,采用变性和复性技术手段将导致蛋白得率下降和酶活性损失。因此,通过原核表达系统可溶性表达无冗余氨基酸的ALDH2蛋白是今后研究方向。
[参考文献]
[ 1 ] Yoshida A, Rzhetsky A, Hsu L C, et al. Human aldehyde dehydro⁃genase gene family[J]. Eur J Biochem, 1998, 251(3): 549-557.
[ 2 ] Black W, Vasiliou V. The aldehyde dehydrogenase gene super⁃family resource center[J]. Hum Genomics, 2009, 4(2): 136-142.
[ 3 ]王焱,陈银蓉,巩燕,等.急性心肌梗死患者血浆乙醛脱氢酶2活性水平的变化及意义[J].上海医学, 2010(5): 413-416.
[ 4 ] Itoga S, Nanmoku T, Uchimoto T, et al. Comparative analyses of four different methods of genotyping ALDH2[J]. Alcohol Clin Exp Res, 2004, 28(8S): 117-122.
[ 5 ]黄娟,王荷花,张小骥,等.人乙醛脱氢酶2的原核表达及其活性的鉴定[J].生物技术通报, 2014(12): 201-206.
[ 6 ] Gross A, Ong T R, Grant R, et al. Human aldehyde dehydroge⁃nase-catalyzed oxidation of ethylene glycol ether aldehydes[J]. Chem Biol Interact, 2009, 178(1-3): 56-63.
[ 7 ] Yao Z, Zhang C, Lu F, et al. Gene cloning, expression, and char⁃acterization of a novel acetaldehyde dehydrogenase from Issatch⁃enkia terricola strain XJ-2[J]. Appl Microbiol Biotechnol, 2012, 93(5): 1999-2009.
[ 8 ]黄锟,赵玉凤,赵锦,等.人乙醛脱氢酶2基因在毕赤酵母SMD1168中的表达研究[J].中国医药生物技术, 2010(1): 44-48.
[ 9 ]赵锦,赵玉凤,黄锟,等.人乙醛脱氢酶2基因在毕赤酵母中的高效表达[J].化学与生物工程, 2010(2): 50-52.
[10]李青松,李一峰,邵敏华,等.不同基因型的人类乙醛脱氢酶2基因的克隆及表达(英文)[J].复旦学报:自然科学版, 2004(6): 1079-1083.
[11] Donovan R S, Robinson C W, Glick B R. Review: Optimizing in⁃ducer and culture conditions for expression of foreign proteins un⁃der the control of the lac promoter[J]. J Ind Microbiol, 1996, 16 (3): 145-154.
[12] Vasiliou V, Nebert D W. Analysis and update of the human alde⁃hyde dehydrogenase (ALDH) gene family[J]. Hum Genomics, 2005, 2(2): 138-143.
[13]陈瑞,方剑,王静涵.乙醛脱氢酶2基因在毕赤酵母中的表达和分离纯化[J].生物加工过程, 2013(6): 34-37.
[14]孙莉,李智博,秦飞,等.人乙醛脱氢酶2的原核表达及其条件优化[J].基因组学与应用生物学, 2012(2): 123-128.
[15]毕智丽. pTYB11载体的应用及其重组子破菌条件的研究[J].科技信息, 2012(5): 20-34.
[16] Zhu Y, Pan J, Qiu J, et al. Optimization of nutritional require⁃ments for mycelial growth and sporulation of entomogenous fun⁃gus Aschersonia aleyrodis Webber[J]. Braz J Microbiol, 2008, 39 (4): 770-775.
[17] Orlovs'Ka I V, Hrabchenko N I, Spivak M. Optimization of culti⁃vation conditions for strains of Escherichia coli-a producer of recombinant alpha-2b-interferon[J]. Mikrobiol Z, 2007, 69(2): 50-55.
Expression of recombinant human aldehyde dehydrogenase 2 by using intein induced expression system
LIU Xiangyu, YIN Jiechao, LI Jingpeng (School of Life Sciences, Northeast Agricultural University, Harbin 150030, China)
Abstract:To achieve the recombinant human aldehyde dehydrogenase 2 proteins with high activity, the ALDH2 gene was amplified by PCR. The cloned and expressed plasmids pGEM-T-ALDH2 and pTYB11-ALDH2 were constructed. The recombinant expression plasmids was induced by IPTG. Through orthogonal experiment, the results showed that the optimal strategy was the expression conditions (OD 0.3, 1.0 mmol·L-1IPTG, 30℃, 4 h). Because all the target proteins were almost expressed in the form of inclusion body, the bioactive acetaldehyde dehydrogenase was obtained by means of degeneration and renaturation for the inclusion body. Using the IMPACTTM-CN protein purification system, the similar natural ALDH2 protein was obtained from the self cleavage of fused intein protein, and the protein concentration was 0.045 mg·mL-1by the Bradford method. The activity of purification protein was 462 U·mg-1.
Key words:human aldehyde dehydrogenase 2; intein; recombinant expression; inclusion body; IMPACTTM-CN protein purification system
*通讯作者:李景鹏,教授,博士生导师,研究方向为基因工程与分子生物学。E-mail: lijingpeng@163.com
作者简介:刘向宇(1979-),女,实验师,硕士,研究方向为分子生物学。E-mail: lily_liu1979@126.com
基金项目:黑龙江省科技厅应用技术研究与开发计划项目(2013GC13C105)
收稿日期:2015-09-14
中图分类号:Q78
文献标志码:A
文章编号:1005-9369(2016)01-0038-07

