姜黄素与顺铂联合应用对胃癌SGC-7901的体外抑制作用
范双娜,卢 洁
浙江省舟山医院药剂科,浙江 舟山 316021
姜黄素与顺铂联合应用对胃癌SGC-7901的体外抑制作用
范双娜,卢洁
浙江省舟山医院药剂科,浙江 舟山 316021
[摘要]目的观察姜黄素、顺铂对胃癌SGC-7901细胞的生长抑制作用,并探究其机制。方法体外培养胃癌SGC-7901细胞,姜黄素、顺铂分别单独应用及联合应用后,采用MTT法检测细胞凋亡情况;RT-PCR检测T-Akt、p-Akt、p53 mRNA表达水平的变化;Western blot检测Bcl-2蛋白表达水平变化。结果MTT结果显示,姜黄素、顺铂均可抑制胃癌SGC-7901细胞的增殖,且呈浓度和时间依赖性(P<0.05),且联合组肿瘤细胞的凋亡率明显高于单药组(P<0.01);RT-PCR检测显示,与单独给药组相比,联合用药在显著上调T-Akt和p53 mRNA表达的同时,降低p-Akt mRNA的表达(P<0.01)。Western blot结果显示,单独给药、联合用药均能降低SGC-7901细胞中Bcl-2蛋白的表达。结论姜黄素与顺铂均能通过诱导细胞凋亡,抑制胃癌SGC-7901细胞生长,联合用药抑制SGC-7901细胞的增殖可能是通过抑制p-Akt基因、Bcl-2蛋白表达,同时上调T-Akt和p53基因的表达来实现的。
[关键词]胃癌SGC-7901细胞;顺铂;姜黄素;T-Akt;p-Akt;p53;Bcl-2
0引言
胃癌是最常见的恶性肿瘤之一,因其高死亡率而备受关注。目前临床使用的化疗药物如顺铂对胃癌有一定疗效,但由于存在较严重的毒副作用,可导致患者身体无法耐受而影响临床治疗效果。因此,寻找更有效、毒副反应更轻的治疗方案是迫切需要解决的问题。姜黄素(Curcumin)是一种酚类色素,是中药姜黄的主要活性成分之一,因其所具有的抗炎、抗氧化、促进细胞凋亡、抗肿瘤等作用,在多种恶性肿瘤(如肝癌、胃癌、肺癌等)的治疗中均发挥了重要作用[1-4]。目前姜黄素与化疗药物联合应用对胃癌的作用研究较少,本文拟探讨姜黄素与化疗药物-顺铂的相互作用关系,为临床应用提供实验室依据。
1材料与方法
1.1仪器和试剂HEPA二氧化碳培养箱:美国Thermo公司;四甲基偶氮唑盐(MTT):美国Sigma公司;RPMI-1640培养液:美国Gibco公司;小牛血清(FBS):杭州天杭生物科技有限公司;胰酶:美国Sigma公司;二甲基亚砜(DMSO):分析纯,天津市永大化学试剂有限公司;兔抗人Bcl-2单抗购自Abcam公司;SYBR Green 荧光定量试剂盒:杭州宝赛生物公司;细胞株:胃癌SGC-7901细胞,购自南京凯基生物科技有限公司。
1.2SGC-7901细胞培养胃癌SGC-7901细胞用含10% FBS的RPMI-1640培养液(含双抗),于37 ℃、5% CO2培养箱内培养,每2 d更换培养液,以0.25%胰蛋白酶(含0.02%EDTA)消化细胞并传代,所有实验均在细胞对数生长期进行。
1.3姜黄素溶液的配制取少量DMSO溶解姜黄素粉末,使制成浓度为10 mg/mL的储备液,于-20 ℃保存备用。
1.4MTT 测定
1.4.1不同浓度姜黄素干预不同时间对SGC-7901细胞增殖的影响收集对数生长期的SGC-7901细胞,弃旧培养液,洗涤,0.25%胰蛋白酶消化后计数,收集并用RPMI-1640培养液调整细胞浓度为1×105个/mL,接种于96孔培养板中,每孔150 μL,置CO2培养箱内培养;正常培养24 h待细胞贴壁后,分别设空白对照组(不加药物的培养基)、药物组,每组8个复孔。药物组为含有不同浓度姜黄素的培养液,姜黄素浓度分别为5、10、20、40、80 μg/mL。置37 ℃、5 % CO2培养箱中分别培养12、24、48 h后,每孔加MTT 20 μL,继续培养4 h后取出,倾去孔内液体,每孔加200 μL DMSO,充分振荡混匀使结晶物充分溶解,于酶标仪570 nm处测定各孔吸收值(A),空白孔调零,以正常组吸收值为对照,取平均值,计算各孔细胞抑制率(Inhibitory rate,IR%)=(1-实验组/正常组)×100%。
1.4.2不同浓度顺铂干预不同时间对SGC-7901细胞增殖的影响设顺铂组终浓度分别为0.5、1.0、2.0、4.0、8.0 μg/mL。其余实验步骤同“1.4.1”。
1.4.3姜黄素与顺铂联合应用干预不同时间对SGC-7901细胞增殖的影响取对数生长期的SGC-7901细胞消化后,制成1×105个/mL细胞悬液,接种于96孔培养板中,每孔150 μL,培养24 h后,根据“1.4.1”与“1.4.2”的实验结果,选择适宜浓度的姜黄素与顺铂联合给药。分别设空白对照组、联合给药组。其余实验步骤同“1.4.1”。
1.5RT-PCR检测细胞内T-Akt、p-Akt、p53 mRNA水平收集并调整细胞浓度为5×105个/mL,接种于25 mL培养瓶中,设正常组、姜黄素组、顺铂组、联合给药组,培养48 h后,收集各组细胞,按照Trizol试剂说明书提取细胞总RNA,逆转录合成cDNA,之后进行PCR反应。引物设计见表1。
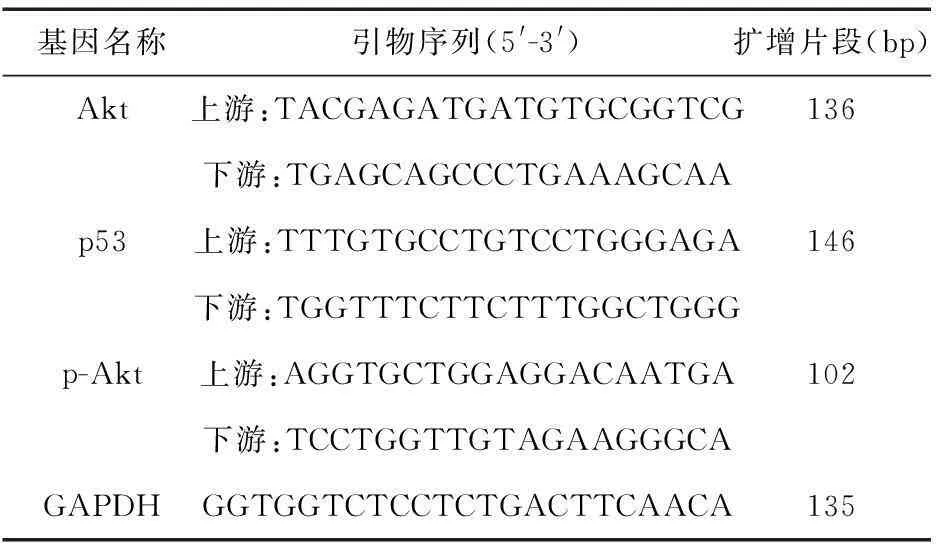
表1 扩增用的引物序列
1.6Western blot 检测MMP-2蛋白的表达收集并调整细胞浓度为5×105个/mL,接种于25 mL培养瓶中,设空白对照组、药物组,培养48 h后,收集各组细胞,提取各组细胞总蛋白,BCA法进行蛋白定量,将蛋白样品上样到SDS-PAGE胶加样孔后电泳,转膜,封闭液室温封闭2 h,加入一抗(1∶500),4 ℃孵育过夜,洗膜后加入二抗室温孵育2 h,滴加ECL液冲洗显色检测Bcl-2蛋白条带。同时以β-actin作为内参照。

2结果
2.1姜黄素对SGC-7901细胞生长抑制作用不同浓度姜黄素干预SGC-7901细胞12、24、48 h后,SGC-7901细胞的生长繁殖均受到不同程度的抑制,抑制程度呈浓度、时间依赖性。见表2。由表2可见,与空白组比较,5 μg/mL姜黄素作用24 h后,SGC-7901细胞活力明显受到抑制(P<0.05),达17.4%;作用48 h后,抑制作用更加显著(P<0.01),达32.3%;姜黄素浓度为80 μg/mL时,作用48 h后,抑制作用更加显著(P<0.01),达76.9%。结果显示,随着姜黄素浓度的增加及作用时间的延长,SGC-7901细胞的损伤程度越明显。
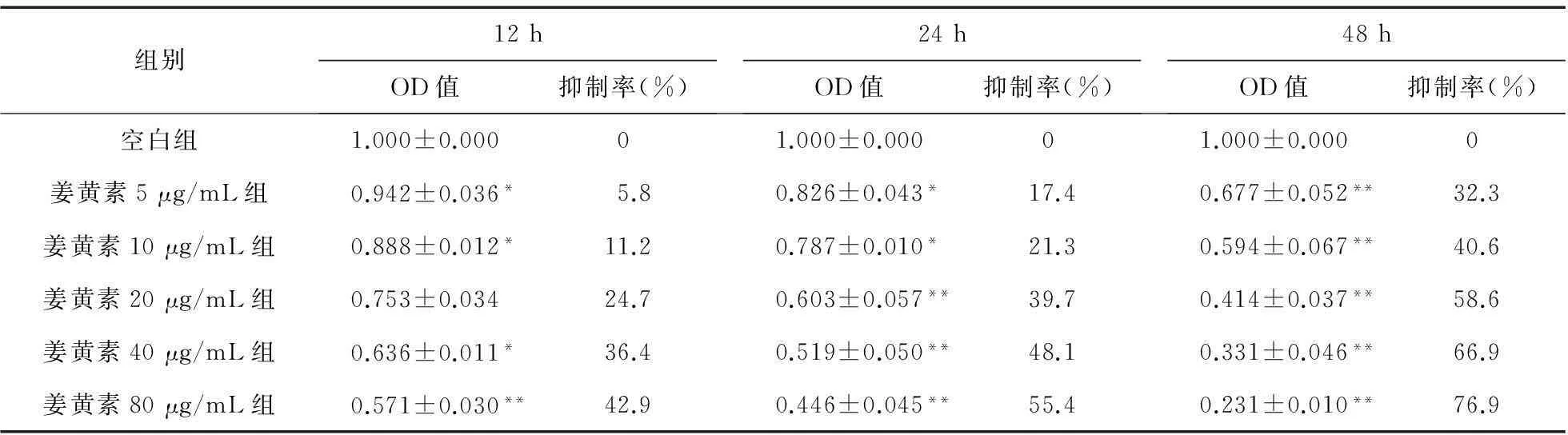
表2 不同浓度姜黄素对SGC-7901细胞生长抑制作用(n=8)
注:与空白组比较,*P<0.05,**P<0.01
2.2化疗药物对SGC-7901细胞的生长抑制作用随着化疗药物浓度的增加及作用时间的延长,SGC-7901细胞的生长均受到不同程度的抑制,0.5 μg/mL顺铂作用24 h后,SGC-7901细胞活力明显受到抑制(P<0.05),达21.2%;8.0 μg/mL顺铂作用48 h后,抑制作用更加显著,差异有统计学意义(P<0.01),达77.3%,且呈剂量、时间依赖性。见表3。
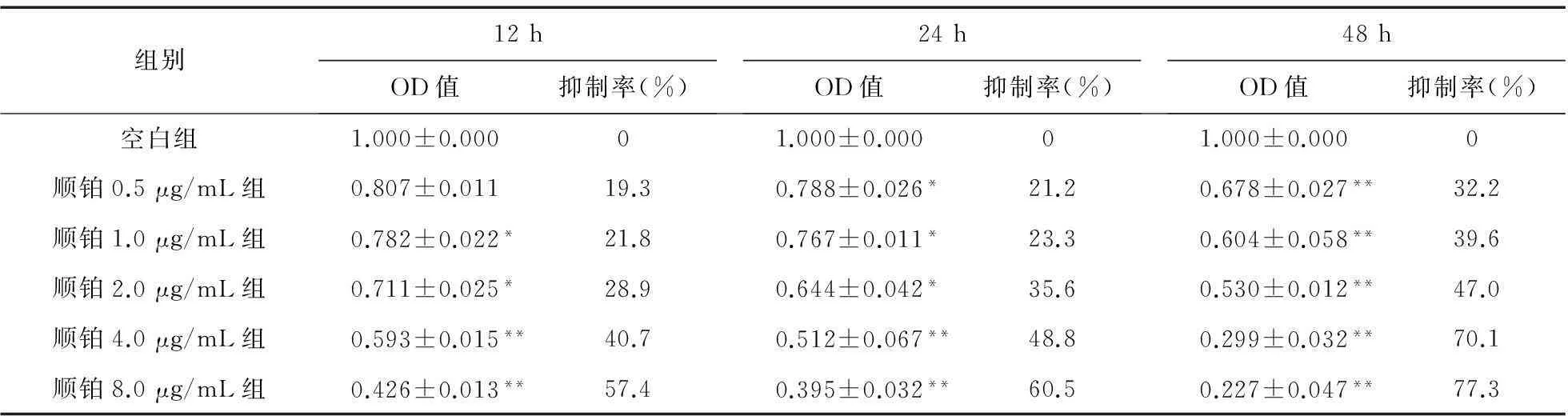
表3 不同浓度顺铂对SGC-7901细胞生长抑制作用(n=8)
注:与空白组比较,*P<0.05,**P<0.01
2.3联合用药对SGC-7901细胞生长抑制作用姜黄素(10 μg/mL)与顺铂(2.0 μg/mL)联合作用于SGC-7901细胞,随着作用时间的延长,SGC-7901细胞的增殖明显受到抑制,且与单独应用姜黄素和顺铂相比,联合用药对SGC-7901细胞增殖的抑制作用更加显著(P<0.01)。见表4。
2.4T-Akt、p-Akt和p53 mRNA表达水平的变化姜黄素、顺铂及两者联合处理SGC-7901细胞48 h后,RT-PCR结果表明,给药组p-Akt mRNA随浓度增加呈现出下降趋势,而T-Akt、p53呈上升趋势。见图1。姜黄素组、顺铂组及联合用药组p-Akt mRNA表达水平分别是空白组的(0.72±0.21)、(0.51±0.22)、(0.33±0.13)倍,差异有统计学意义(P<0.05);T-Akt mRNA表达水平分别是空白组的(1.29±0.31)、(1.35±0.43)、(1.9±0.11)倍,差异有统计学意义(P<0.05);p53 mRNA表达水平分别是空白组的(1.38±0.08)、(1.53±0.43)、(2.85±0.39)倍,差异有统计学意义(P<0.05)。与单独用药组相比,联合用药组T-Akt、p-Akt和p53 mRNA表达差异亦有统计学意义(P<0.01)。总之,姜黄素联合顺铂给药可以下调SGC-7901细胞p-Akt mRNA的表达,上调p53和T-Akt mRNA的表达量。结果表明,姜黄素联合顺铂对SGC-7901细胞p-Akt和p53 mRNA表达量的影响有可能通过调节Akt的活性来实现。

表4 联合用药对SGC-7901细胞的生长抑制作用(n=8)
注:与空白组比较,*P<0.05,**P<0.01;与联合用药组比较,#P<0.05,##P<0.01
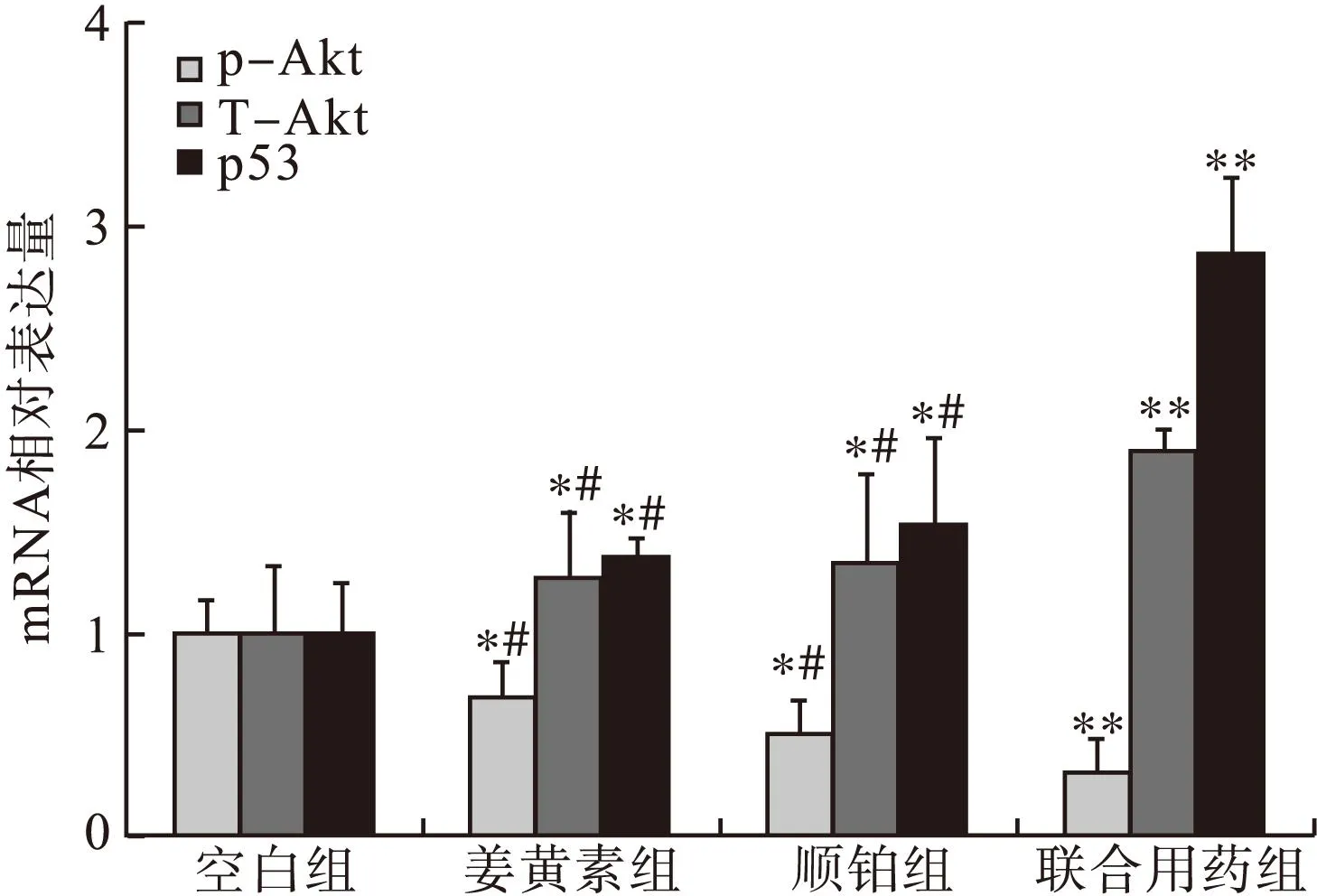
图1 RT-PCR检测p-Akt、T-Akt及p53的mRNA 表达水平的变化
2.5药物干预对SGC-7901细胞中Bcl-2蛋白表达的影响姜黄素、顺铂及联合用药分别作用于SGC-7901细胞48 h后,均可使Bcl-2 蛋白表达水平下降,与空白组比较,差异有统计学意义(P<0.05);联合用药组与单独用药组比较,Bcl-2蛋白表达差异亦有统计学意义(P<0.05),见图2。

图2 药物干预对SGC-7901细胞中Bcl-2蛋白表达的影响
3讨论
肿瘤的发生发展是多步骤、多基因突变累积的结果,细胞凋亡调控机制失常是引发肿瘤的重要原因。细胞凋亡分为内源性途径和外源性途径,两个途径均在细胞凋亡中发挥着重要作用,是抗肿瘤药物诱导肿瘤细胞死亡最常见的形式。细胞凋亡与激活某些基因的表达及调控信号通路密切相关,促进细胞凋亡可有效抑制肿瘤生长[5-6]。因此,通过调控基因及信号通路已成为抗肿瘤研究的新方向。
PI3K/Akt是人体细胞内重要的信号转导通路之一,广泛参与细胞的各项生理病理功能活动。PI3K/Akt通路的活化在肿瘤发生中表现为抑制细胞凋亡。p-Akt是Akt的功能活化状态,Akt只有在活化状态时才具有生物学功能。活化的Akt可以进一步活化促凋亡蛋白Bax等,释放抗凋亡蛋白,增加胞浆中游离的抗凋亡蛋白Bcl-2的量[7]。Bcl-2和Bax基因均是一类癌基因家族成员,与肿瘤细胞的凋亡密切相关[8]。Bax是Bcl-2的同源基因,可与Bcl-2形成异源二聚体,促进凋亡[9]。Bcl-2/Bax比值维持在一定的范围可以维持内环境的稳定,当受到一定的外来刺激时可引起DNA损失,Bcl-2/Bax比值明显上升,最终导致细胞凋亡[10]。一些化疗药物正是通过抑制Bcl-2和/或上调Bax基因表达发挥抗肿瘤效应。p53基因是重要的抑癌基因,p53蛋白磷酸化后即被激活,磷酸化p53蛋白通过调控细胞周期及诱导细胞凋亡发挥抑癌作用[11]。在临床上对恶性肿瘤的治疗多采用联合用药方案,以期减少用药量,进而降低毒副作用。有研究表明,姜黄素可抑制肿瘤细胞的增殖,其抗肿瘤作用主要与其抑制肿瘤细胞增殖、转移,诱导肿瘤细胞凋亡有关[12]。MTT结果表明,姜黄素、顺铂均能够显著抑制胃癌细胞SGC-7901的增殖,并且随着药物浓度、作用时间的增加,姜黄素、顺铂对SGC-7901 细胞的抑制逐渐增强,姜黄素浓度达10 μg/mL时,作用12、24、48 h后,细胞凋亡率分别为11.2%、21.3%、40.6%;顺铂浓度达2.0 μg/mL时,作用12、24、48 h后,细胞凋亡率分别为28.9%、35.6%、47.0%。而姜黄素和顺铂联合应用后细胞的凋亡率显著增高,作用24、48 h后,SGC-7901 细胞凋亡率分别为55.7%、67.8%,说明联合用药可协同抑制胃癌细胞的增殖。本研究通过RT-PCR检测p-Akt、T-Akt和p53 mRNA的表达,姜黄素组、顺铂组及联合用药组p-Akt mRNA表达水平分别是空白组的(0.72±0.21)、(0.51±0.22)、(0.33±0.13)倍;T-Akt mRNA表达水平分别是空白组的(1.29±0.31)、(1.35±0.43)、(1.90±0.11)倍;p53 mRNA表达水平分别是空白组的(1.38±0.08)、(1.53±0.43)、(2.85±0.39)倍,差异有统计学意义(P<0.05);与单独用药组、空白组比较,联合用药组p-Akt mRNA的表达明显降低,p53和T-Akt mRNA的表达增高;Western blot检测结果显示,与单独用药组比较,联合用药组Bcl-2蛋白的表达显著下调。结果表明,诱导SGC-7901细胞发生凋亡可能是姜黄素和顺铂联合抑制胃癌细胞增殖的作用机制之一。
总之,本研究结果表明,将姜黄素与化疗药物联合使用,不仅可降低化疗药物的使用量,降低毒副反应,还能达到满意的疗效,这一发现为姜黄素应用于临床提供了理论支持,而两药联合应用抗胃癌的作用机制则需进行更深入的研究。
参考文献:
[1]Saxena V,Hussain MD.Polymeric mixed micelles for delivery of curcumin to multidrug resistant ovarian cancer [J].J Biomed Nanotechnol,2013,9(7):1146-1154.
[2]Kim HJ,Park SY,Park OJ,et al.Curcumin suppresses migration and proliferation of Hep3B hepatocarcinoma cells through inhibition of the Wnt signaling pathway[J].Mol Med Rep,2013,8(1):282-286.
[3]Kaushik G,Kaushik T,Yadav SK,et al.Curcumin sensitizes lung adenocarcinoma cells to apoptosis via intracellular redox status mediated pathway[J].Indian J Exp Biol,2012,50(12):853-861.
[4]Mo N,Li ZQ,Li J,et al.Curcumin inhibits TGF-β1 induced MMP-9 and invasion through ERK and Smad signaling in breast cancer MDA-MB-231 cells[J].Asian Pac J Cancer Prev,2012,13(11):5709-5714.
[5]Wang P,Zhang K,Zhang Q,et al.Effects of quercetin on the apoptosis of the human gastric carcinoma cells[J].Toxicol In Vitro,2012,26:221-228.
[6]Zhang L,Tao L,Ruan J,et al.Xanthatin induces G2/M cell cycle arrest and apoptosis in human gastric carcinoma MKN-45 cells[J].Planta Med,2012,78:890-895.
[7]Sawa H,Kobayashi T,Mukai K,et al.Bax overexpression enhances cytochrome c release from mitochondria and sensitizes KATOIII gastric cancer cells to chemotherapeutic agent-induced apoptosis[J].Int J Oncol,2000,16(4):745-754.
[8]陈小娟,侯桂兰,李清林,等.RT-PCR检测抗癌扶正协定方对C57 /BL6J小鼠Lewis肺癌肿块细胞中bax/bcl-2以及Th1/Th2基因表达的影响[J].中华中医药学刊,2014,32(10):2412-2415.
[9]Yuen HF,Chan KK,Grills C,et al.Ran is a potential therapeutic target for cancer cells with molecular changes associated with activation of the PI3K/Akt/mTORC1 and Ras/ MEK/ERK pathways[J].Clin Cancer Res,2012,18(2):380-391.
[10]Hoshyar R,Bathaie SZ,Sadeghizadeh M.Crocin triggers the apoptosis through increasing the Bax/Bcl-2 ratio and caspase activation in human gastric adenocarcinoma,AGS,cells[J].DNA Cell Biol,2013,32(2):50-57.
[11]Taira N,Yoshida K.Post-translational modifications of p53 tumor suppressor:determinants of its functional targets[J].Histol Histopathol,2012,27(4):437-443.
[12]Carmeliet P,Jain RK.Molecular mechanisms and clinical applications of angiogenesis[J].Nature,2011,473(7347):298-307.
Inhibitory effect of curcumin combined with cisplatin on the proliferation of gastric cancer cells SGC-7901invitroFAN Shuang-na,LU Jie (Department of Pharmacy,Zhoushan Hospital,Zhoushan 316021,China)
[Abstract]ObjectiveTo investigate the inhibitory effects of curcumin combined with cisplatin on the proliferation of gastric cancer cells SGC-7901.MethodsSGC-7901 cells were cultured in vitro. The single use of curcumin and cisplatin and the combination use were applied on gastric cancer cells SGC-7901 respectively. The inhibitory rate of cells was measured by MTT assays. T-Akt,p-Akt and p53 mRNA expression levels were tested by real time PCR. Bcl-2 protein level was detected by Western blot.ResultsThe viability of SGC-7901 cells was reduced by curcumin and cisplatin in a concentration-/time-dependent manner (P<0.05). The tumor cell apoptosis rate of combination group was significantly higher than those of single drug groups (P<0.01). RT-PCR results showed that the expression levels of T-Akt and p53 mRNA in combination group were higher than those of single drug groups,while the expression level of p-Akt mRNA was lower. Expression levels of Bcl-2 protein in SGC-7901 cells of the three groups decreased.ConclusionBoth curcumin and cisplatin can inhibit the SGC-7901 cells growth by inducing apoptosis of cells. The inhibition on the proliferation of SGC-7901 cells treated by curcumin combined with cisplatin in vitro may be induced by inhibiting the expression of p-Akt gene and Bcl-2 protein,enhancing the expression of T-Akt and p53 gene.
Key words:Gastric cancer cells SGC-7901;Cisplatin;Curcumin;T-Akt;p-Akt;p53;Bcl-2
DOI:10.14053/j.cnki.ppcr.201602002
收稿日期:2015-05-25

