紫杉醇联合顺铂新辅助化疗在早中期宫颈癌治疗中的临床应用
李 翔,鲁艳明,张 瑶
中国医科大学附属盛京医院妇产科,沈阳 110004
紫杉醇联合顺铂新辅助化疗在早中期宫颈癌治疗中的临床应用
李翔*,鲁艳明,张瑶
中国医科大学附属盛京医院妇产科,沈阳 110004
[摘要]目的研究紫杉醇联合顺铂新辅助化疗在早中期宫颈癌治疗中的应用价值。方法选择我院2012年8月至2014年12月收治住院的82例早中期宫颈癌患者的临床资料,根据数字随机分组法原则,将患者分为观察组与对照组,每组41例。对照组术前不给予辅助化疗,直接行宫颈癌根治术,术后补充化疗;观察组采用新辅助化疗(术前给予紫三醇+顺铂静脉化疗2个周期),化疗结束后3周,行宫颈癌根治手术,术后补充化疗(同对照组)。比较两组患者的近期治疗效果、不良反应发生情况。结果观察组总有效率为56.09%,对照组总有效率为31.70%,两组比较差异有统计学意义(P<0.05)。观察组、对照组分别有21、15例患者发生不良反应,不良反应发生率分别为51.22%、36.59%,两组比较差异无统计学意义(P>0.05)。结论紫杉醇联合顺铂新辅助化疗对早中期病灶较大的宫颈癌的效果较好,可提高临床治疗有效率,且不良反应发生率与对照组无显著差异,值得临床推广应用。
[关键词]新辅助治疗;紫杉醇;顺铂;宫颈癌
0引言
宫颈癌在妇科恶性肿瘤中较为常见,且其发生具有年轻化倾向。保留卵巢功能的宫颈癌根治手术在年轻宫颈癌患者的治疗中成为首选。而如果患者肿瘤体积较大,会使得手术治疗难度提高,增加手术并发症的发生;如果没有及时采取措施对肿瘤进行有效控制,则会增加转移、复发的风险[1-2]。近年来,新辅助化疗技术在宫颈癌治疗中的应用效果较好,可大大提升临床疗效[3-9]。为了解紫杉醇联合顺铂新辅助化疗在病灶较大的早中期宫颈癌治疗中的临床应用效果,笔者对我院妇科手术病房、妇科肿瘤病房的82例住院病例进行分析,现将结果报道如下。
1资料与方法
1.1一般资料选择我院2012年8月至2014年12月收治的82例早中期宫颈癌住院患者为研究对象,根据随机分组法原则,将患者分为观察组与对照组,每组41例。对照组术前不给予新辅助化疗;年龄23~60岁,平均(45.19±10.42)岁;病理分型:腺癌患者11例,鳞癌患者30例;肿瘤直径2.9~6.5 cm,平均(4.51±0.28)cm;肿瘤分期:Ⅰb型患者24例,Ⅱa型患者17例。观察组采用紫杉醇联合顺铂新辅助化疗;年龄21~61岁,平均(45.32±10.15)岁;病理分型:腺癌患者12例,鳞癌患者29例;肿瘤直径2.5~6.4 cm,平均(4.26±0.59) cm;肿瘤分期:Ⅰb型患者21例,Ⅱa型患者20例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2治疗方法
1.2.1对照组术前不给予新辅助化疗,直接行广泛性子宫切除及盆腔淋巴清扫术,年轻患者行双侧卵巢组织剖解,若阴性,行双侧卵巢悬吊术。术后根据术中所见、术后病理、危险因素等给予术后补充化疗。
1.2.2观察组术前采用新辅助化疗。新辅助化疗:紫杉醇(紫杉醇注射液,扬子江有限公司) 135~175 mg/m2+500 mL 0.9%氯化钠注射液,顺铂(注射用冻干型顺铂,齐鲁制药有限公司) 70 mg/m2+500 mL 0.9%氯化钠注射液,静脉滴注。化疗前12、6 h,分别予10 mg地塞米松脱敏治疗;化疗期间同时予患者奥美拉唑及天晴甘美等药物保胃保肝治疗,首次使用紫杉醇治疗时,先行低浓度小剂量紫杉醇静滴试敏治疗,使用顺铂,同时予患者静脉水化治疗,治疗期间密切监测患者生命体征,若化疗期间出现不良反应,及时停药,并采取处理措施。患者化疗2个疗程,每次用药间隔21 d。化疗结束后21 d,患者接受手术治疗,术后补充化疗(手术原则与术后补充化疗原则、方案同对照组)。
1.3观察指标分析两组患者的治疗效果、不良反应发生情况,并进行对比。治疗效果评价标准[3]:采用实体瘤疗效评价标准。完全缓解(CR):患者经治疗后,影像学及血清学肿瘤彻底消失,并持续至少4周;部分缓解(PR):经治疗后,患者的病灶缩小超过30%,持续至少4周;稳定(SD):介于疾病进展及部分缓解之间,肿瘤最大径之和缩小未达PR,或增大未达PD;进展(PD):经治疗后,患者的病灶最大径线超过≥20%,或出现新病灶,但原病灶分裂不计在内。完全缓解和部分缓解为有效,稳定和进展为无效。

2结果
2.1两组治疗效果比较观察组的总有效率(完全缓解+部分缓解)为56.09%,对照组的总有效率为31.70%,两组比较差异有统计学意义(P<0.05)。见表1。
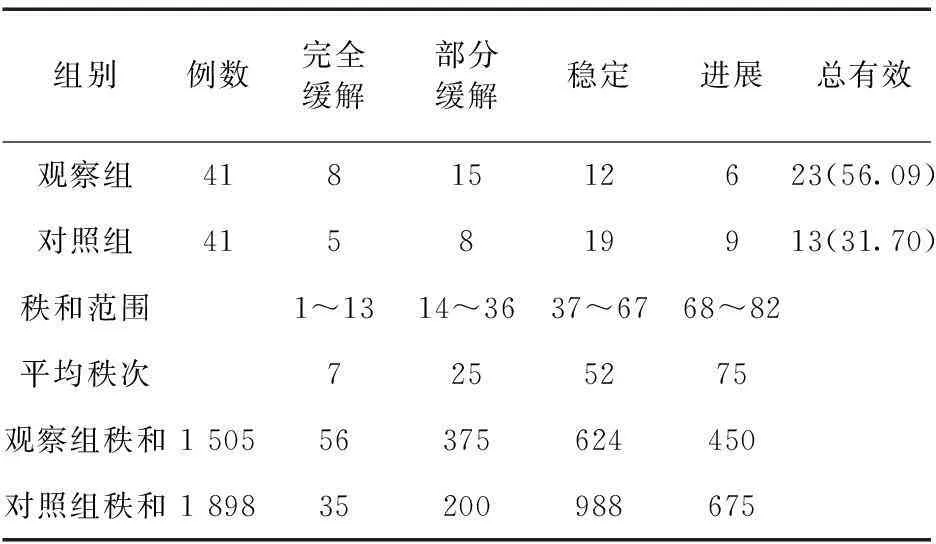
表1 两组患者的临床疗效对比(例,%)
注:Z=2.032,C=0.914,Zc=2.126
由表1可见,Zc>1.96,P<0.05,差异有统计学意义,表明两种治疗方案疗效分布不同,治疗效果差异有统计学意义;观察组平均秩次为36.71,对照组为46.29,观察组疗效较好。
2.2不良反应发生情况观察组发生不良反应21例,其中神经毒性反应4例、胃肠道反应6例、骨髓抑制11例,不良反应发生率为51.22%。对照组发生不良反应15例,其中神经毒性反应2例、胃肠道反应7例、骨髓抑制6例,不良反应发生率为36.59%。两组患者化疗药物不良反应发生率比较差异无统计学意义(P>0.05)。见表2。

表2 两组患者不良反应比较(例,%)
3讨论
近年来,宫颈癌的发生率呈逐年上升、低龄化趋势,对女性的健康造成很大威胁。而宫颈癌患者整体生存情况并不理想。以往传统治疗方法手术+补充放化疗或根治性放化疗可取得一定疗效,控制复发率,延长部分患者的生存时间,控制转移率[9-10]。
随着研究的不断深入,新辅助化疗已用于多种恶性肿瘤的治疗中。在宫颈癌的治疗中,大部分患者经2~3个周期新辅助化疗后,能够缩小瘤体[11-14],改善宫旁组织浸润程度,使宫旁组织柔软有弹性,降低肿瘤临床分期,从而扩大手术适应证,为病灶较大的早中期年轻宫颈癌患者争取手术机会,同时为手术提供良好条件,降低手术难度及损伤风险,减少手术并发症的发生率。近年来,新辅助化疗联合手术治疗已逐渐成为宫颈癌的主要治疗方式之一,Chen等[15]研究表明,新辅助化疗联合手术治疗局部晚期宫颈癌患者的5年总生存率可达到45%~83%。新辅助化疗可促使肿瘤细胞活力降低,将未转移病灶抑制或者清除,减少或清除肿瘤部分微小病灶,有效控制肿瘤细胞短期内的转移及疾病复发[16-18]。但对于患者远期生存期限是否有所改善,暂无定论。
紫杉醇是新型抗微管药物,通过促进微管蛋白聚合抑制解聚,保持微管蛋白稳定,抑制肿瘤细胞有丝分裂,降低肿瘤细胞繁殖,促进肿瘤细胞凋亡。体外研究表明,紫杉醇具有显著的放射增敏作用,可能使细胞中止于对放疗敏感的G2和M期。顺铂属于铂金属络合物,为细胞周期非特异性抗癌药物,主要作用点是增生细胞DNA,可与肿瘤细胞的DNA上碱基结合,使DNA分子链内和链间交叉键联,抑制癌细胞DNA合成及修复,现已广泛应用于多种恶性肿瘤治疗中,且临床作用明显。资料显示,顺铂在宫颈癌化疗中单独应用的有效率为23%~50%,且顺铂与紫杉醇协同使用不产生交叉耐药现象[19],可有效缩小肿瘤病灶,使肿瘤细胞对放疗敏感性增加,达到放疗增敏剂效果。TP(杉醇+顺铂)现已成为国际上公认的抗恶性肿瘤一线药物,广泛应用于女性乳腺癌、宫颈癌等的治疗中[20]。Zhang等[21]研究也证实,紫杉醇小剂量可直接诱导HeLa宫颈癌细胞凋亡,从而抑制细胞分裂,减轻毒性,与顺铂联合应用的近期治疗效果明显。李雪梅等[22]研究表明,紫杉醇联合顺铂化疗治疗宫颈癌,可降低铂类药物的化疗不良反应(尤其是肾毒性、消化道反应等),增强抗肿瘤治疗效果,且不增加药物毒性。
本研究结果显示,观察组(术前接受新辅助化疗)的治疗效果优于对照组,两组比较差异有统计学意义(P<0.05)。在近期疗效研究中,患者接受静脉化疗后,可出现不同程度的化疗不良反应,如恶心、呕吐、腹泻、血象三系改变、肝肾功能异常及脱发、乏力等[23-24]。但本研究中的不良反应主要表现为骨髓抑制、胃肠道反应及神经毒性。其中,部分患者出现血液三系减少,主要表现为白细胞、中性粒细胞下降,其次为血小板下降,血红蛋白下降发生率最低;胃肠反应以恶心、呕吐为主,腹泻较少;神经毒性主要表现为四肢麻木,尤其以指尖明显。两组的化疗不良反应发生率比较差异无统计学意义(P>0.05)。但观察组患者的不良反应程度稍重,尤其表现在骨髓抑制程度上,没有Ⅳ骨髓抑制情况发生。各种不良反应患者均可耐受,且在短期内均可通过对症治疗缓解。刘少晓等[25]研究表明,紫杉醇联合顺铂的新辅助化疗可使局部晚期宫颈癌患者客观缓解率达71.88%,缩短手术时间及术中出血量,化疗毒副作用均在可控范围内,与本研究结论相似。综上所述,紫杉醇联合顺铂新辅助化疗治疗宫颈癌不仅可以达到更好的近期治疗效果[26-28],且治疗过程相对安全,值得临床推广。关于化疗药物种类、化疗周期、给药途径及手术时机的选择,还应根据患者的具体病情,制定个体化的治疗方案。
参考文献:
[1]任韧.新辅助化疗在宫颈癌治疗中的应用及临床价值分析[J].中国肿瘤临床与康复,2013,(12):1399-1401.
[2]李琳,周敏,成莉,等.局部晚期宫颈癌患者新辅助化疗疗效观察[J].临床和实验医学杂志,2014,(3):208-210.
[3]张蓉,李斌,白萍,等.紫杉醇联合铂类在局部晚期宫颈癌新辅助化疗中的应用[J].中华肿瘤杂志,2011,(33):616-620.
[4]He D,Duan C,Chen J,et al.The safety and efficacy of the preoperative neoadjuvant chemotherapy for patients with cervical cancer: a systematic review and meta analysis[J].Int J Clin Exp Med,2015,8(9):14693-14700.
[5]Cibula D.A novel perspective of neoadjuvant chemotherapy in locally advanced cervical cancer[J].Ann Surg Oncol,2015,Nov 24.[Epub ahead of print]
[6]Scandurra G,Scibilia G,Banna GL,et al.Efficacy and tolerability of paclitaxel, ifosfamide, and cisplatin as a neoadjuvant chemotherapy in locally advanced cervical carcinoma[J].J Gynecol Oncol,2015,26(2):118-124.
[7]Shu P,Shen Y,Zhao Y,et al.A phase I study of adjuvant intensity-modulated radiotherapy with concurrent paclitaxel and cisplatin for cervical cancer patients with high risk factors[J].Med Oncol,2015,32(11):247.
[8]Yin ZM,Yu AJ,Wu MJ,et al.Effects and toxicity of neoadjuvant chemotherapy preoperative followed by adjuvant chemoradiation in small cell neurdendocrine cervical carcinoma[J].Eur J Gynaecol Oncol,2015,36(3):326-329.
[9]张晓霞,刘萍,郭海荣.宫颈癌新辅助化疗的临床应用及其疗效的评价[J].中国医学创新,2014,4(4):144-146.
[10]刘云聪,张瑜,陈燕平.新辅助化疗治疗35例中晚期宫颈癌患者临床疗效观察[J].现代诊断与治疗,2014(8):1890-1891.
[11]付翔.新辅助化疗在中晚期宫颈癌术前的临床应用分析[J].中国民族民间医药,2013,(6):56.
[12]杨学刚,周石,李政文,等.不同途径新辅助化疗治疗年轻宫颈癌的疗效比较[J].介入放射学杂志,2015,24(4):342-346.
[13]Tsubamoto H,Maeda H,Kanazawa R,et al.Phase Ⅱ trial on neoadjuvant intravenous and trans-uterine arterial chemotherapy for locally advanced bulky cervical adenocarcinoma[J].Gynecol Oncol,2013,129:129-134.
[14]廖万清,汤新跃.术前新辅助化疗在局部晚期宫颈癌治疗中的临床价值[J].实用癌症杂志,2015,30(2):266-268.
[15]Chen H,Liang C,Zhang L,et al.Clinical efficacy of modified preoperative neoadjuvant chemotherapy in the treatment of locally advanced(stage IB2 to ⅡB)cervical cancer:randomized study[J].Gynecol Oncol,2008,110:308-315.
[16]沈佳惠,李胜泽.预测宫颈癌新辅助化疗的敏感性研究进展[J].中华全科医学,2014,12:1995-1997.
[17]雷蕾,张雪芬,吴大保,等.新辅助化疗治疗中晚期宫颈癌21例[J].中国临床保健杂志,2012,(4):404-405.
[18]孙晋瑞,梁东霞,何洁华,等.新辅助化疗对宫颈癌微血管和微淋巴管的影响及疗效分析[J].肿瘤,2011,31(12):1087-1092.
[19]候岩峰,程晓伟,承莉,等.术前新辅助化疗治疗局部晚期宫颈癌临床疗效的观察[J].肿瘤基础与临床,2011,(24):213-215.
[20]任锦霞,王小虎,赵林.紫杉醇+顺铂同步放化治疗局部中晚期宫颈癌的临床观察[J].兰州大学学报:医学版,2009,35(2):54-57.
[21]Zhang H,Peng W,Zhang Y.Detection of cell apoptosis in pelvic lymph nodes of patients with cervical cancer after neoadjuvant chemotherapy[J].J Int Med Res,2014,42:641-650.
[22]李雪梅.小剂量紫杉醇联合顺铂周疗方案治疗宫颈癌70例的疗效观察[J].贵阳中医学院学报,2013,35(4):101.
[23]何红芬.宫颈癌新辅助化疗临床应用及预后影响因素[J].航空航天医学杂志,2015,(2):204-222.
[24]刘弘扬,奈嫚嫚,封全灵,等.局部晚期宫颈癌术前新辅助化疗效果分析[J].广东医学,2014,35(4):556-558.
[25]刘少晓,程晓燕,郑红枫,等.紫杉醇联合顺铂新辅助治疗局部晚期宫颈癌的临床疗效及安全性评价[J].中国临床药理学杂志,2015,31(6):432-434.
[26]王文桃.紫杉醇联合顺铂对局部晚期宫颈癌新辅助化疗的近期疗效观察[J].中国现代药物应用,2015,9(9):165-166.
[27]Kong TW,Lee EJ,Lee Y,et al.Neoadjuvant and postoperative chemotherapy with paclitaxel plus cisplatin for the treatment of FIGO stage IB cervical cancer in pregnancy[J].Obstet Gynecol Sci,2014,57(6):539-543.
[28]Li Y,Wang X,Li J,et al.Combination therapy of liposomal paclitaxel and cisplatin as neoadjuvant chemotherapy in locally advanced cervical cancer[J].Eur J Gynaecol Oncol,2015,36(1):54-58.
Clinical application of neoadjuvant chemotherapy with paclitaxel and cisplatin in the treatment of early and middle stage cervical cancerLI Xiang*,LU Yan-ming,ZHANG Yao (Department of Gynecology and Obstetrics,Shengjing Hospital of China Medical University,Shenyang 110004,China)
[Abstract]ObjectiveTo study the clinical value of neoadjuvant chemotherapy (paclitaxel+cisplatin) in the treatment of early and middle stage cervical cancer.MethodsEighty two patients with early and middle stage cervical cancer in our hospital from August 2012 to December 2014 were divided into observation group and control group according to the principle of random,41 cases in each group.Patients in control group accepted radical hysterectomy for cervical cancer with postoperative complementary chemotherapy.Patients in observation group accepted neoadjuvant chemotherapy (patients were given paclitaxel before operation and treated with cisplatin chemotherapy for 2 cycles),radical surgery at 3 weeks after the end of chemotherapy,and postoperative supplementary chemotherapy (same as control group).The recent treatment efficacy and adverse reaction incidence between the two groups were compared.ResultsThe total effective rates in observation group and control group were 56.09% and 31.70%,there was significant difference between the two groups (P<0.05).There were 21 cases (51.22%) of adverse reaction in observation group and 15 cases (36.59%) in control group,no significant difference was found (P>0.05).ConclusionNeoadjuvant chemotherapy with paclitaxel and cisplatin has good effect on early and middle stage cervical cancer with large lesions.It can improve the efficiency of clinical treatment with good safety,it is worthy of clinical application.
Key words:Neoadjuvant therapy;Paclitaxel;Cisplatin;Cervical cancer
DOI:10.14053/j.cnki.ppcr.201602005
*通信作者
基金项目:国家自然科学基金(81202048)
收稿日期:2015-07-21

